(自用) 化学假期作业8讲评
T16
(1)
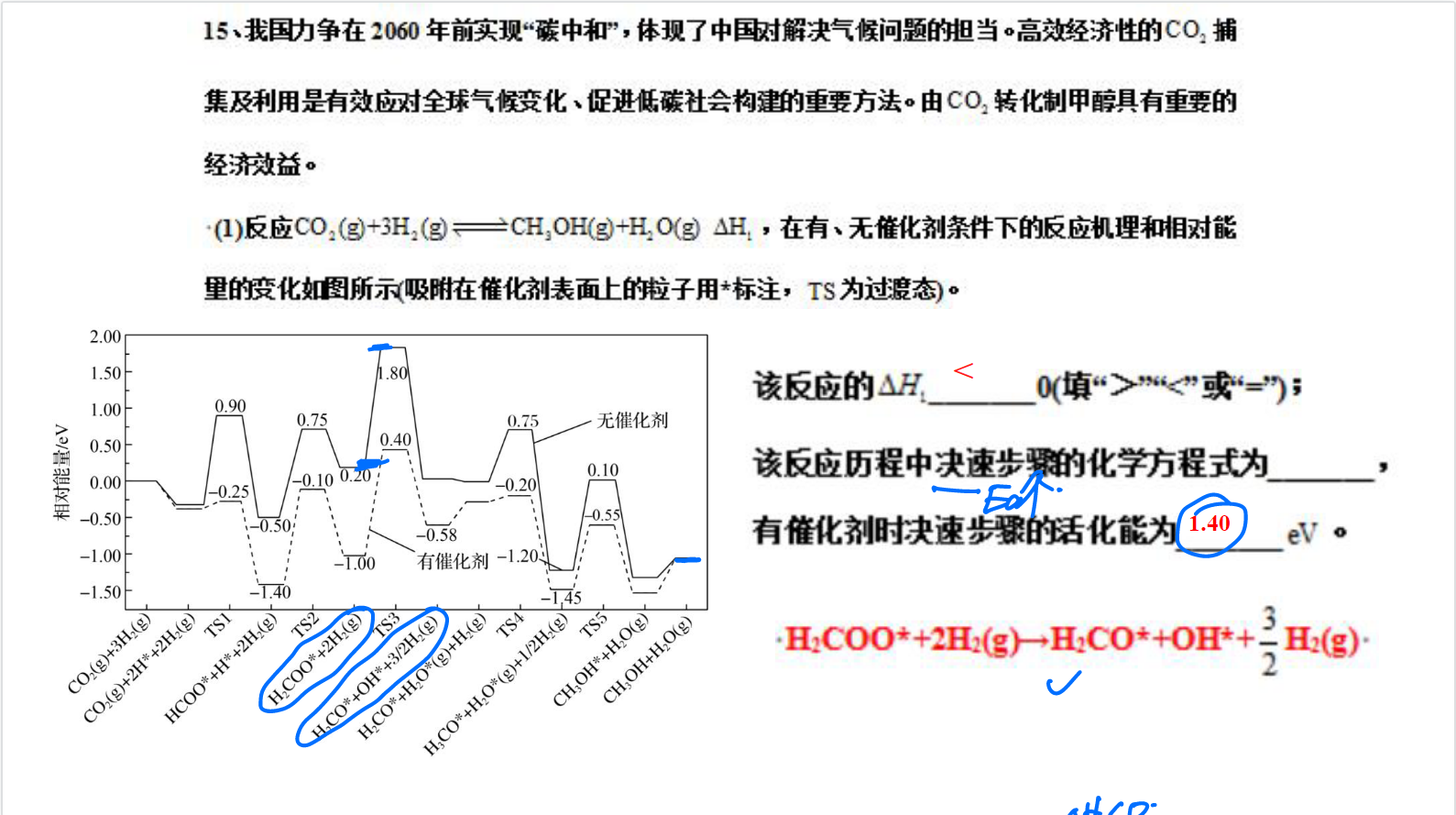
根据图可知,起始相对能量高于末态相对能量,说明反应放热,$\Delta\ H_1>0 $
根据决速步骤定义,决速步骤是反应机制中具有最高活化能的反应步骤,所以由图可知,决速步骤为 $$\ H_2COO^* \ +\ 2H_2 \ = \ H_2 \ + \frac{3}{2} \ H_2$$
相对应活化能即为\(\ H_2COO^* \ + \ 2H_2\)和\(\ \ TS3\)之间的差值为\(1.40eV\) (一般保留两位有效数字)
(2)
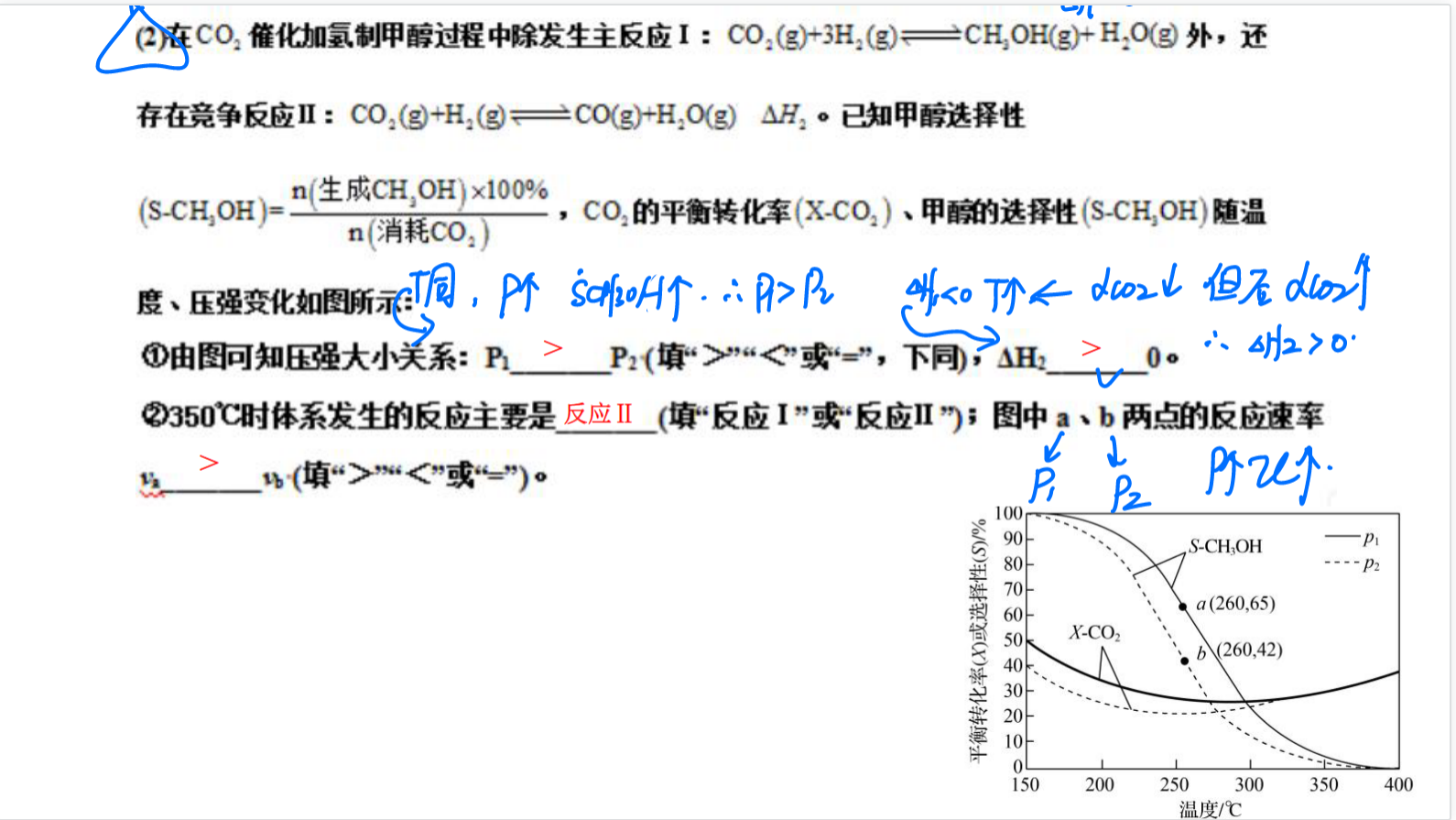
该反应为气体体积减小的反应,加压平衡正向移动,甲醇的选择性增大,故由图可知压强大小关系: \(p_1>p_2\)
反应1为吸热反应,在\(p_1\)下,升高温度反应逆向移动,\(CO_2\)转化率减小,所以压强减小,而温度升高到\(300^\circ\ C\)后,\(CO_2\)转化率增大,说明反应2正向移动,且速率大于反应1,说明反应2是吸热反应,$\Delta\ H_2>0 $
根据以上推断,\(350^\circ\ C\)时,反应2占主导地位,总体表现为\(CO_2\)转化率升高,\(a,b\)两点的温度相同\(a\)点的压强更大,故反应速率\(v_a>v_b\) 。
T17
(2)

\(A.\)增加\(CH_4\)用量可以增加产物,且使反应正向移动,但会减小\(CH_4\)转化率,舍
\(B.\)恒温恒压下充入氮气,相当于减小体系压强,在该平衡体系中,气态反应物物质的量更少,平衡随压强减小正向移动,可取
\(C.\)移除反应物可使平衡正向移动,可取
\(D.\)加入催化剂只会改变反应速率,不影响产率,平衡和转化率

恒温恒压条件下,\(1\ mol\ CH_4(g)\)和\(\ 1\ mol\ H_2O(g)\)反应达平衡时\(CH_4(g)\)的转化率为\(α\),\(CO_2(g)\)的物质的量为\(b\ mol\),则转化的\(CH_4(g)\)为\(α\ mol\)
剩余的\(CH_4(g)\)为\((1-α)\ mol\)根据\(C\)元素守恒可知,\(CO(g)\)的物质的量为\((α-b)\ mol\)
根据\(H\)和\(O\)守恒可知,\(H_2O(g)\)的物质的量为\((1-α-b)\ mol\),\(H_2(g)\)的物质的量为\((3α+b)\ mol\),则反应混合物的总物质的量为\((2α+2)mol\)
之后将物质的量的比例系数作为反应系数,带入平衡常数计算公式即可
当\(H_2O\)物质的量为\(5.0\ mol\)时,转化率\(a=0.90\),所以平衡时\(CH_4\)的物质的量为\(0.1\ mol\)
\(C\)总数为\(1\ mol\),\(CO_2\)为\(0.65\ mol\),由元素守恒可知,\(CO\)的物质的量为\(0.25mol\)
根据\(H\)和\(O\)守恒可知,\(H_2O\)的物质的量为\((5-0.90-0.65 )mol=3.45mol\),\(H_2\)的物质的量为\((3α+b )mol=3.35mol\)
平衡混合物的总物质的量为\((2α+6 )mol=7.8mol\),平衡体系中\(H_2\)的物质的量分数为\(\frac{3.35}{7.8}\ *100\%\ \approx\ 43\ \%\)

