向细胞内导入 DNA 的方法
- 转化 Transformation: 是指含外源基因的重组质粒(载体)将外源基因直接导入细菌、和非动物的真核细胞的方法,使之获得新的遗传特性。
- 转染 Transfection: 是指重组质粒载体或游离核苷酸在脂质体等介导下进入真核细胞。
- 转导 Transduction: 是指通过重组病毒载体将外源基因导入真核细胞或原核细胞,从而引起的基因重组现象。
- 感染 Infection: 重组病毒载体入侵受体细胞导致的病理生理过程。
1 转化 Transformation
在分子生物学和遗传学中,转化是指细胞通过细胞膜直接吸收和掺入来自周围环境的外源性遗传物质而引起的细胞遗传改变。为了进行转化,受体细菌必须处于一种感受态,这种感受态可能在自然界中作为对环境条件(如饥饿和细胞密度)的时间限制反应出现,也可能在实验室中诱导。
“转化”也可以用来描述将新的遗传物质插入非细菌细胞,包括动物和植物细胞;然而,因为“转化”对动物细胞有特殊的意义,表明进展到癌症的状态,所以在动物细胞中这个过程通常被称为“转染”。
Competent 感受态: Competence refers to a temporary physiological state of being able to take up exogenous DNA from the environment; it may be induced in a laboratory.
1.1 自然感受态和转化 Natural Competent and Transformation
目前革兰氏阴性菌和革兰氏阳性菌中存在自然感受态的细菌种类相同。
成功的 DNA 转化需要DNA 结合 bind,吸收 up take,重组 recombine,三个过程。DNA 首先结合感受态细胞表面的 DNA receptor,然后单链 DNA 穿过细胞膜,互补链通常被降解。单链 DNA 随后在 RecA 依赖的过程中,被整合到细菌的基因组上。通常,转入的 DNA 序列没有特异性。
感受态通常是由高细胞密度和/或营养限制引起的,这些条件与细菌生长的稳定期 stationary phase 有关。转化的最佳时期通常是:对数生长期末,biofilm 形成时期,对数生长中晚期,DNA 损伤期
为什么对数生长期的细胞较静止期的细胞难转化?对数生长期存在 2 套细菌的基因组,如果发生 DNA 损伤,细菌倾向使用自身的基因组进行同源重组 HRR 修复。静止期的 HRR 需要外源的模板。
1.2 实验室转化的常用方法
人工感受态 Artificial Competence 可以在实验室程序中诱导,这些程序涉及通过将细胞暴露在自然界通常不存在的条件下,使其被动地渗透到 DNA 中 。
1.2.1 大肠杆菌
1.2.1.1 化学转化法
通常情况下,细胞在冷条件下在含有二价阳离子 divalent cations(通常为氯化钙,镁离子也可)的溶液中培养,改变细胞膜的通透性。然后将细菌暴露于热脉冲(热冲击)中,扰动细胞膜液晶结构,形成孔洞,使 DNA 进入。
氯化钙破坏部分细胞膜,使重组 DNA 进入宿主细胞。同时,氯化钙能屏蔽 DNA 带有的负电荷,使其与带有负电荷的细胞膜不相斥。
DNA 进入的通道类型
DNA entry into E. coli cells is through channels known as zones of adhesion or Bayer's junction, with a typical cell carrying as many as 400 such zones. Their role was established when cobalamine (which also uses these channels) was found to competitively inhibit DNA uptake. Another type of channel implicated in DNA uptake consists of poly (HB):poly P:Ca. In this poly (HB) is envisioned to wrap around DNA (itself a polyphosphate), and is carried in a shield formed by Ca ions.
化学转化法对环状 DNA 质粒载体转化效果最佳。对于线性 DNA, 一般采用自然感受态细胞。如果要转化大的质粒载体,使用电穿孔法效果更加。
1.2.1.2 电穿孔法 Electroporation
细胞被 10-20 kV/cm 的电场短暂电击,这被认为会在细胞膜上产生孔洞,质粒DNA可以通过孔洞进入。电击后,细胞的膜修复机制会迅速关闭孔洞。
采用电穿孔法转化细胞前,需要用冷的双蒸水洗涤细胞,避免电流从溶液中的离子传递,导致附在细胞两极的电压下降,转化不成功。
1.2.2 酵母
- 产生 球状体 spheroplasts:采用可破坏酵母细胞细胞壁的酶
- 二价离子环境:将酵母细胞暴露于碱金属阳离子 alkali cation,如铯或锂,可以使细胞吸收质粒 DNA。例如有方案使用醋酸锂、聚乙二醇和单链 DNA。
- 电穿孔法:与电穿孔法转化细菌类似。
- 酶消化或玻璃珠搅拌也可用于转化酵母细胞。
1.2.3 植物
1.2.3.1 载体介导的方法 Vector-mediated Methods
- 农杆菌法: 农杆菌 Agrobacterium 介导的转化是最简单的植物转化方法。
- 植物组织切块,浸泡在含有悬浮农杆菌的液体中
- 植物细胞分泌损伤相关的酚类物质,上调农杆菌毒力的操纵子 virulence operon
- 细菌的 IV 型分泌系统通过菌毛将细菌的蛋白质和 DNA 导入植物细胞
- 导入的 DNA (T-DNA) 由 broder sequence 定义,和带有核定位信号的 VirD2 蛋白一起以单链 DNA 的形式进入细胞
- T-DNA 整合到宿主植物的染色体中
- 病毒转化(转染)法 Viral transformation (transduction): 将所需的遗传物质包装到合适的植物病毒中,让这种经过修饰的病毒感染植物。
- 遗传物质为 DNA 的病毒: 整合入宿主植物染色体
- 遗传物质为 RNA 的病毒(植物病毒多为此种): 严格定义为 转染 transduction。插入的基因不整合进入染色体,后代植物没有病毒。多用于瞬转。
T-DNA 双元载体系统 (Binary Vector System): 由于农杆菌中的 Ti 质粒侵染植物细胞会产生瘤,且 Ti 质粒 150-200 kb 过大,故在基因克隆中实际使用双元载体系统。双元载体系统包括一个辅助质粒(T-DNA 被切除的 Ti 质粒)和一个供体质粒(大肠杆菌质粒,携带 T-DNA 的边界序列,及插入目的基因的多克隆位点)。当两个质粒载体同时转化入农杆菌时,辅助质粒为供体质粒 T-DNA 的转移提供酶等,仅使目的基因整合到宿主的染色体中。
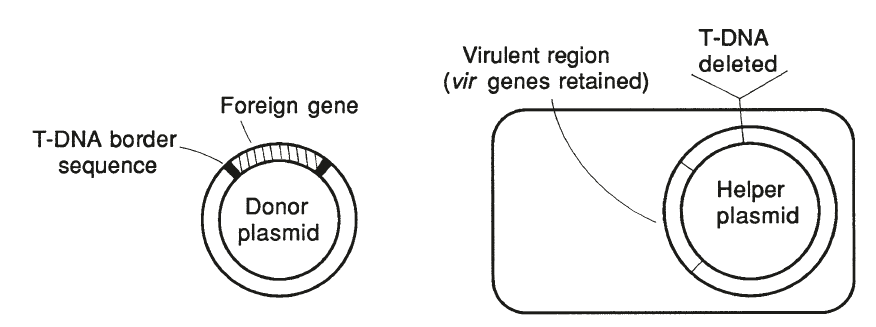
1.2.3.2 非载体介导的方法 Vector-less Methods
- 基因枪法 Gene Gun: 大多数植物可通过此种方法转化。金或钨颗粒被DNA包裹,然后射入植物细胞或植物胚胎。一些遗传物质将留在细胞中并转化它们。这种方法也可以转化植物质体 plant plastids。基因枪法转化效率低于农杆菌介导的转化。
- 电穿孔法 Electroporation
1.2.4 真菌
- 原生质体 Protoplasts/PEG 法
- 农杆菌介导转化 Agrobacterium tumefaciens Mediated Transformation: 真菌不产生与植物类似的酚类物质,需要人为添加。(例如:乙酰丁香酮 Acetosyringone)
- CRISPR/Cas9 法: 真菌中使用 CRISPR/Cas9 系统的起步较晚,限制在没有合适的系统来表达 sgRNA. 2015年,有一份报告水稻稻瘟病菌 CRISPR/Cas 系统的研究。该系统包括针对菌丝体的密码子优化 Cas9,内源性 RNA 聚合酶 III 的 U6启动子,和用来表达 sgRNA 的真菌启动子 RNAP II 。
- 基因枪、电穿孔、声穿孔(利用超声产生的空化气泡穿过细胞膜)
真菌转化的一些问题:
- 真菌部分处于双核状态,可能转化不完全
- 转化真菌通常需要先破坏细胞壁
- 丝状真菌的细胞为共质体状态
- 真菌菌丝的有丝分裂通常只发生在菌丝的顶端
1.3 转化后的筛选方法
- 抗性筛选
- 营养缺陷型筛选
- 蓝白斑筛选 (alpha 互补)
- GFP 绿色荧光蛋白筛选
2 转染 Transfection
转染是有意将裸核酸或纯化核酸 (naked or purified nucleic acid) 导入真核细胞的过程。
‘Naked’ nucleic acids are DNA/RNA produced in the laboratory and intended for use in, or as the result of genetic engineering.
遗传物质(如超螺旋质粒 DNA 或 siRNA 结构),甚至是抗体等蛋白质,都可能被转染。动物细胞的转染通常涉及在细胞膜上打开短暂的孔或“洞”,以便吸收物质。转染可以使用磷酸钙(即磷酸三钙)、电穿孔、细胞挤压或将阳离子脂质与转染材料混合以产生脂质体,脂质体与细胞膜融合并将其携带的物质带入其中。
转染可导致靶细胞出现不同的形态和异常。
2.1 转染方法
转染方法可分为 物理方法、化学方法、生物方法 三大类。
2.1.1 转染所用的质粒载体
转染所用的载体通常是穿梭质粒载体,在细菌中扩大,并以一定浓度转染真核细胞。
穿梭质粒 (shuttle plasmid vector): 是一类由人工构建的具有两种不同复制起点和选择标记,因而可以在两种不同的寄主细胞中存活和复制的质粒。
转染所用的质粒载体往往含有固定的组分,例如哺乳动物细胞的表达载体就有如下的共同结构:
- 真核复制起点
- 真核启动子(通常为病毒蛋白的启动子),启动子可以是 组成型 constitutive 表达 (如 SV40, RSV, CMV),或 诱导 inducible 表达 的 (如 MMTV-LTR)。
- 选择标记或报告基因(在转染在后的宿主中进行选择):如 neo 基因使细胞具有 G418 的抗性,hyg 基因使细胞具有潮霉素 hygromycin 抗性,pac 基因使得嘌呤霉素 puromycin 失效…… 也可以使用磷酸核糖转移酶(HPRT)、胸苷激酶(TK)和二氢叶酸还原(DHFR),来筛选细胞……
- 多克隆位点
- 转录终止序列 poly(A)
- 细菌复制起点,选择标记(如抗性基因)
转染可以是 瞬时 transient 的,也可以是 稳定整合 stable integrated 的(大约 1/10^4)。采用选择标记或报告基因,能够容易的筛选稳定整合的形式。
2.1.2 物理方法
2.1.2.1 电穿孔法 Electroporation
与电转大肠杆菌原理类似。适用性广,除了质粒外,还可转染大的基因组。但细胞致死率高,DNA 和细胞用量大,需根据不同细胞类型优化电穿孔实验条件。
2.1.2.2 显微注射法 Microinjection
显微注射法是使用玻璃微量移液管在微观或临界宏观水平上向微小结构中注射液体物质的方法。
对于细胞或原核注射等过程,靶细胞被放于显微镜下。使用两个微操作器,其一为一移液器,起到固定细胞的作用;其二为一毛细管针,穿透细胞膜或核膜递送物质。
2.1.2.3 基因枪法 Gene Gun
基因枪是一种用于将外源 DNA、RNA 或蛋白质输送到细胞的装置。通过将 DNA 包裹在重金属颗粒上,并使用机械力将这些微粒发射到细胞中,可以将所需的基因整合到所需的细胞中。这种方法能够转化几乎任何类型的细胞,并且不仅限于细胞核的转化;它还可以转化细胞器,包括质体和线粒体。
2.1.2.4 穿刺感染 Impalefection
穿刺感染是一种利用纳米材料(如碳纳米纤维、碳纳米管、纳米线)进行基因传递的方法。针状纳米结构垂直于基底表面合成。将含有该基因并用于细胞内递送的质粒 DNA 连接到纳米结构表面。然后将带有这些针头阵列的芯片压在细胞或组织上。被纳米结构刺穿的细胞可以表达传递的基因。
2.1.2.5 流体静力学注射法 Hydrostatic Pressure
流体静力学注射法是用于小鼠或大鼠的方法,其通过血液输送大量的“裸露”的质粒,实现肝组织(且只在转肝组织)的高效转基因表达,并且能维持较长时间。随着时间的推移,细胞会逐渐丢失质粒,即外源的质粒是一种瞬时表达,而非整合入基因组。
2.1.2.6 超声法 Sonication
超声转染法使用高强度超声波(主要归因于气泡与附近细胞膜相互作用的空化作用),在细胞膜上形成孔洞,使 DNA 进入。
超声空化作用:液体中的微小气泡核在超声波作用下产生振动,当声压达到一定值时,气泡将迅速膨胀,然后突然闭合,在气泡闭合时产生冲击波,这种膨胀、闭合、振荡等一系列动力学过程称超声波空化作用。
2.1.3 化学方法
2.1.3.1 脂质体转染法 Lipofection
脂质体转染法采用两亲脂质,在溶液中形成脂质体结构,将 DNA 包裹于其中。通过与细胞一同孵育,脂质体易于与细胞膜融合,将其中的 DNA 分子带入。通常采用带正电荷的脂质体,其较易将带负电荷的 DNA 包裹在内。通过对转染细胞进行温和的热休克处理,可以提高脂质转染的效率。
能转染各种类型的细胞,转染效率较高。但在体内,能被血清清除,并在肺组织内累积,诱发强烈的炎症反应。
常见脂质体转染试剂:
- Lipofectamine 2000: ThermoFisher 公司的转染试剂,1993 年商用。
2.1.3.2 磷酸钙转染法 Calcium Phosphate
磷酸钙盐转染法是花费最低的方法。将含有磷酸盐离子的 HEPES 缓冲盐溶液(HeBS)与含有待转染 DNA 的氯化钙溶液混合,带正电荷的钙离子和带负电的磷酸盐会形成细微沉淀,将要转染的 DNA 结合在其表面。接着将带有此种沉淀物的悬浮液添加到待转染的细胞中(通常是单层培养的细胞),细胞吸收沉淀物时,将 DNA 带入。
HEPES buffer: (2-[4-(2-Hydroxyethyl)piperazin-1-yl]ethane-1-sulfonic acid) 一种两性离子磺酸缓冲液,Good's 缓冲液的一种。HEPES 广泛用于细胞培养,主要是因为与细胞培养中常用的碳酸氢盐缓冲液相比,在二氧化碳浓度(由有氧呼吸产生)发生变化时,HEPES 能更好地维持生理 pH 值。
磷酸钙转染法不适用于原代细胞(所需的DNA浓度较高),操作简便但重复性差,不适用于所有细胞种类。
2.1.3.3 阳离子聚合物法 Cationic Polymers
阳离子聚合物法中,带负电的 DNA 与阳离子聚合物结合形成复合物,复合物通过与细胞表面的蛋白多糖相互作用,通过内吞作用被细胞吸收。
常用的阳离子聚合物有:
- DEAE-葡聚糖 DEAE-dextran: DEAE-葡聚糖仅限于瞬时转染。带正电的 DEAE-葡聚糖可以结合带负电的 DNA 分子,使得 DNA 复合物结合在带负电的细胞表面。通过使用 DMSO 或甘油获得的渗透休克,也可能是细胞内吞作用,使得 DNA 复合体进入细胞。
- 聚乙烯亚胺 polyethylenimine (PEI): 一种具有较高的阳离子电荷密度的有机大分子,每相隔二个碳个原子都有一个质子化的氨基氮原子,使得聚合物网络在任何 pH 下都能充当有效的 质子海绵 proton sponge。PEI 能将 DNA 缩合成带正电荷的微粒,这些微粒可以黏合到带有负电荷的细胞表面残基,并通过胞吞作用进入细胞。一旦进入细胞,胺的质子化导致反离子大量涌入以及渗透势降低。上述变化导致的渗透膨胀使囊泡释放聚合物与 DNA 形成的复合物进入细胞质。复合物拆解后,DNA 能自由的融合到细胞核中。
在体内可应用,细胞毒性低。
2.1.3.4 非脂质体型转染试剂 FuGENE
FuGENE 转染试剂自 1997 年开始商用,其是一种对细胞较温和的转染试剂。FuGENE 的优点是在有或无血清的情况下都能有几乎相同的转染效率。即研究人员不再需要执行培养基置换的步骤,在含血清和无血清的培养基之间来回交换,产生对细胞可能的刺激。
2.1.4 病毒方法
有关病毒的方法与 Transduction 转导 相关,将在后续介绍。
3 转导 Transduction
转导是采用病毒或病毒载体将外源DNA导入细胞的过程。转导不需要在提供 DNA 的细胞和接受 DNA 的细胞之间进行物理接触(发生接合),并且具有 DNA 酶抗性(转化易受 DNase 的影响)。转导是用来稳定地将外源基因导入宿主细胞基因组(细菌和哺乳动物细胞)的常用工具。
3.1 采用噬菌体转导
3.1.1 自然情况下噬菌体转导的几种类型
- 普遍性转导 generalized transduction: 当噬菌体的头部仍然还有空间时,噬菌体倾向将更多的 DNA 包含在内,此时,一部分细菌的遗传物质可能被包裹进去,这种情况被称为普遍性转导 generalized transduction。被包裹的基因可能来源于细菌基因组的任何部位,并且转导后的基因不会整合在宿主的染色体上。
- 局限性转导 specialized transduction: 噬菌体只能传递供体染色体的特定部分(靠近原噬菌体附着点的基因)的转导。被包裹的基因,一般为和噬菌体基因紧密连锁的部分细菌宿主的 DNA。供体基因可以插入受体染色体或留在细胞质中,这取决于噬菌体的性质。
- 横向转导 lateral transduction: 横向转导是将细菌 DNA 的很长片段转移到另一种细菌的过程。到目前为止,这种形式的转导只在金黄色葡萄球菌中被描述过,但它可以转移更多的基因,并且比一般的和专门的转导频率更高。转导的 DNA 可能插入宿主的染色体。
3.1.2 采用噬菌体转导进行基因编辑
由于噬菌体的容积有限,一般采用噬菌体转导小片段 DNA。下表列出了载体和 DNA 限制大小的一般关系:
| Vector | Features | Isolation of DNA | DNA limit |
|---|---|---|---|
| Plasmid | High copy number | Physical | 10 kb |
| Phage | Infects bacteria | Via phage packaging | 20 kb |
| Cosmid | High copy number | Via phage packaging | 48 kb |
| BAC | Based on F plasmid | Physical | 300 kb |
| YAC | Origin + centromere + telomere | Physical | >1 Mb |
3.2 采用病毒载体转染哺乳动物细胞
3.2.1 病毒载体的类型
目前主流的病毒载体系统主要包括慢病毒 (Lentivirus)、(γ-)逆转录病毒 (Retrovirus)、腺病毒 (Adenovirus) 和腺相关病毒 (Adeno-associated Virus)。其中:
- 慢病毒和γ-逆转录病毒属于逆转录病毒科,基因组为正链 RNA,能随机整合如宿主基因组并稳定遗传;
- 腺病毒属于腺病毒科 (Adenoviridae),基因组为线性双链 DNA,不整合入宿主基因组;
- 腺病毒相关病毒属于细小病毒科 (Parvoviridae),基因组为线性单链 DNA,不整合入宿主基因组。
除逆转录病毒仅感染分裂型的细胞外,其他种类病毒载体可感染分裂或不分裂的细胞。
还有 SV40 病毒载体系统。SV40 是 simian vacuolating virus 40 或 simian virus 40 的缩写,属于多瘤病毒科 (Polyomaviridae),存在于猴子和人体内。
3.2.2 SV40 载体系统
SV40 病毒的基因组大约 5.2 kb,是环状的双链 DNA。其基因组有两个启动子,以相反方向启动“早期基因”和“晚期基因”的转录。其中:
- 早期基因:T 和 t 抗原,与病毒的致瘤作用有关
- 晚期基因:编码病毒衣壳蛋白 VP1, VP2, VP3
SV40 侵染细胞后,早期产生 T 抗原和 t 抗原,在 T 抗原作用下起始病毒 DNA 复制,在 DNA 复制后开始晚期转录,表达产生 VP1, VP2, VP3,然后装配形成病毒颗粒,裂解细胞并释放。
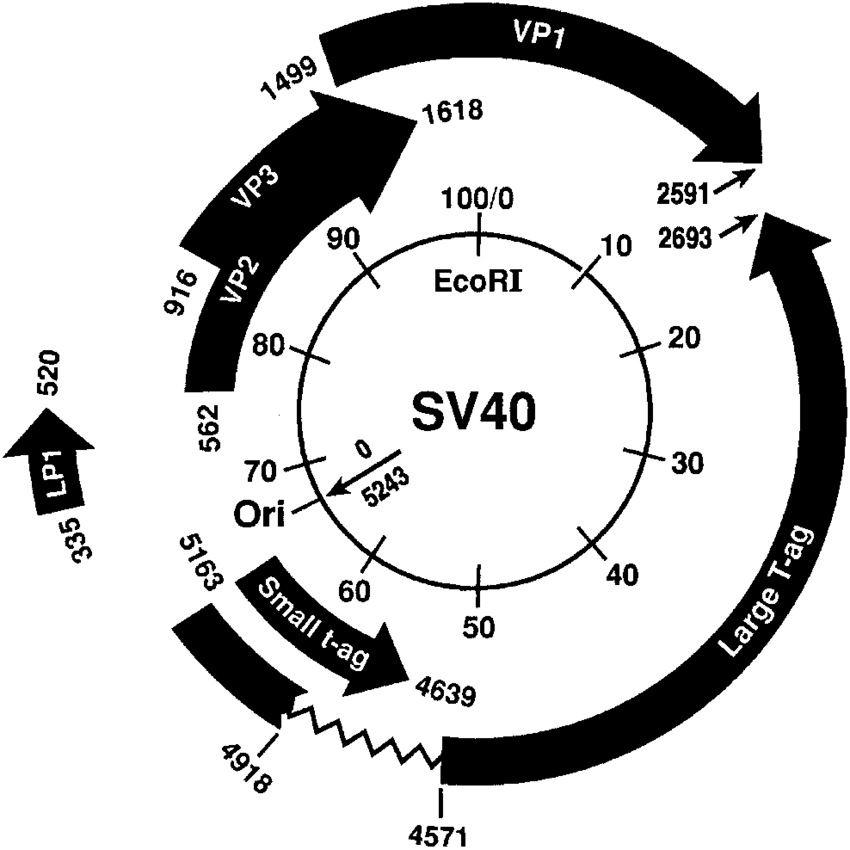
SV40 仅能包含其基因组大小的基因片段,故有两种病毒载体,分别取代 SV40 的早期基因和晚期基因。SV40 系统一般包含两个部分:
- 病毒载体(早期基因缺失或晚期基因缺失)
- 辅助病毒
根据 SV40 病毒感染作用的不同效应,可将其寄主细胞分成三种不同的类型:
受纳细胞 permissive cell: SV40 病毒在感染了 CV-1 和 AGMK 猿猴细胞之后,便产生感染性的病毒颗粒,并使寄主细胞裂解。
非受纳细胞 non-permissive cell: SV40 感染啮齿动物(通常是仓鼠和小鼠)的细胞,不会产生感染性颗粒,此时病毒基因组整合到寄生细胞的染色体上。细胞被转化/永生化 (SV40 T抗原)。
半受纳细胞 semi-permissive cell: 人细胞,允许 SV40 增殖,但它们产生的病毒后代有限。大多数细胞在感染后会裂解并死亡,但部分细胞能够抵抗 SV40 的感染,同时产生低滴度的病毒子代。
3.2.2.1 SV40 晚期基因区取代载体
- 载体 由复制起点 ori,晚期基因启动子 promoter,和被替换成为目的基因的晚期基因区段组成。
- 辅助病毒 helper virus 是早期基因区段被失活的 SV40 病毒。
将上述病毒载体和辅助病毒同时转染猴细胞,彼此提供基因产物,释放出能单次侵染其他细胞,不具有再次侵染能力的病毒颗粒,从而实现目的蛋白的高效表达。
3.2.2.2 SV40 早期基因区取代载体
其构造方法与晚期基因区取代载体相反。
如果宿主细胞提供病毒功能,就可以不使用辅助病毒。有一种被称为 COS 的细胞系是由非洲绿猴肾 CV-1 细胞转染有复制起源缺陷的 SV40 突变病毒构成的。该细胞含有整合在染色体 DNA 中的 SV40 病毒的 DNA,可以互补病毒载体功能,但不能自发复制。
SV40 载体的弊端:
- 该方法仅限于猴细胞
- 由于细胞的裂解,表达不稳定
- 在病毒复制过程中可能发生 DNA 的重排
3.2.3 逆转录病毒系统
Production of lentiviral vectors - PMC (nih.gov)
病毒 RNA 基因组的 5′ 端和 3′ 端分别含有长末端重复序列 (LTR long terminal repeat),分别携带转录的起始和终止序列。在 5′ 和 3′ LTR 区域之间,有三个病毒蛋白编码区:gag 为病毒核心蛋白,pol 为酶逆转录酶,env 为包膜,以及一个携带用于引导RNA组装形成病毒颗粒信号的 psi(ψ)区域。
5' -- LTR -- psi (packaging signal) -- gag -- pol -- env -- LTR -- 3'
安全的逆转录病毒系统由 2 个组分构成:
- 逆转录病毒载体 retrovirus vector: 逆转录病毒载体丢失了大量的病毒结构基因,但是 LTR 和 psi (ψ) 区得到保留。载体通常带有多克隆位点以供插入基因和选择标记,插入基因的启动子通常由 LTR 承担。
- 包装细胞 packaging cell: 包装细胞来源于小鼠或禽类的成纤维细胞系,其中含有整合的原病毒 DNA,但 psi (ψ) 区被删除。 包装细胞提供病毒颗粒组装必要的蛋白。
由这种系统产生的病毒颗粒不能在宿主体内复制,是一种安全的逆转录病毒。
3.2.3.1 慢病毒载体系统 (HIV-1 改造)
慢病毒是一种逆转录病毒,可在人类和其他哺乳动物体内引起慢性致命疾病,其特征是潜伏期长。该属包括导致艾滋病的人类免疫缺陷病毒(HIV)。慢病毒分布于世界各地,已知存在于猿、牛、山羊、马、猫、羊以及其他几种哺乳动物中。
许多慢病毒载体系统基于 HIV-1 病毒(基因组为线性正链单链 RNA)改造而来,为了提高慢病毒的安全性,病毒生产所需的成分被拆分成多个质粒(第二代系统有 3 个,第三代系统有 4 个):
- 慢病毒转移质粒 Lentiviral Transfer Plasmid: 转基因序列的两侧是长末端重复序列(LTR),这有助于将转移质粒序列整合到宿主基因组中。通常,病毒转导后整合到宿主基因组中的是LTR之间的序列以及LTR。出于安全原因,转移质粒都不能复制,可能在 3' LTR 中包含额外的缺失,使病毒在整合后“自我失活”(self-inactivating SIN)。
- 包装质粒 Packaging Plasmid
- 包膜质粒 Envelope Plasmid
第二代系统:
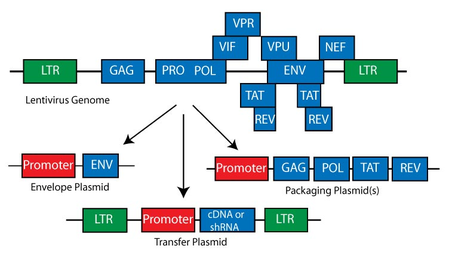
第三代系统:
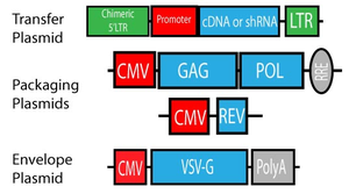
两图中均没有显示 psi 包装信号。各区段的功能如下:
- LTR 长末端重复序列: 存在 3 个区段 U3、R 和 U5。LTR 末端参与病毒与宿主基因组的整合。一旦整合了前病毒,5′ 端的 LTR 将作为整个逆转录病毒基因组的启动子,而 3′ 端的 LTR 将提供新生的病毒 RNA 多聚腺苷酸化,并且编码辅助蛋白 Nef。
- ENV: 编码病毒衣壳蛋白 gp120 和 gp41。
- GAG: 编码基质蛋白、衣壳蛋白和核衣壳蛋白
- POL: 编码蛋白酶、整合酶和逆转录酶
- TAT: 转录激活因子,反式激活 LTR 启动子,增加病毒转录的效率。
- REV: 编码 rev 蛋白,控制病毒转录本的剪接和出核
- VSV-G: 荧光蛋白,报告基因
第三代系统相较于第二代系统:
- 增加了质粒载体数量,降低病毒滴度,更安全
- 除去了 tat,在 5′ LTR 中嵌合异源启动子,使转录不依赖于 tat 的反式激活
3.3 昆虫杆状病毒系统
杆状病毒表达系统在生产真核生物活性蛋白中有着越来越多的应用。该系统与哺乳动物细胞相似,均具有翻译后修饰功能:折叠、二硫键的形成、糖基化、磷酸化、信号肽的切除等……该系统使用 Autographa californica multiple nuclear polyhedrosis virus (AcMNPV) 苜蓿银纹夜蛾核型多角体病毒,其能感染许多鳞翅目的昆虫。在实验室中,一般使用培养的草地贪夜蛾的卵巢细胞。
AcMNPV 有两种病毒形态:胞外病毒颗粒,与细胞到细胞的感染有关;存在于多角体中的病毒颗粒,与昆虫间病毒的水平转移有关。
昆虫通过进食 AcMNPV 污染的食物,使 AcMNPV 侵染肠道细胞。在肠道细胞中复制后,新的病毒颗粒通过出芽释放到胞外。在感染的晚期,多角体基因持续高表达,多个病毒颗粒聚集在一起转化成多角体的。随着多角体的增多,细胞裂解,将大量的病毒颗粒释放到环境中。
3.3.1 杆状病毒转移载体
AcMNPV 的基因组 135 kb,能容纳大分子的插入片段,但由于其基因组过大,不便于直接操作。进行基因编辑,通常是使用杆状病毒转移载体 AcMNPV Transfer Vector:
- 包含 AcMNPV 多角体蛋白基因的片段(基因插入后会破坏此基因)
- 启动子,及其下游的多克隆位点(其两侧存在与 AcMNPV 同源的序列)
- 质粒复制起点 ori,及抗性基因(用于在大肠杆菌中扩增)
进行转导前,需要将 AcMNPV 与 AcMNPV Transfer Vector 同时转染昆虫细胞,其二在细胞内发生同源重组,使目的基因从 Transfer Vector 转移到 AcNMPV 上(重组成功的病毒不具有多角体形式,可筛选),从而使带有目的基因的 AcNMPV 侵染更多的昆虫细胞,表达目的蛋白。
由于上述方法重组率低,且筛选困难(通过观察是否产生多角体,成功的重组不产生多角体),故有许多对其的改进。例如,Vialard 等在多角体基因的上游插入半乳糖苷酶,通过 X-gal 筛选。Kins 提出了线形化技术,仅有重组成功的病毒才能具备侵染能力。
- Lewin's Genes IX (2015)
- Transformation (genetics) - Wikipedia
- Transfection - Wikipedia
- Impalefection - Wikipedia
- Transduction (genetics) - Wikipedia
- Association Between Simian Virus 40 and Human Tumors
- 2018_Article_AdvancesProblemsAndProspectsOfeneticTransformation of Fungi.pdf
- FuGENE 6 Transfection Reagent: the gentle power - ScienceDirect
- Addgene: Lentiviral Guide
- 转化、转染、转导、感染有什么区别
- 科学网—读书笔记003--植物病毒相关的一些载体(pEAQ 和 VIGS 载体) - 于颜玲的博文
- 【求助】真菌基因敲除方法
- 裸质粒流体力学注射法-基因治疗研究的利器 - 中国知网
- 四种病毒系统介绍 - 丁香园
- 昆虫杆状病毒表达系统的研究进展 - 实验方法 - 丁香通
- 1分钟解锁两种转染试剂的差异 - 知乎
- 几种转染方法对比 - 实验方法 - 丁香通


