利用卷积神经网络进行阿尔茨海默病分类的神经影像模式融合 论文研读笔记
原文链接
发表: 2018.11.13
摘要
阿尔茨海默病(AD)分类的自动化方法具有巨大的临床益处,并可为防治该疾病提供见解。深层神经网络算法通常使用诸如MRI和PET的神经学成像数据,但是还没有对这些模式进行全面和平衡的比较。为了准确确定每个成像变体的相对强度,本研究使用阿尔茨海默病神经成像倡议(ADNI)数据集在阿尔茨海默病痴呆分类的背景下进行比较研究。此外,本文还分析了在融合环境中使用这两种模式的益处,并讨论了在未来使用深度学习的AD研究中如何利用这些数据类型
引言
计算机辅助诊断的自动化方法可以大大提高筛选高危个体的能力。该研究将集中在两种不同的神经影像学模式:结构T1加权MRI和AV-45淀粉样PET。研究的主要目的是比较这些模式中的每一种单独使用的有效性,以及当这两种模式都被用作融合系统时的有效性。考虑到输入数据的视觉特性,该工作选择应用一种非常适合计算机视觉任务的模型:卷积神经网络(CNN)
相关工作
早期的方法通常使用线性分类器,如支持向量机(SVM)来手工制作生物特征。这些特征可以在个体体素水平上定义,如组织概率图的情况,或者在区域水平上定义,包括皮质厚度和海马形状或体积。有研究表明全脑方法通常比基于区域的方法获得更高的分类精度。此外,有证据表明,某些数据预处理方法,即DARTEL注册包[3],可以显著影响分类结果。这两项发现为在本工作中使用全脑容量并在分类算法之前设计一个健壮的注册流水线提供了依据
由于每个卷积层中的共享滤波器权重,这些模型非常适合于具有2D或3D数据的任务。目前,虽然存在利用多种数据类型并应用最新的神经网络体系结构的方法,但是模态和体系结构之间的比较研究在使用数据集时是随意的,并且缺乏对模型有效性的解释。并且,在之前的相关研究中使用的预处理管道也是不同的。该研究在这两个方面都做了新的研究
首先,对本工作中使用的预处理进行了清楚的解释,并提供了每个步骤的原理
第二,模态比较结果在生物学上下文中讨论,该上下文更有效地描述了每个数据类型的相对性能
方法论
预处理操作对最终的分类性能有重大影响。因此,该研究开发了一个管道来校正成像数据中固有的几个偏差。虽然管道的组件采用现有算法,但总体结构与以前的工作不同,并允许在MRI和PET模式之间进行更公平的比较。研究使用CNN网络地体系结构,因为调查的主要目的是比较数据模式而不是网络类型,所以CNN被设计成代表由标准网络层组成的可比较的方法
预处理
预处理流水线旨在纠正原始MRI和PET数据中可能存在的几种偏差,这也消除了网络学习方法纠正或忽略这些偏差的额外负担。取而代之的是,该网络具有在健康与阿尔茨海默病患者之间发现模式的单独任务
管道的构建如下
- MRI偏差校正
由于扫描器的发射/接收不均匀性,MRI图像可能具有低频偏置分量。这种空间不均匀性虽然并不总是在视觉上显而易见,但是可能导致图像处理管道出现问题。因此许多MRI处理方案开始于应用偏置场校正算法,非参数非均匀强度归一化(N3)是消除这种偏置场的一种稳健且成熟的方法:它优化了缓慢变化的乘法场,当去除时,恢复真实信号的高频分量。这项工作选择采用一种称为N4的更新方法,该方法利用B样条拟合来改进校正。该步骤对原始MRI图像执行,但是对于PET图像是不必要的
- 仿射登记
两个图像模态都使用线性仿射变换进行配准。注册的目的是消除扫描仪中个体之间的任何空间差异,即从标准方向进行小的平移和旋转。通常,扫描被注册到脑图谱模板,例如MNI152。
- 颅骨剥离术
颅骨剥离用于从图像中去除非脑组织体素。这通常被构造为一个分割问题,如在FSL的脑提取工具(BET)中使用聚类来相应地分离体素。然而,考虑到扫描已经注册到标准空间,颅骨剥离是一项简单的任务。使用MNI152空间中的脑掩模来消除MRI和PET图像中的任何非脑体
单个主题的预处理流水线

在进行下一步操作之前,要对数据集中的单个患者的所有MRI和PET图像执行该预处理。在任何配准步骤之前,N4校正应用于所有MRI扫描。所有MRI扫描被登记到第一扫描时间点,并且所得图像被平均以创建平均模板。N4校正扫描在被注册到MNI152模板之前被注册到这个空间。然后使用二进制掩码对得到的图像进行颅骨剥离
PET扫描用计算机断层扫描进行衰减校正。PET采集的前10分钟被重建成两个5分钟的帧。框架被一起校正,并且被整个小脑参考(标准化)。每个PET扫描以6自由度配准被配准到个体的平均T1模板,然后从平均T1到MNI152的预先计算的12自由度配准被连接并应用于PET图像,以将它们从原生PET移动到MNI152空间。最后,对PET图像进行颅骨剥离
网络
CNN架构在其结构上是相当传统的,该网络以全3D MRI或PET图像作为输入,并输出诊断标签。虽然网络中存在多个处理层,但只有三种不同的类型:卷积层、最大池层和完全连接层。卷积层构成CNN的骨架,3D过滤器与层的输入卷积在一起。每个核由在整个输入图像中共享的学习权重组成;并且,每个处理层可以有多个可训练的核,这允许内核专门化,同时仍然提供捕获每个层的变化的能力。在卷积层之后,通常具有最大池层。这些层通过输出给定区域中的最大响应来对输入图像进行下采样。完全连接的层通常放置在CNN的末端。这些层采用早先在网络中学习的区域特定的卷积特征,并允许每个特征之间的连接。这些层中的权重也是可训练的;因此,这些层聚合区域特征并学习它们之间的全局连接。结果,CNN中的最终完全连接层的输出是最终诊断标签
CNN架构1

(以单个MRI或PET体积作为输入,输出为“Healthy”或“AD”的二进制诊断标签,卷积层和前两个全连接层使用ReLU激活函数,最后一个全连接层使用softmax函数)
CNN结构2
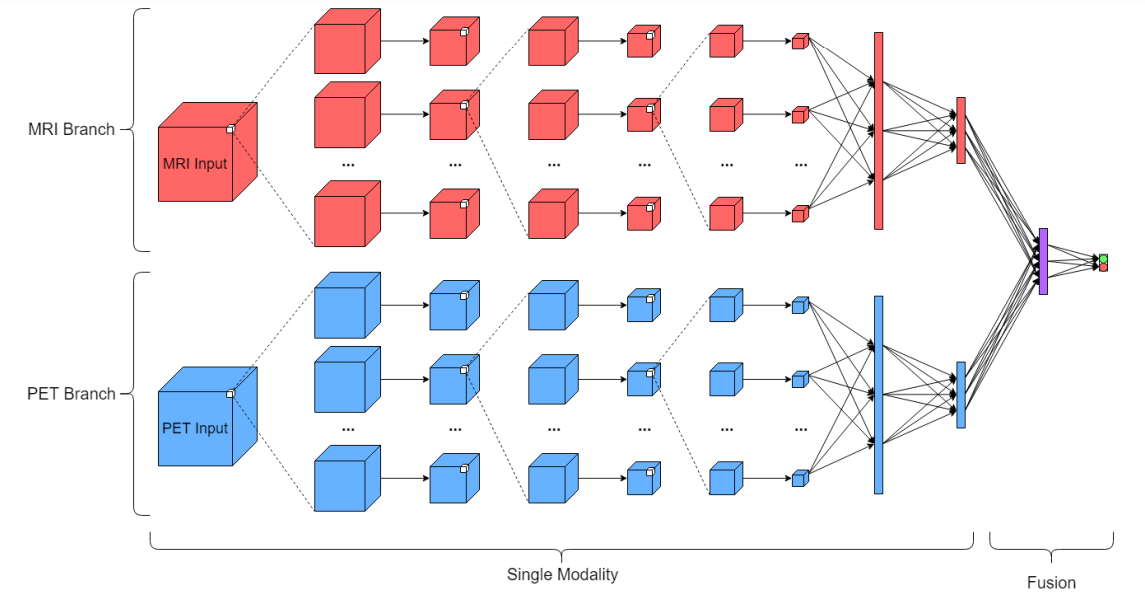
(同时输入一个MRI和一个PET,该架构上下部分都是一个单独的架构1,只是在最后增加了一个128节点的全连接层,并且将核的数量由20减少到10,则是为了保持参数数量的一致)
实验结果
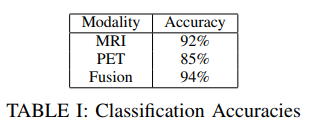
使用以下3个技术可以将MRI分类准确性提高到95%
- A. Gupta, M. Ayhan, and A. Maida, “Natural image bases to represent neuroimaging data,” in International Conference on Machine Learning, 2013, pp. 987–994.
- A. Payan and G. Montana, “Predicting alzheimer’s disease: a neuroimaging study with 3d convolutional neural networks,” arXiv preprint arXiv:1502.02506, 2015.
- E. Hosseini-Asl, R. Keynton, and A. El-Baz, “Alzheimer’s disease diagnostics by adaptation of 3d convolutional network,” in Image Processing(ICIP), 2016 IEEE International Conference on. IEEE, 2016, pp. 126–130
基本上,这项研究更清楚地说明了MRI和PET模态之间的差异,并建议MRI模态可能对用于计算机辅助诊断的机器学习算法更有信息
研究的最后值得注意的结果是融合网络的性能优于单个MRI和PET网络。此外,尽管使用了较少的数据点,但融合网络的性能优于MRI网络。在融合情况下有更多的PET扫描可以进一步提高准确性,该研究清楚地表明,即使PET的信息量较少,也能够提供互补的信息以提高分类精度
结论
这项工作比较核磁共振成像和淀粉样蛋白PET成像在应用深层神经网络进行计算机辅助诊断的有效性。具体而言,设计并训练了两个结构相同的CNN,分别使用MRI和淀粉样PET数据进行预处理,以便尽可能公平地进行比较。分类结果表明,MRI数据比淀粉样PET数据更有利于神经网络训练预测临床诊断。然而,使用两种模式的网络,即使具有相同数量的可训练权重,也将实现更高的精度。这表明这两种数据类型具有互补信息,可以在这些类型的任务中使用这些信息



