【文化课学习笔记】【化学】有机相关知识梳理
有机相关知识梳理
有机物的化学性质
有机物主要化学反应
高中有机主要反应(不涉及加聚、缩聚):
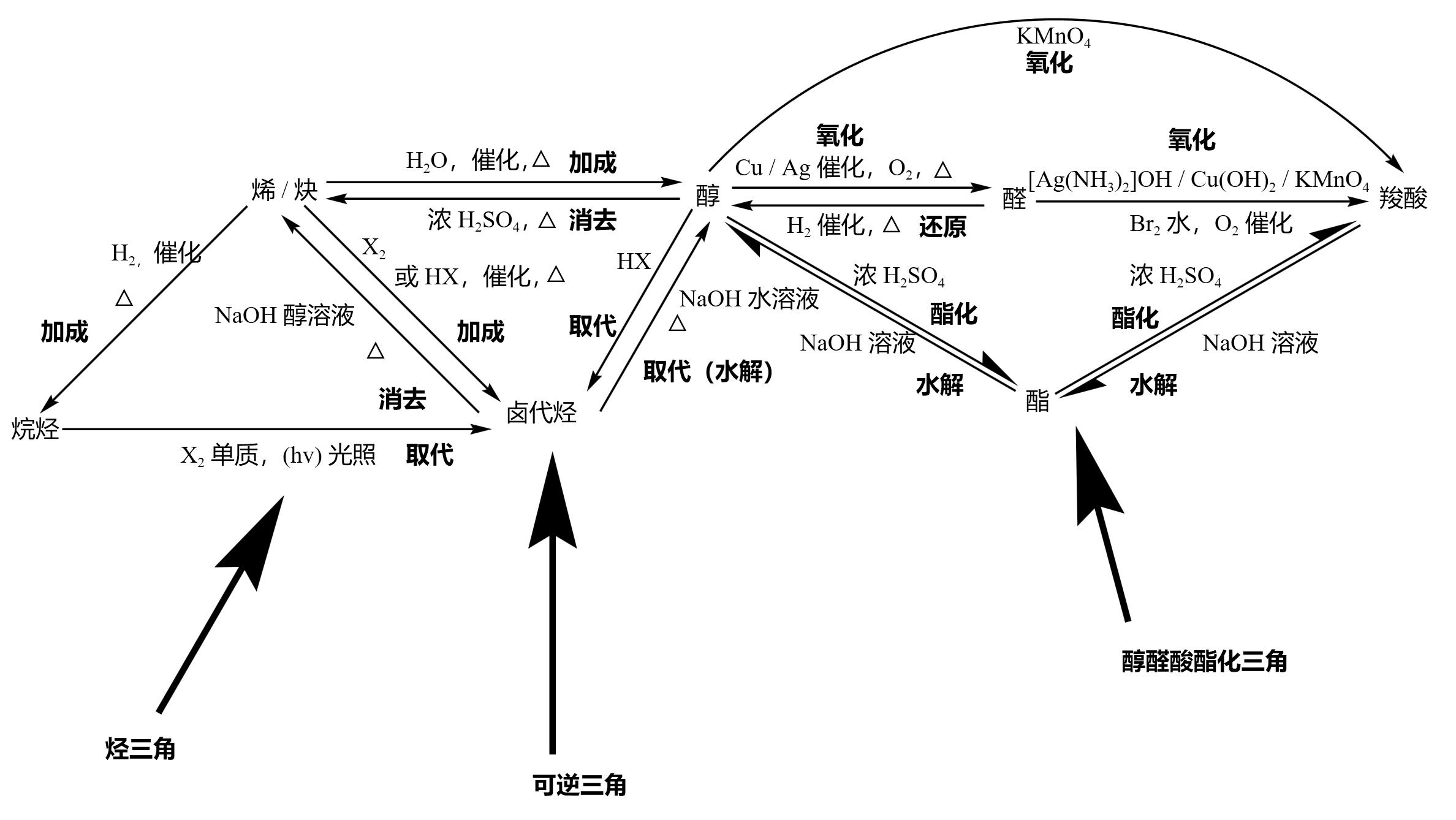
烃三角涵盖了烷、烯、炔和卤代烃三种烃类的关系,可逆三角中的三类物质可以互相转化、醇醛酸酯化三角主要反应以连续氧化和酯化反应为特征,同时包含二者的逆反应(还原反应和水解反应)。
从烷烃出去的只有一个取代反应,跟卤素单质在光照条件下生成 X 卤代物(卤代烃)。
从烯 / 炔出去的都是加成反应,且反应均需加热,分别生成烷烃(
从卤代烃出去的有两个反应,分别是取代和消去反应,反应均需加热。一个是在氢氧化钠水溶液下发生取代(水解)生成醇,碳卤键断裂;一个是在氢氧化钠醇溶液下发生消去反应生成烯 / 炔,碳卤键和碳氢键断裂,得到双键 / 三键。
醇可发生的反应很多,大的方面有取代、消去和氧化反应:
- 取代反应又可以分为卤代和酯化(实际上两个醇还可以发生成醚反应,不过和酯化原理相同,这里不做赘述),卤代得到卤代烃,和酸在浓硫酸和加热条件下酯化得到酯。
- 消去反应在加热条件下和浓硫酸反应得到烯 / 炔。
- 氧化反应又可以分为酸性高锰酸钾氧化和催化氧化,都可以连续氧化先得到醛再得到羧酸,二者必须保证
醇需要加热的有三个个反应,一个是消去反应生成烯 / 炔,一个是催化氧化,还有一个是酯化反应。
醛由于其中间价态,既可以发生氧化又可以发生还原。其中氧化反应,可以通过酸性
除了醛之外,酮也可以在氢气加成和加热条件下,还原为醇。二者是相似的,但酮没有醛那么活泼,所以不能发生银镜反应等氧化为酸。
酯会在加热条件下发生酸性水解和碱性水解,生成醇和羧酸,同时有可能在酸性 / 碱性环境下与其它物质反应得到副产物。
只有烯 / 缺在催化剂和加热条件下加成能够得到烷烃。
从烯 / 炔进入(箭头指向烯 / 炔)的反应一定都是加热条件下的消去反应,类似于加成反应的逆反应,分别由醇和卤代烃反应得到。
卤代烃有三种生成途径:烷烃取代、稀炔加成、醇类取代,即「二取代一加成」。
醇的生成途径是所有有机物类中最多的:稀炔加成,卤代烃取代(水解),醛类还原,酯类水解。
醛只能通过醛类氧化得到。
羧酸主要通过氧化得到,一般主要是醛类和醇类氧化,除此之外还可以由酯类水解得到。
酯可以由羧酸和醇酯化得到。
未涉及到的反应:
- 各种物质(烷、烯、炔、醇和醛)的燃烧,各种有机物燃烧基本都生成二氧化碳和水。
- 烯 / 炔的酸性高锰酸钾氧化:烯、炔在酸性高锰酸钾氧化时生成二氧化碳,能够使得酸性高锰酸钾褪色。
- 醇和钠的反应:发生置换,得到
- 醛与氢氰酸加成 & 羟醛缩合。
- 羧酸的弱酸性:羧酸可以和钠、氢氧化钠、碳酸氢钠、苯酚钠以及碳酸钠反应。
- 酯交换反应:酯脱
- 涉及苯环、酚相关反应。
涉及苯环的反应:
苯只有四个反应,卤代、硝化、磺化和被氢气加成。
苯的同系物:
- 只要连苯环的碳上有氢,就可以被酸性高锰酸钾氧化,生成羧酸;
- 被
- 加热和浓硫酸条件下发生硝化反应,硝基取代苯环上邻对位氢;
- 被氢气加成生成甲基环己烷。
苯酚:
- 具有弱酸性,能够和钠、氢氧化钠、碳酸钠反应,但不能和碳酸氢钠反应。
- 被溴取代,苯环邻对位被溴取代。
- 和氢气加成。
- 在空气中氧化,生成苯醌;被酸性高锰酸钾氧化。
- 在三价铁中发生显色反应。
- 和乙酰氯、乙酸酐等物质发生成酯反应。
三者的共同特点:都可以被氢气加成,将苯环变成环己烷;都可以被溴卤代。
苯和苯的同系物共同特点:都可以发生卤代、硝化,苯环被硝基取代。
苯的同系物和苯酚共同特点:都能被高锰酸钾氧化。
苯特有:磺化。
苯的同系物特有:光照条件下侧链被卤代。
苯酚特有:弱酸性、在空气中氧化成苯醌、显色反应、成酯反应。
| 试剂 | 溴水 | 溴单质 | 酸性高锰酸钾 | ||||
|---|---|---|---|---|---|---|---|
| 烷烃 | / | / | / | / | 不反应 | 反应(光照,加热) | 不反应 |
| 烯烃 | / | / | / | / | 加成反应 | 加成反应( |
反应 |
| 炔烃 | / | / | / | / | 反应 | 反应 | 反应 |
| 苯 | / | / | / | / | 不反应 | 反应(纯的液溴, |
不反应 |
| 苯的同系物 | / | / | / | / | 不反应 | 反应(光照侧链,催化苯环) | 反应生成苯甲酸 |
| 卤代烃 | 不反应 | 反应 | 不反应 | 不反应 | 不反应 | 不反应 | 不反应 |
| 醇 | 反应 | 不反应 | 不反应 | 不反应 | 不反应 | 不反应 | 氧化反应 |
| 苯酚 | 反应 | 反应 | 反应 | 不反应 | 反应(生成三溴苯酚白色沉淀) | 反应 | 氧化反应 |
| 醛 | 不反应 | 不反应 | 不反应 | 不反应 | 氧化反应(溴水有次溴酸强氧化性) | 反应 | 氧化反应 |
| 羧酸 | 反应 | 反应 | 反应 | 反应 | 不反应 | 不反应 | 不反应 |
| 酯 | 不反应 | 水解反应 | 不反应 | 不反应 | 不反应 | 不反应 | 不反应 |
说明:
- 醇跟氢氧化钠、碳酸钠和碳酸氢钠不反应是因为无碱性。
- 草酸是羧酸中的特例,可以和酸性高锰酸钾反应。
- 酯相比酸是较为稳定的物质。
这个表格重点记忆与苯环有关的,之前与苯环无关的在前面结构图中已经主要展现。
试剂用量问题
注意题目是否指明该物质为
。
消耗
能消耗氢氧化钠的物质有卤代烃、酯、羧基。
口诀:
- 卤代烃:一卤一碱,苯环直连最多俩(非水解)。解释:溴苯在高温高压下可能变溴化钠,生成的苯酚变苯酚钠,所以最多消耗两摩尔。
- 酯:普通一个,酚酯俩。
- 肽键:肽键水解,酸补羟基,氨补氢,酸变盐,所以是一个。
- 羧基:一个。
消耗
能消耗氢气的物质有醛(还原反应)、双键、三键、苯环。
口诀:双键一个三键俩,一见苯环就加仨,羧基酯基不能加。
注意:高中阶段除了氢气和氢氰酸之外其它均不能加成碳氧双键,氢气也不能加成羧基和酯基上的碳氧双键。
消耗溴水的量
溴水可以取代 / 加成,能消耗溴水的物质有酚羟基邻对位,谈谈双键,碳碳三键。
口诀:取代或加成,双键一个三键俩,酚羟邻对空位加。
注意:溴水不能加成碳氧双键。
有机物主要物理性质
熔沸点
- 有氢键,沸点高:例如
- 无氢键,分子量越大,分子间作用力越强,沸点越高。
- 相同分子量,支链越多,沸点越低。
一般规律:
- 互为同系物的有机物,随着碳数的增加,分子量增加,熔沸点逐渐增加。
- 互为同分异构体的同一类有机物,支链越多,熔沸点越低。
- 同一类有机物,随着官能团数增加,分子量增加,熔沸点逐渐增加。
例如:
结论:碳数相差不大时,熔沸点 醇 > 卤代烃 > 一般的烃。
羧酸与质量相当的其它有机化合物相比,沸点较高。这与羧酸分子间可以形成氢键有关。
溶解度
相似相溶
- 极性分子易溶于极性溶剂,例如二氧化硫溶于水的程度比二氧化碳大,是因为二氧化硫是极性分子,水是极性溶剂。
- 非极性分子易溶于非极性溶剂,例如溴微溶于水但易溶于四氯化碳。
- 一般地,有机物之间均易溶,例如苯甲酸不溶于水,但易溶于乙醇和苯。
注意:判断物质分子是否为极性分子的标准是判断「正负电荷中心是否重合」,而不是分子中是否含有极性键。
亲水集团与疏水基团
常见亲水基团:氢键可以影响水溶性,含有氢键的一般都亲水,例如
常见疏水基团:烃基,酯基。
既含有亲水基团又含有疏水基团的物质有硬脂酸,例如
,其中 亲水, 亲水,可以用此原理来去污。
氢键的影响
与水分子形成氢键,溶解度提升。
例:如下图所示,碳酸氢钠两个碳酸氢根分子会形成分子间氢键,缔合形成大分子,所以溶解度比碳酸钠更小。
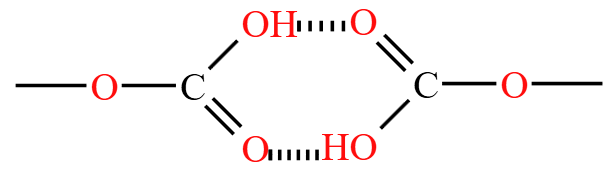
注意:不能加入四氯化碳萃取从而除去溴苯中的溴单质,根据有机物一般互溶,且四氯化碳与溴互溶,三者会互溶在一起,不能达到萃取的效果。
醇醛酮羧酸酯
大体上,都是随着碳数的增加溶解度逐渐减小。
常温下饱和的一元醇:
甲醛、乙醛、丙醛、丙酮等低级醛、酮均易溶于水。这里低级醛指的是碳数少。碳数越多,醛和酮溶于水的能力越差。
碳数
酯类微溶于水,难溶于饱和碳酸钠溶液(可以降低酯的溶解度),易溶于有机溶剂。
状态
对于烃来说,一般情况下(特例看题给信息):
- 碳数
- 碳数
有些物质在标况(
非烃类物质:
- 醇:甲醇常温下是气体,乙醇常温下是液体。
- 醚:二甲醚标况下是气体。
对于所有的有机物:
标况下:
- 只含
- 含
- 含
室温(
- 只含
- 含
- 含
补充:烷烃碳数
是固态,烯烃碳数 是固态。
密度与分层
一般研究液态物质,密度:
- 烃、酯 < 水。注意:带稠环的不一定,比如萘的密度大于水。
- 卤代烃 > 水。
- 硝基苯 > 水。
与苯有关的物质,苯和乙苯密度都小于水,硝基苯和溴苯密度都大于水。
一般情况烃和酯在水的上层,而卤代烃和硝基苯在水的下层。
烷烃:随着碳数增加,烷烃的密度逐渐增大。
卤代烃:随着碳数的增加,卤素
其它
苯是一种无色、有特殊气味、有毒的液体,易挥发,密度比水小,不溶于水,是良好的有机溶剂。苯可以把溴从溴水中萃取出来,但不能把其从溴的四氯化碳溶液中萃取出来。
苯酚:
- 无色、有特殊气味的晶体,长期暴露在空气中会变成粉红色。
- 微溶于冷水(一般在冷水中是白色浑浊),易溶于热水(
- 有一定的杀菌能力,可作杀菌消毒剂。
- 有毒,对皮肤有强烈的腐蚀性。若苯酚进入眼睛,则立刻用乙醇清洗,然后再用清水冲洗。
羧酸:
- 低级酸(碳数少的酸)具有强烈的刺激性气味,具有很强的挥发性。
- 纯净的乙酸俗称冰醋酸。
- 甲酸俗称蚁酸,最早在蚂蚁身上提取。是无色、带有刺激性气味的液体。
- 高级脂肪酸是不溶于水的蜡状固体。
酯:低级酯具有芳香气味。
有机物的鉴别和除杂
鉴别
核心三大问题:是否反应,是否溶解,上层下层(密度问题)。
常用试剂:
- 水:是否互溶(考虑水溶性),若不互溶,再考虑是否分层(考虑密度)。
- 酸性高锰酸钾:是否反应,若不反应,考虑是否分层(考虑密度);若能反应,则考虑是否褪色。
- 溴水:主要是两类反应,加成和取代,加成例如碳碳双键、碳碳三键,取代例如苯酚邻对位可以被溴取代。除此之外,还有一类靠的不是特别多的氧化反应,例如修水可以氧化醛基。
- 银氨溶液:主要鉴别醛基和还原糖,但由于其无色,用的没有新制氢氧化铜悬浊液更多。
- 新制氢氧化铜悬浊液:具有蓝色絮状沉淀,可以检验羧基,发生中和反应,沉淀被溶解掉;可以检验醛基,会产生砖红色沉淀
注:由于甲酸既有醛基又有羧基,可以直接用新制氢氧化铜悬浊液检验,即加入氢氧化铜悬浊液蓝色絮状沉淀消失,再加入氢氧化铜悬浊液产生砖红色沉淀。
常见物质鉴别:
乙酸和乙酸乙酯:用水鉴别。前者与水互溶,后者微溶于水,会和水分层。
苯和溴苯:用水鉴别。前者密度小于水,后者密度大于水。
苯和乙烯(己烯):溴水(或酸性高锰酸钾)。前者与溴水分层,在溶液上层,后者使得溴水褪色。
苯和甲苯:酸性高锰酸钾。前者不反应,后者褪色。(这里不能用溴水,因为甲苯只能和液溴反应)
注意:
- 一般涉及到需要鉴别物中含有乙醇的情况,优先考虑水。
- 一般涉及到酚和稀作为鉴别物,优先考虑溴水。苯酚能产生白色沉淀,烯能使溴水褪色。
- 一般涉及到甲酸作为鉴别物,优先考虑新制氢氧化铜悬浊液。
除杂
本质:利用物理性质差异。
核心三大思路:溶解度差异、转化为易溶于水的物质、转化为高沸点物质。
常见物质除杂:
| 物质 | 杂质 | 试剂 / 操作 |
|---|---|---|
| 乙烷 |
乙烯 / 乙炔 | 使用溴水洗气,乙烷不溶于溴水,会飘走,乙烯 / 炔变成高沸点物质溶于水中 |
| 己烷 |
乙醇 | 水洗,分液取上层(弃水层) |
| 硝基苯 | 浓硝酸 | 水洗,振荡静置分液弃水层 |
| 乙醇 | 水 | 加入生石灰 |
| 乙醇 | 乙酸 | 蒸馏(加入氧化钙 / 碱性的氢氧化钠固体) |
| 乙酸乙酯 | 乙酸、乙醇 | 饱和碳酸钠溶液(作用:吸收醇,中和酸,降低酯的溶解度) |
| 苯 | 苯酚 | 氢氧化钠溶液,振荡,静置,分层,弃水层(反萃取) |
| 苯 | 甲苯 | 蒸馏(同系物蒸馏往往是最好的方式) |
| 溴苯 | 溴 | 氢氧化钠溶液,振荡,静置,分层,弃水层 |
| 溴苯 | 苯 | 蒸馏 |
说明:
- 去除乙烷中的杂质乙烯 / 乙炔,不能使用酸性高锰酸钾,因为会引入杂质二氧化碳,不能使用溴的四氯化碳,因为乙烷和四氯化碳都是非极性分子,二者互溶,会导致乙烷损失。
- 去除乙醇中的杂质水 ,不能使用蒸馏,因为二者有氢键作用,会形成一种特殊的状态——共沸物。
- 去除乙醇中的杂质乙酸,不能使用氢氧化钠溶液,因为乙醇会溶于氢氧化钠水溶液。分离互溶的沸点不同的液体一般使用蒸馏来除杂。
- 去除苯中的杂质苯酚,二者虽然互溶,如果使用蒸馏可能会导致苯酚被氧化,所以一般不用蒸馏除杂。
- 除去苯中的杂质甲苯,不能使用酸性高锰酸钾,因为甲苯被高锰酸钾氧化后会形成苯甲酸,依然会溶于苯。
- 除去溴苯中的杂质溴,使用氢氧化钠溶液,这里苯环上的溴不会水解(苯环上的卤素不水解)。但若是除去溴乙烷中的杂质溴,则不能使用氢氧化钠,因为溴乙烷中的溴会被氢氧化钠溶解,应该使用碳酸钠溶液,碳酸钠的碱性更弱。乙酸乙酯中除杂乙酸和乙醇和这个类似。
- 不能利用与水密度的相对大小,用水分离苯和溴苯,因为苯和溴苯互溶,二者的作用力比水大。



【推荐】国内首个AI IDE,深度理解中文开发场景,立即下载体验Trae
【推荐】编程新体验,更懂你的AI,立即体验豆包MarsCode编程助手
【推荐】抖音旗下AI助手豆包,你的智能百科全书,全免费不限次数
【推荐】轻量又高性能的 SSH 工具 IShell:AI 加持,快人一步
· 无需6万激活码!GitHub神秘组织3小时极速复刻Manus,手把手教你使用OpenManus搭建本
· C#/.NET/.NET Core优秀项目和框架2025年2月简报
· 什么是nginx的强缓存和协商缓存
· 一文读懂知识蒸馏
· Manus爆火,是硬核还是营销?