【文化课学习笔记】【化学】选必三:烃的衍生物
【化学】选必三:烃的衍生物
如果你是从 B 站一化儿笔记区来的,请先阅读我在第一篇有机化学笔记中的「读前须知」(点开头的黑色小三角展开):链接
卤代烃
物理性质
溶解性
不溶于水,易溶于有机溶剂。
状态
常温下,卤代烃大多是液体或固体。
例外:一氯甲烷 \(\ce{CH3Cl}\) 和氯乙烷 \(\ce{CH3CH2Cl}\) 为气体。
拓展:用溴的四氯化碳和溴水都可以除去乙烯。乙烯可以和溴的四氯化碳发生加成反应生成二溴乙烷,和四氯化碳溶解;乙烯和溴水发生加成反应生成二溴乙烷,二溴乙烷的密度大于水,会沉在水的下面,溴水褪色。
密度和沸点
由于卤代烃中含有卤素,相对分子质量更大,所以卤代烃的密度和沸点都高于相应的烃。
随着碳数的增加,卤素 \(\ce X\) 数目相同的卤代烃的密度一般逐渐减小。原因:随着碳数的增加,含 \(\ce X\) 量逐渐减小,所以卤素的作用逐渐减小,密度就逐渐减小。
随着碳数的增加,卤素 \(\ce X\) 数目相同的卤代烃的沸点一般逐渐增大。
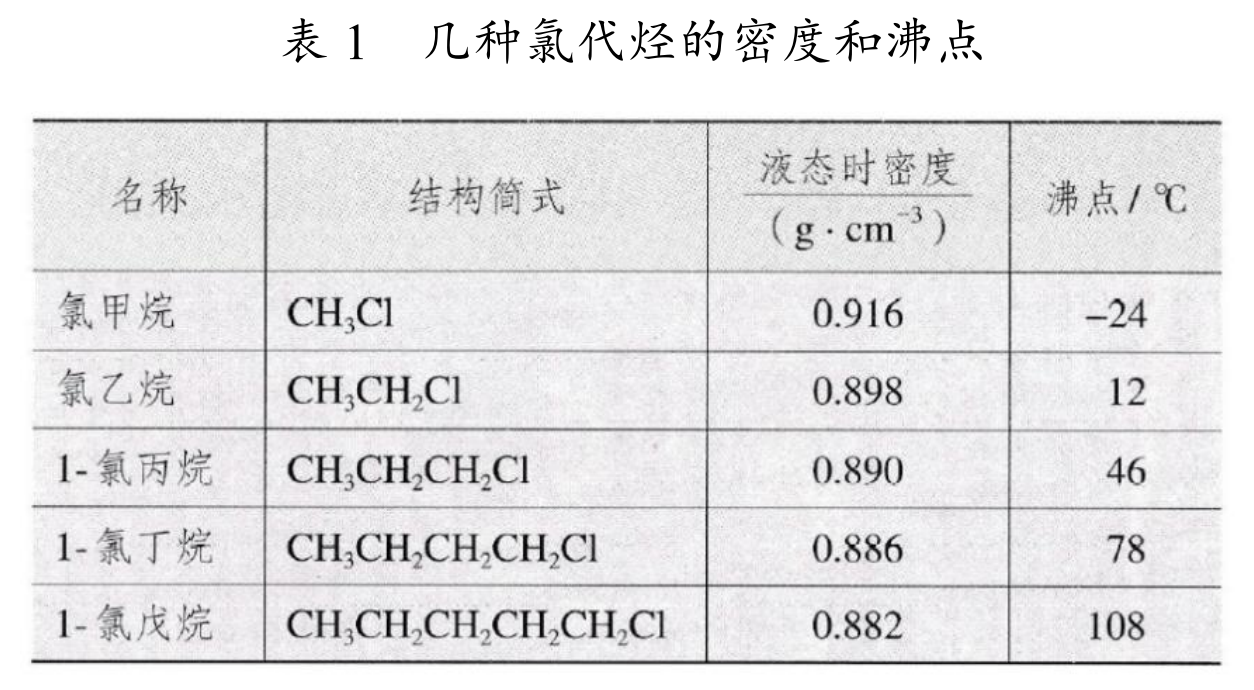
注意:由上表可以看出,在常温(\(\pu{25^\circ C}\))下,\(\ce{CH3Cl}\) 和 \(\ce{CH3CH2Cl}\) 是气态,其它卤代烃是液态。而在标况(\(\pu{0^\circ C}\))下, 只有 \(\ce{CH3Cl}\) 是气态,\(\ce{CH3CH2Cl}\) 和其它卤代烃是液态或固态。
应用:早期的冰箱一般利用一种沸点较高的卤代烃氟氯烃 \(\ce{CCl3F}\) 制成氟利昂制冷,后来发现氟氯烃中自由基太多,可能会逸散到大气中破坏臭氧层,所以不再使用。现在的冰箱一般用环戊烷制冷。
化学性质
取代反应(水解反应)
以 \(1-\) 溴丙烷的取代反应为例:
【实验用品】
\(1-\) 溴丙烷、\(5\%\ \ce{NaOH}\) 溶液,\(\pu{2 mol*L-1}\) 硝酸、\(2\%\ \ce{AgNO3}\) 溶液、试管、试管夹、酒精灯、胶头滴管。
实验药品的作用:
- \(1-\) 溴丙烷:研究卤代烃取代反应的机理。
- \(5\%\ \ce{NaOH}\) 溶液:使 \(1-\) 溴丙烷水解。
- \(\pu{2 mol*L-1}\) 硝酸:让水中的溴离子 \(\ce{Br-}\) 被硝酸酸化。
- \(2\%\ \ce{AgNO3}\) 溶液:检验溴离子。
【实验操作】
取一支盛有少量 \(1-\) 溴丙烷的试管,假如 \(\pu{1 mL}\ 5\%\ \ce{NaOH}\) 溶液,充分振荡,并稍加热一段时间后,冷却、静置,待液体分层后,用滴管小心吸取少量上层液体,移入另一支盛有 \(\pu{1 mL}\ \pu{2 mol*L-1}\) 硝酸的试管中,然后假如 \(2\sim 3\) 滴 \(2\%\ \ce{AgNO3}\) 溶液,观察现象。
【实验现象】
试管中由淡黄色沉淀出现。
【实验解释】
\(1-\) 溴丙烷的密度一般较大,大于 \(\ce{NaOH}\) 溶液,且二者不互溶。所以加入 \(\ce{NaOH}\) 溶液后,\(1-\) 溴丙烷在试管下层,而 \(\ce{NaOH}\) 溶液在上层。\(\ce{NaOH}\) 会和 \(1-\) 溴丙烷发生反应,使得下层的 \(1-\) 溴丙烷中的 \(\ce{C-Br}\) 键断裂,\(\ce{Br-}\) 进入上层溶液中。在上层液体(水层)中吸取少量液体后,用硝酸酸化 \(\ce{Br-}\) 后,若滴入 \(\ce{AgNO3}\) 可以产生淡黄色沉淀,证明生成了 \(\ce{AgBr}\) 沉淀,即 \(\ce{NaOH}\) 成功和 \(1-\) 溴丙烷发生加成反应使得 \(\ce{C-Br}\) 键断裂。
【反应机理】
\(1-\) 溴丙烷和 \(\ce{NaOH}\) 发生水解反应,生成丙醇和溴化钠,方程式如下:
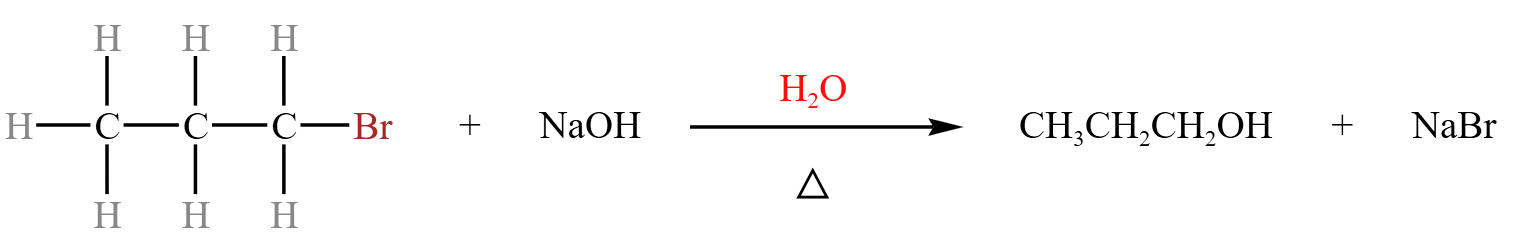
通过这个反应可以看出,碳卤键比碳氢键更容易断裂,即键的极性:\(\ce{C-X > C-H > C-C}\)。
【其它取代反应】
卤代烃被氢氧化钠水解,断开 \(\ce{C-X}\) 键,断开后碳原子与羟基 \(\ce{-OH}\) 结合生成醇。
例如:\(1,2-\) 二溴乙烷与氢氧化钠反应生成乙二醇和溴化钠,方程式如下:
特例:若卤素直接相连在苯环上,即溴苯 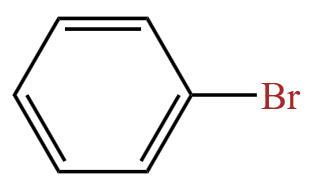 在氢氧化钠溶液加热条件下,几乎不水解。
在氢氧化钠溶液加热条件下,几乎不水解。
注意:若题目问溴苯与氢氧化钠反应最多消耗几摩尔氢氧化钠,则氢氧化钠在高温高压的条件下,溴苯会被水解为苯酚
,由于生成的苯酚具有一定酸性,所以它会和具有碱性的氢氧化钠再次反应,得到的产物实际上是苯酚钠
和溴化钠,所以最多会消耗 \(\pu{2 mol}\) 氢氧化钠。
【除杂】
-
除去溴苯中混有少量的 \(\ce{Br2}\),可以通过 \(\ce{NaOH}\) 溶液反萃取除去 \(\ce{Br2}\)。实验操作:加入 \(\ce{NaOH}\) 溶液充分振荡后分液。原因:溴苯中的 \(\ce{Br2}\) 会与 \(\ce{NaOH}\) 反应生成可溶于水的物质,而 \(\ce{NaOH}\) 不会水解溴苯上的溴,所以 \(\ce{NaOH}\) 能够除去杂质 \(\ce{Br2}\)。
-
除去溴乙烷中混有少量的 \(\ce{Br2}\),不能通过 \(\ce{NaOH}\) 溶液反萃取除去 \(\ce{Br2}\)。原因:\(\ce{NaOH}\) 除了会把杂质 \(\ce{Br2}\) 除去之外,溴乙烷也会与 \(\ce{NaOH}\) 发生反应,使得溴乙烷水解,\(\ce{C-Br}\) 键断裂。拓展:可以通过 \(\ce{Na2CO3}\) 之类的物质除杂。
消去反应
定义
有机物在一定条件下,从一个分子中脱去一个或几个小分子,而生成含不饱和键的化合物的反应,叫消去反应。
注:
- 消去反应类似加成反应的逆反应。
- 高中阶段学过的消去反应一般都是 \(\beta-\) 消去,因为一般情况下是邻碳上的两个分子脱落发生消去反应。具体下面会说到。
反应条件&结构要求
反应条件:\(\ce{NaOH}\) 醇溶液,加热。
结构要求:\(\beta-\) 碳(邻碳)上存在氢。
注意:苯环由于其稳定的大 \(\pi\) 键结构,一般不能发生消去反应。
反应机理
\(1-\) 溴丙烷的消去反应:
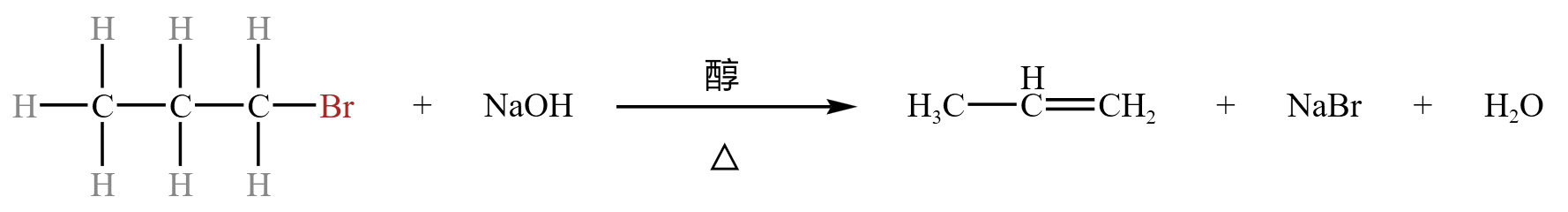
我们称与 \(\ce{Br}\) 相连的碳为 \(\alpha\) 碳,与 \(\alpha\) 碳相邻的碳为 \(\beta\) 碳,则 \(1-\) 溴乙烷和 \(\ce{NaOH}\) 反应,\(\alpha\) 碳上的 \(\ce{Br}\) 和 \(\beta\) 碳上的一个 \(\ce{H}\) 会脱去形成 \(\pi\) 键,得到 \(\ce{CH3-CH=CH2}\),而脱去的 \(\ce{H}\) 和 \(\ce{Br}\) 形成 \(\ce{HBr}\) 和 \(\ce{NaOH}\) 发生中和反应生成 \(\ce{NaBr}\) 和 \(\ce{H2O}\)。
这种邻碳上的分子脱落发生消去反应,就叫做 \(\beta -\) 消去。
检验乙烯:
- 先通入水溶液中,除去挥发的醇;然后再通入酸性 \(\ce{KMnO4}\) 溶液中,若溶液褪色,则证明产生了丙烯。
- 直接通入到溴水中,若溶液褪色,则证明产生了丙烯。
注意:第一种方法必须先通入水溶液中,因为醇可以被酸性 \(\ce{KMnO4}\) 氧化使得其褪色,所以需要排除醇防止干扰检验;而第二种方法种,醇不与溴水发生反应,所以可以直接通入溴水,检验是否产生丙烯。
\(2-\) 溴丁烷的消去反应:
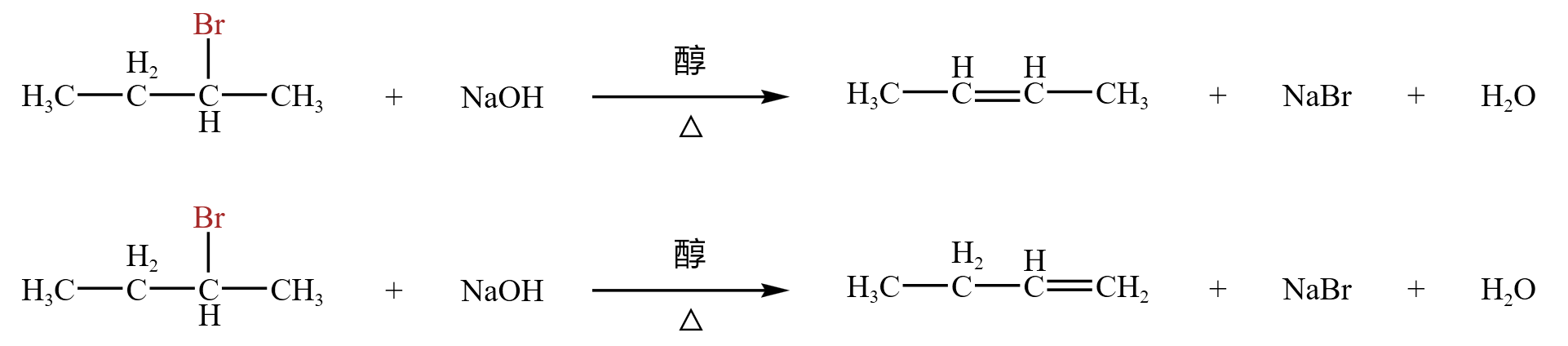
上述两种情况都有可能,但一般情况下第一种情况较多,第二种情况较少。即一般谁氢少,就消去谁的氢,属于「扎氏规则」,与「马氏规则」类似。
\(1,2-\) 二溴乙烷的消去反应:

即从左到右,\(1\) 号碳上的溴和 \(3\) 号碳上的氢一同消去,\(4\) 号碳上的溴和 \(2\) 号碳上的氢一同消去,需要消耗 \(\pu{2 mol}\ \ce{NaOH}\),生成乙炔 \(\ce{HC#CH}\)。
产物
卤代烃消去反应,如果只有一个卤素分子,则得到单烯(例如 \(1-\) 溴己烷);若是双卤素分子,可能得到炔(例如 \(1,2-\) 二溴乙烷),也可能得到二烯(例如 \(2,3-\) 二溴丁烷可能得到 \(1,3-\) 丁二烯)。
水解反应和消去反应对比
卤代烃水解反应和消去反应对比如下:
| 水解反应 | 消去反应 | |
|---|---|---|
| 反应条件 | \(\ce{NaOH}\) 水溶液,加热 | \(\ce{NaOH}\) 醇溶液,加热 |
| 结构要求 | 存在 \(\ce{R-X}\),其中 \(\ce R\) 非苯环 | 邻碳(\(\beta-\) 碳)有氢(或有 \(\beta - \ce H\)) |
卤素原子的引入和转化
示例一:氯乙烷
氯乙烷是含有一个卤素原子的卤代烃的代表。
氯乙烷作为生成物的反应:
- 甲烷通过取代反应,加入氯气,在光照条件下可以生成 \(\ce{CH3CH2Cl}\)。
- 乙烯通过加成反应,加入 \(\ce{HCl}\) 和催化剂,可以生成 \(\ce{CH3CH2Cl}\)。
氯乙烷作为反应物的反应:
- 氯乙烷和 \(\ce{NaOH}\) 水溶液,在加热条件下,发生水解反应,得到乙醇。
- 氯乙烷和 \(\ce{NaOH}\) 醇溶液,在加热条件下,发生消去反应,得到乙烯。
如下图所示:
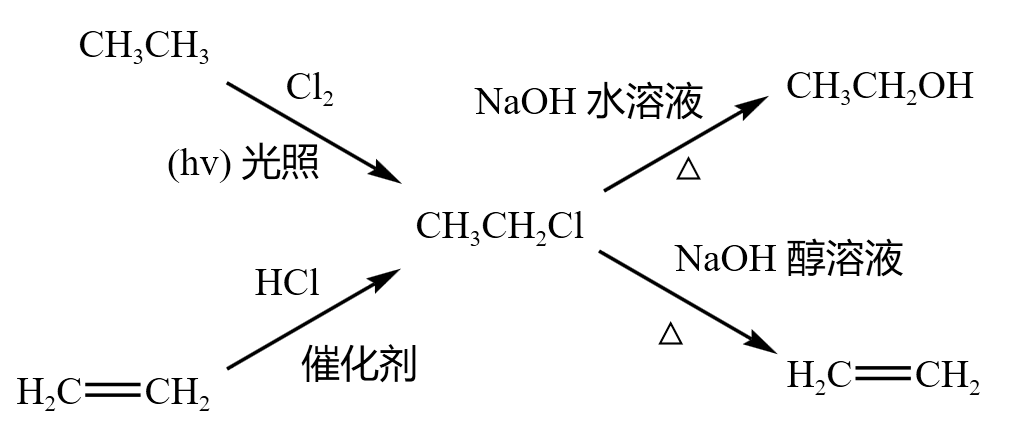
注意:如果通过乙烯加成得到氯乙烷,之后氯乙烷一定是和 \(\ce{NaOH}\) 水溶液发生水解反应,一般题目中不会再通过消去反应变回乙烯。
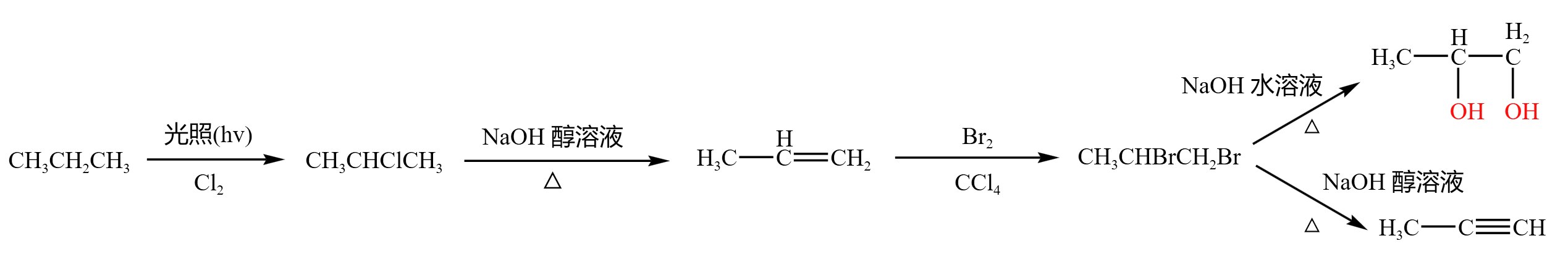
示例二:\(1,2-\) 氯丙烷
\(1,2-\) 二氯丙烷是邻二卤代烃的代表。
\(1,2-\) 二氯丙烷作为生成物:
丙烷通过取代反应,加入氯气,可以在光照条件下生成 \(\ce{CH3CHClCH3}\),然后再通过消去反应,得到 \(\ce{CH3-CH=CH2}\),再通过加成反应,与溴的四氯化碳反应得到 \(\ce{CH3CHBrCH2Br}\)。
\(1,2-\) 二溴丙烷作为反应物:
- 和 \(\ce{NaOH}\) 水溶液,在加热条件下发生水解反应,得到丙二醇。
- 和 \(\ce{NaOH}\) 醇溶液,在加热条件下发生消去反应,得到 \(\ce{CH3-C#CH}\)。
如下图所示:
总结
卤素原子的引入一般有两种方法:取代反应或加成反应。
卤素原子的转化一般也有两种方法:水解反应(变成醇),消去反应(变成双键或三键)。
有机物的高聚物
常见的应用是聚四氟乙烯 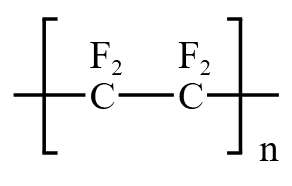 ,被称为不粘锅的涂层,是特弗伦材料,性质很稳定。
,被称为不粘锅的涂层,是特弗伦材料,性质很稳定。
醇
物理性质
溶解性
一般情况下,能够和水分子形成氢键的基团,例如羟基 \(\ce{-OH}\),我们称为亲水基,而对于烷基等只含碳氢的基团,我们称为疏水基。那么亲水基占比越高,物质溶解性更大,反之更小。
所以羟基数量相同,碳数越多,溶解性越差;碳数相同,羟基越多,溶解性越大。
常温下饱和的一元醇:
- \(\ce{C} \le 3\) 能与水以任意比例互溶。
- \(4 \le \ce C \le 11\) 是油状液体,仅可部分溶于水。
- \(\ce C \ge 12\) 是固体,难溶于水。
熔沸点
饱和一元醇,碳数越多,分子量越大,熔沸点越高。如下图所示。
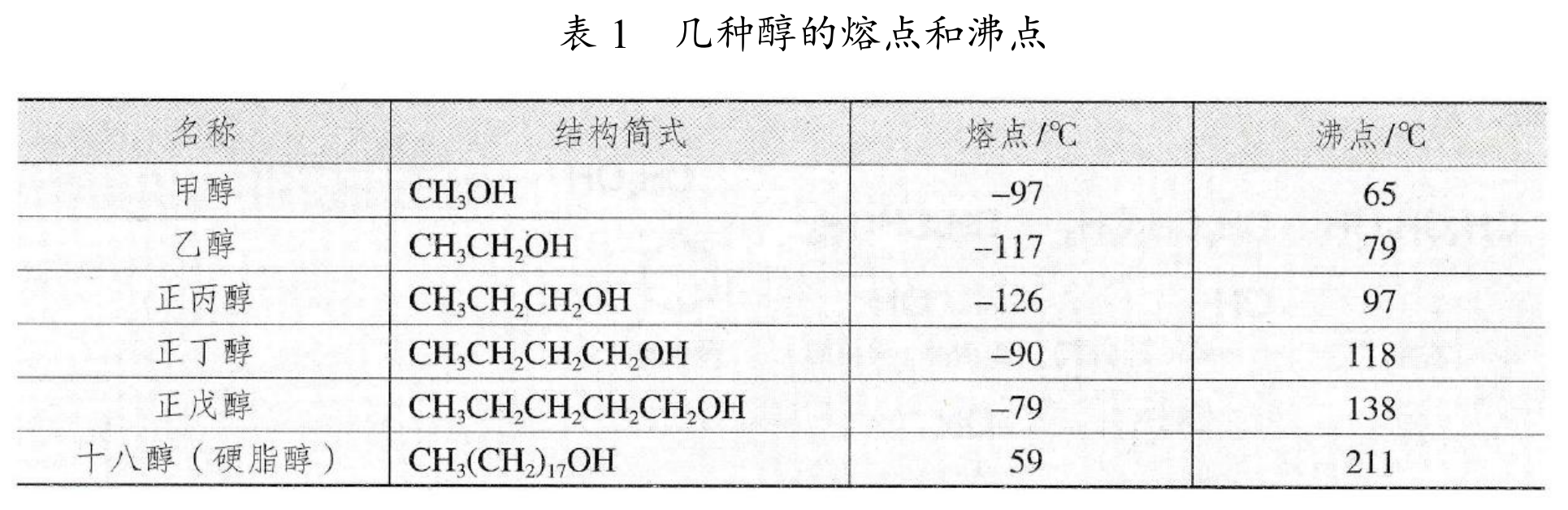
碳数相同时,羟基越多,分子间作用力更强,熔沸点越高。例如 \(\ce{CH2OH-CHOH-CH2OH}\) 的熔沸点高于 \(\ce{CH3CH2CH2OH}\)。
相对分子质量相近的醇和烷烃、烯烃相比,沸点更高。
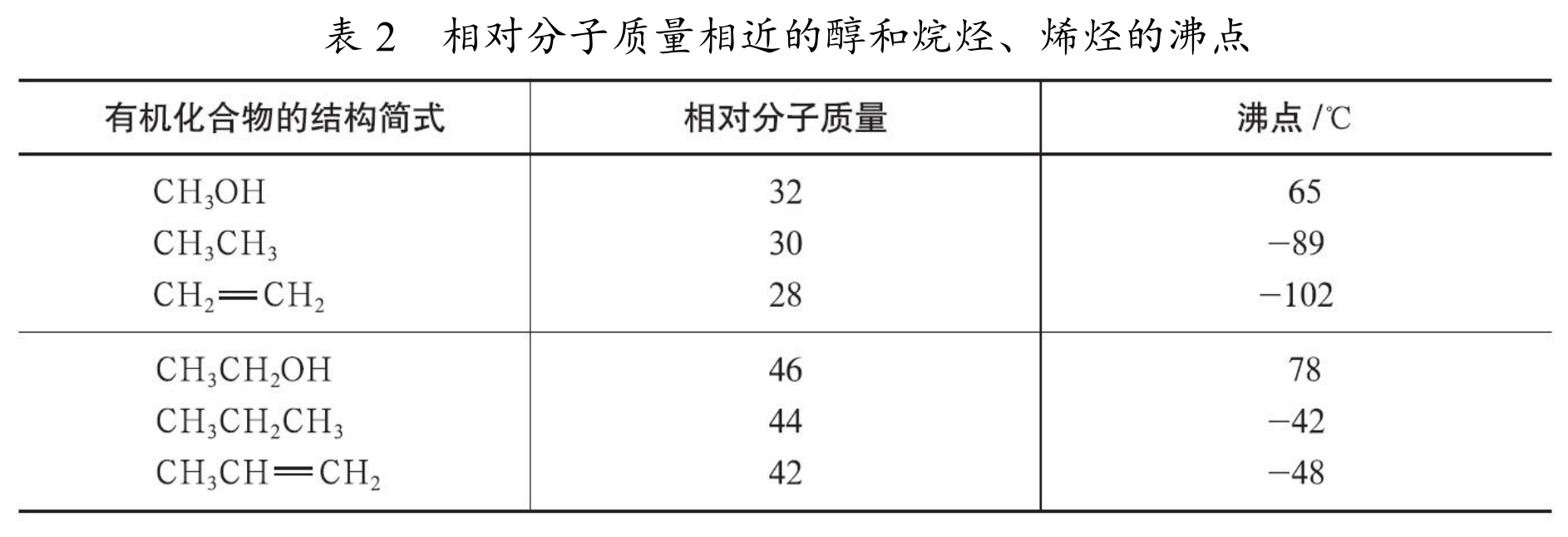
化学性质
取代反应
与 \(\ce{Na}\) 反应
羟基 \(\ce{-OH}\) 上的氢可以与钠置换,如下:
与 \(\ce{HX}\) 反应
以和 \(\ce{HCl}\) 反应为例:
醇上的羟基被 \(\ce{Cl-}\) 取代,\(\ce{-OH}\) 和 \(\ce{H+}\) 结合生成水,如下:
注意:卤代烃和 \(\ce{NaOH}\) 水溶液在加热条件下会发生水解,生成醇;而醇也可以与 \(\ce{HX}\) 发生取代反应重新转化为卤代烃。所以二者在一定条件下可以互相转化,一般情况下如果溶液中卤素较多,则转化为卤代烃,若羟基较多则转化为醇。
酯化反应
口诀:酸脱羟基醇脱氢。
方程式:
验证:
使用同位素标记法,将羟基上的氧标记为 \(\ce{^{18}O}\),反应后发现 \(\ce{^{18}O}\) 在 \(\ce{R'COOR}\),即:
说明了酸脱羟基醇脱氢。
反应中浓硫酸的作用:①催化剂;②吸水。
成醚反应
消去反应
乙醇的消去反应如下:
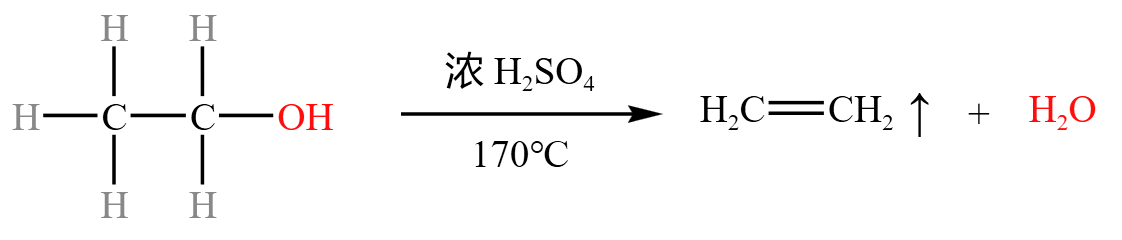
我们称与羟基 \(\ce{-OH}\) 相连的碳为 \(\alpha\) 碳,与 \(\alpha\) 碳相邻的碳为 \(\beta\) 碳,则 \(\alpha\) 碳上的 \(\ce{-OH}\) 和 \(\beta\) 碳上的 \(\ce{H}\) 会脱去,生成 \(\pi\) 键,得到乙烯 \(\ce{CH2=CH2}\),脱去的 \(\ce{-OH}\) 和 \(\ce{H}\) 结合得到水 \(\ce{H2O}\)。
注意:
- 控制温度在 \(\pu{170^\circ C}\) 时需要使用温度计,使用温度计测量温度时一定要插入到液面以下。
- 乙醇的消去反应是 \(\beta-\) 消去。
检验乙烯:乙醇脱水变乙烯后,乙烯还可能再次在浓硫酸的作用下脱氢,最后被碳化,所以产生的乙烯中可能会混有 \(\ce{CO2}\)、\(\ce{SO2}\) 和 \(\ce{H2O}\) 水蒸气。由于 \(\ce{SO2}\) 具有还原性,所以能使高锰酸钾和溴水褪色,也能使得溴的四氯化碳褪色,不能使用这三个试剂检验乙烯。所以需要先用 \(\ce{NaOH}\) 洗气,除去 \(\ce{SO2}\),再检验乙烯。
口诀:浓硫酸一百七,乙醇脱水变乙烯。检验乙烯用碱洗,液面以下温度计。
拓展:若温度是 \(\pu{140^\circ C}\),则会有副产物,即两个乙醇分子间脱水生成乙醚 \(\ce{CH3CH2OCH2CH3}\)。所以一般不能通过乙醇的消去反应来制备乙烯,可能会混油副产物乙醚。
氧化反应
燃烧
醇在点燃的条件下会和氧气发生反应生成二氧化碳和水,不做赘述。
注意:有机物燃烧,所以键都断裂。
酸性 \(\ce{KMnO4}\)/酸性 \(\ce{K2Cr2O7}\) 氧化
以高锰酸钾为例:
酸性高锰酸钾氧化 \(\ce{R-CH2OH}\) 可使得酸性高锰酸钾溶液褪色。反应的中间产物是醛 \(\ce{R-CHO}\),最终产物为羧酸 \(\ce{R-COOH}\)。如下:
从醇到醛少了两个氢,从醛到酸加了一个氧,即去氢加氧。
注意:能够使酸性高锰酸钾褪色的醇必须满足 \(\alpha\) 碳上有氢,不一定必须得是两个氢,即不一定是 \(\ce{-CH2OH}\),只要有氢就都可以被酸性高锰酸钾氧化,但只有 \(\ce{R-CH2OH}\) 生成醛。
催化氧化
总反应:
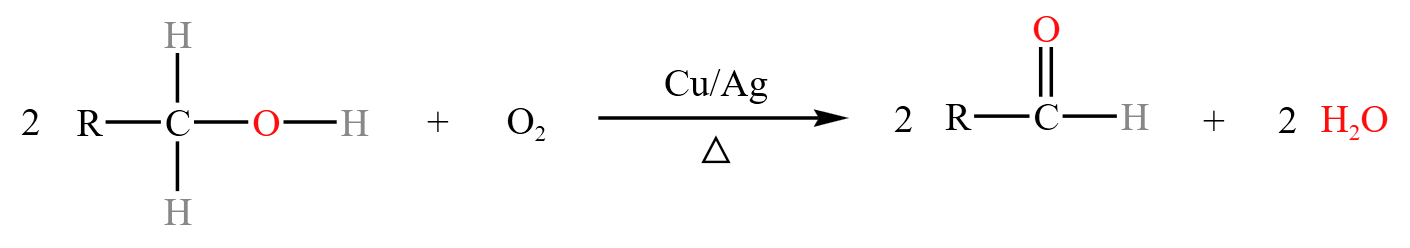
分步反应:
即 \(\alpha\) 碳上脱去一个 \(\ce{H}\),羟基上脱去一个 \(\ce{H}\),生成醛,从中可以看出 \(\ce{Cu}\) 是催化剂。
注:
- 这种氧化叫做 \(\alpha -\) 氧化,只有与羟基直接相连的碳(\(\alpha\) 碳)上有氢,才能发生 \(\alpha-\) 氧化。
- 若将铜丝在酒精灯外焰灼烧,铜丝变黑。原因:与氧气发生反应生成氧化铜。然后将烧黑的铜丝移进酒精灯内焰,发现铜丝再次变红。原因:酒精灯的内焰是乙醇,挥发出的乙醇与氧化铜发生催化氧化生成乙醛,还原回铜。
在上述的基础上,当 \(\alpha\) 碳上少去一个氢(只有一个氢)时,反应为:
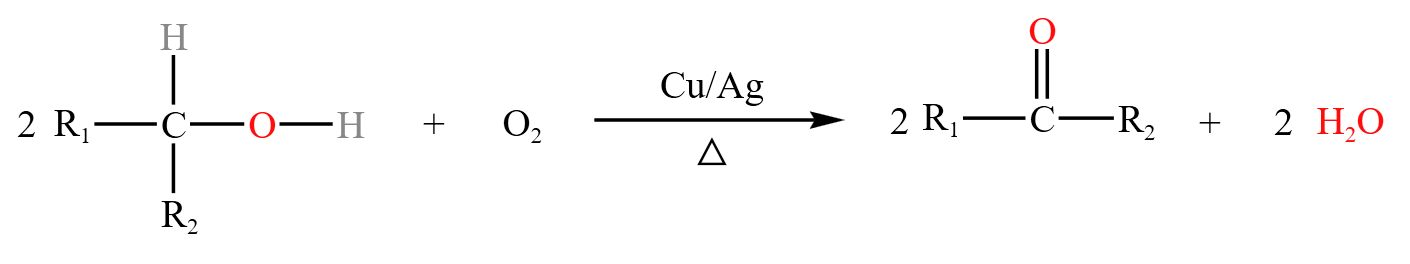
此时得到羰基,生成酮。
当 \(\alpha\) 碳上再少去一个氢,即没有氢时,此时不再发生催化氧化反应。
总结:醇的催化氧化得到的产物可能是醛或酮。
乙醇的催化氧化:
乙醇在铜丝的作用下,和氧气加热,即烧红的铜丝插入到乙醇里,有刺激性气味生成(乙醛)。
注意:消去反应的条件是与 \(\ce{-OH}\) 直接相连的碳的邻碳(即 \(\beta\) 碳)上必须有氢,而催化氧化的条件是与 \(\ce{-OH}\) 直接相连的碳(\(\alpha\) 碳)上必须有氢。
酚
自然界中的酚
芳香烃上直接接羟基的结构被称为酚。
有些植物中含有丁香酚、麝香草酚、芝麻酚等。如下图所示。

苯酚的物理性质
- 无色、有特殊气味的晶体,长期暴露在空气中会变成粉红色。原因:苯酚在空气中可能会被氧化为对苯醌
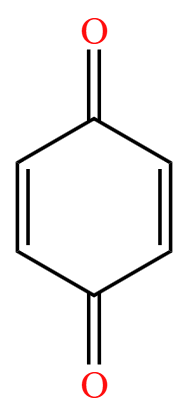 。注意:苯醌中的环不是苯环,所以苯醌不是芳香族化合物。
。注意:苯醌中的环不是苯环,所以苯醌不是芳香族化合物。 - 微溶于冷水(一般在冷水中是白色浑浊),易溶于热水(\(\pu{65^\circ C}\) 以上互溶),易溶于有机溶剂。
- 有一定的杀菌能力,可作杀菌消毒剂。
- 有毒,对皮肤有强烈的腐蚀性。若苯酚进入眼睛,则立刻用乙醇清洗,然后再用清水冲洗。
化学性质
弱酸性
与醇类不同,酚类具有弱酸性。
苯酚中,酚羟基中氧的电子云会与苯环肩并肩,有可能电离出很少的 \(\ce{H+}\),从而呈弱酸性,如下:
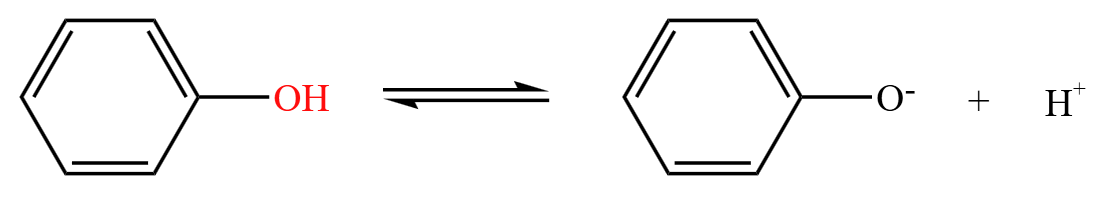
注意:虽然苯酚可以电离出 \(\ce{H+}\),但这个过程很弱,平衡常数只有 \(10^{-10}\) 这个级别。
由于苯酚的弱酸性,它俗称石炭酸。苯酚的弱酸性,体现了苯环对羟基的影响。
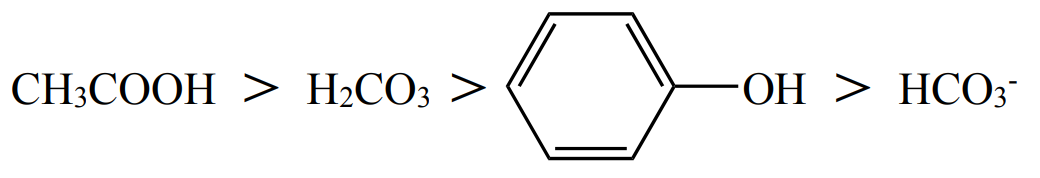
根据下图可知,苯酚的弱酸性介于 \(\ce{H2CO3}\) 和 \(\ce{HCO3-}\) 之间,即弱酸性 \(\ce{H2CO3 > 苯酚 > HCO3-}\)。
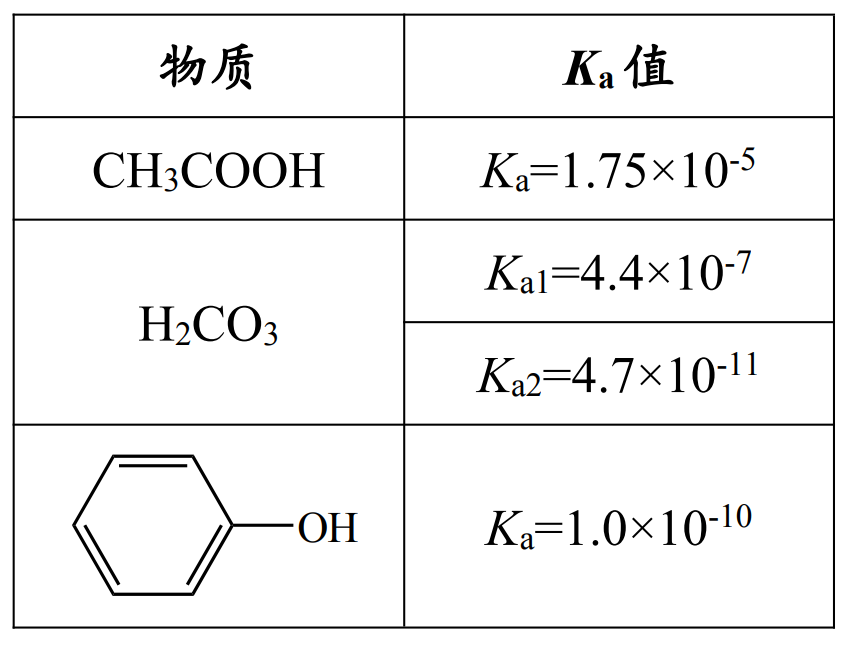
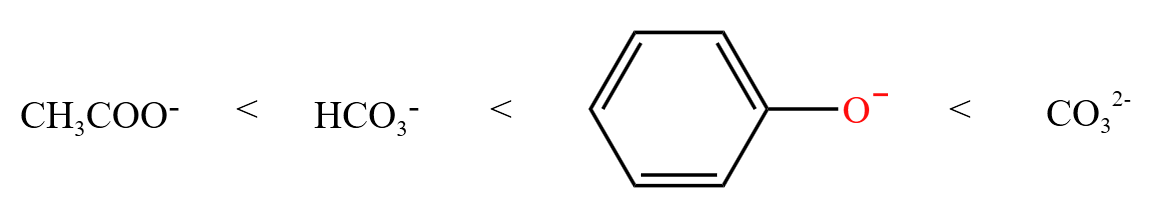
根据「强酸制弱酸」,苯酚可以与碳酸根反应得到碳酸氢根,但不能和碳酸氢根反应。
和醇类似,苯酚也可以与钠发生反应,生成苯酚钠和氢气。同理,苯酚也可以与 \(\ce{NaOH}\) 和 \(\ce{Na2CO3}\) 反应。反应方程式如下:
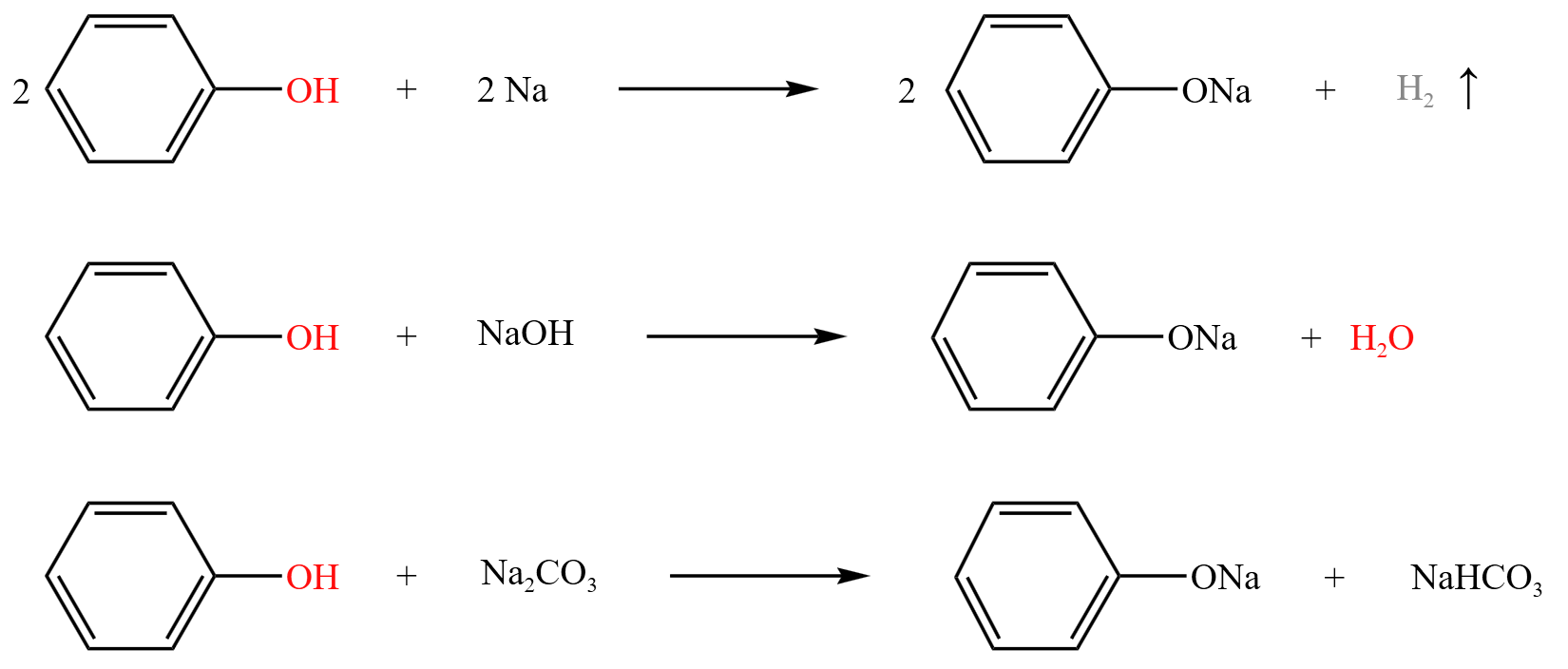
由于苯酚的弱酸性介于碳酸和碳酸氢根之间,所以苯酚不能和碳酸氢钠反应。
小结:
| 反应物 | 醇 | 酚 | 羧酸 |
|---|---|---|---|
| \(\ce{Na}\) | 反应 | 反应 | 反应 |
| \(\ce{NaOH}\) | 不反应 | 反应 | 反应 |
| \(\ce{Na2CO3}\) | 不反应 | 反应 | 反应 |
| \(\ce{NaHCO3}\) | 不反应 | 不反应 | 反应 |
注:高中阶段能与碳酸氢钠反应的官能团只有羧酸。例如,水杨酸
中既含有羟基又含有羧基,只有羧基能与碳酸氢钠反应,生成
。
取代反应
在苯酚上,酚羟基可以活化苯环邻对位,从而使得邻对位上被溴取代,即:
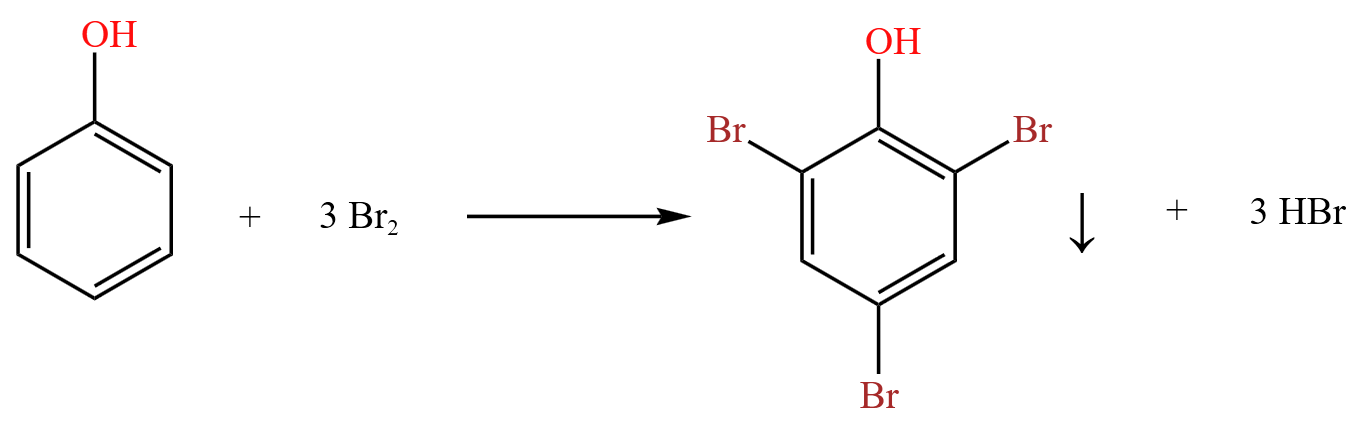
将浓溴水加入到含苯酚的试管中,观察到有白色沉淀生成。这里的白色沉淀是三溴苯酚。如下图所示。

这个反应体现了羟基对苯环的影响,羟基活化了苯环的邻对位。
用途:由于该实验非常灵敏,所以可用于定量定性检验苯酚。
羟基活化苯环的邻对位体现了羟基对苯环的影响,苯酚具有弱酸性体现了苯环对羟基的影响,所以官能团之间会相互影响。
拓展——辨析液溴、溴水和溴的四氯化碳的区别与用途:
- 液溴:深红棕色液体,高中阶段只有与苯环发生取代反应生成溴苯中使用了液溴。除此之外高中的有机实验中不使用液溴。(2024.10.20 upd:事实上,高中阶段还有甲苯可以和液溴发生反应,这里「除此之外高中的有机实验中不使用液溴」指的是高中化学专门讲解过的有机实验中确实涉及液溴的只有苯环,并没有专门讲解甲苯与液溴发生反应的实验,但是从高中化学涉及的化学反应来看,确实除了苯环之外还有甲苯能与液溴发生反应。感谢评论区 @along1114 的指出。)
- 溴的四氯化碳:高中阶段与碳碳双键或三键发生加成反应,除此之外没有其他作用。
- 溴水:高中阶段取代和加成反应都会用到,也有一点氧化性。取代反应一般是取代苯环邻对位,加成反应一般是与碳碳双键或三键加成。
加成反应
苯酚会和氢气发生加成反应:
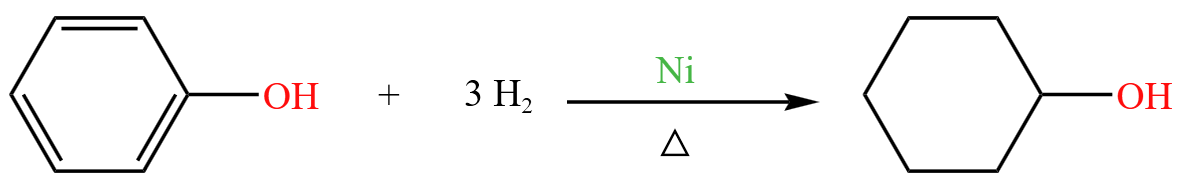
体现了苯环可以和氢气加成的特点。
成酯反应
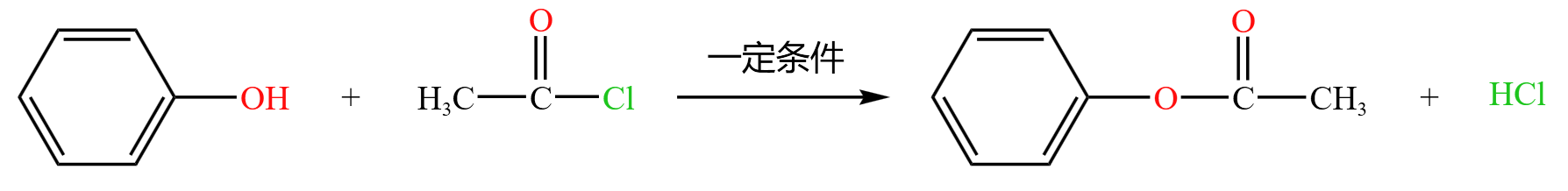
类似于酯化反应,苯酚和乙酰氯反应时,酚脱去羟基中的一个 \(\ce H\),乙酰氯脱去 \(\ce{-Cl}\),生成乙酰苯酚酯和氯化氢。如下:
两分子乙酸脱水缩合结合生成乙酸酐,乙酸酐与苯酚发生成酯反应,得到乙酰苯酚酯和乙酸。如下:

生成的乙酸回收完后在一定条件下又会重新脱水缩合形成乙酸酐,从而可以循环反应。
成酯反应的本质仍是取代,与酯化反应不同的是,酯化反应的对象是酸和醇,酸脱羟基醇脱氢,而成酯反应的对象是酰卤或酸酐和酚反应,酚脱氢。
氧化反应
- 苯酚能在氧气中燃烧,生成二氧化碳和水。
- 苯酚能在空气中氧化,生成粉红色物质苯醌。
- 苯酚能被酸性 \(\ce{KMnO4}\) 氧化。
保护酚羟基:
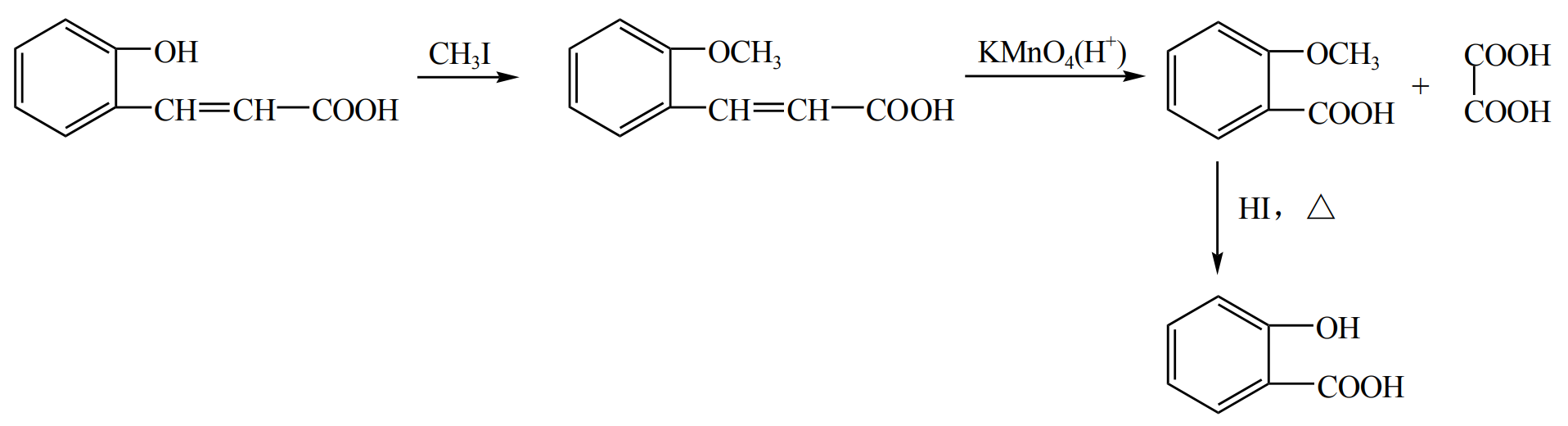
在含有酚羟基的有机物中,可以先通过某些物质使得酚羟基变为醚或醛,从而保护酚羟基不被酸性高锰酸钾直接氧化,例如下面是制备水杨酸的过程。
显色反应
不同的酚遇到三价铁会显示不同的颜色,苯酚遇到 \(\ce{Fe^3+}\) 会显紫色。
用途:检验是否存在酚羟基。
醛和酮
命名及基本知识(复习)
醛和酮中都含有官能团羰基  ,若羰基旁边有氢相连,就叫做醛基
,若羰基旁边有氢相连,就叫做醛基 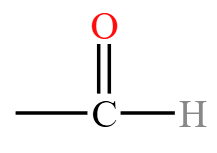 ,若羰基的左右两侧都连的是碳,则叫做酮羰基
,若羰基的左右两侧都连的是碳,则叫做酮羰基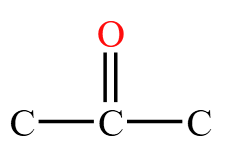 。
。
醛和酮都较为活泼。醛可以被醇氧化得到,醛自身又能氧化成酸,可以认为醛是醇和酸的「中间价态」。
自然界中的醛和酮
桂皮中含有肉桂醛,在有机化学中很常见,让与醛基相连的碳作为 \(\alpha\) 碳,与 \(\alpha\) 碳相连的碳为 \(\beta\) 碳,则肉桂醛命名为 \(\alpha,\beta -\) 不饱和醛(酮)。肉桂醛很活泼,一般通过羟醛缩合反应来制备它。
除此之外,杏仁中含有苯甲醛,如下:

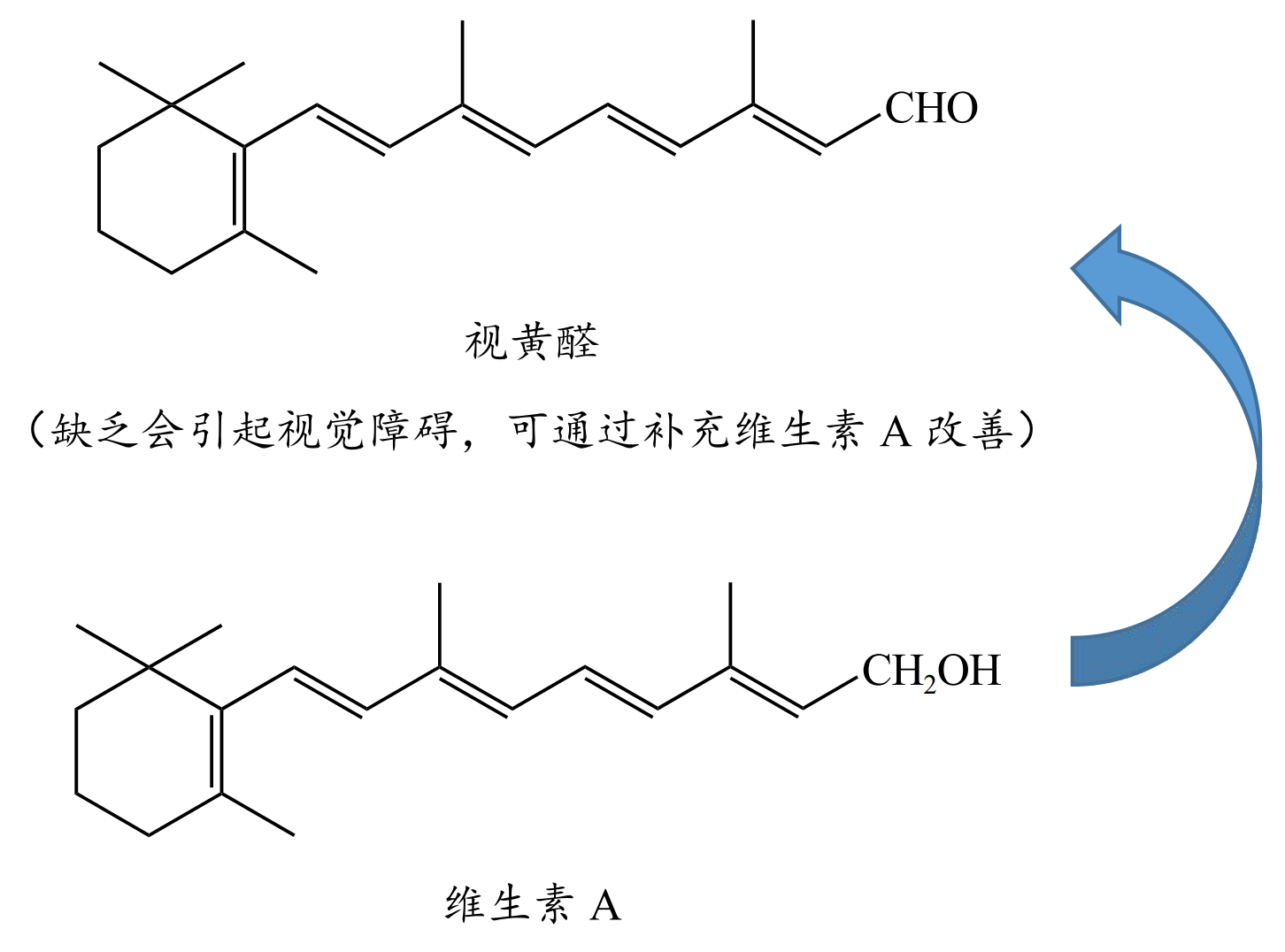
有一种醛叫视黄醛,缺乏可能会引起视觉障碍,可通过补充维生素 A 改善。视黄醛也属于 \(\alpha,\beta-\) 不饱和醛,在自然界中非常常见。如下:
除此之外,还有 \(2-\) 庚酮,如下:

物理性质
溶解性
甲醛、乙醛、丙醛、丙酮等低级醛、酮均易溶于水。这里低级醛指的是碳数少。碳数越多,醛和酮溶于水的能力越差。
特殊地,甲醛的水溶液(质量分数为 \(40\%\))俗称福尔马林,是常见的防腐剂,原理是使得蛋白质变性。
状态
烃的含氧衍生物中,除甲醛外,其余在标况下均为液体或固体。
对于所有的有机物:
标况下:
- 只含 \(\ce{C、H}\) 两种元素,即烃类物质:碳数 \(\le 4\) 的有机物为气体。
- 含 \(\ce{Cl}\) 元素:一氯甲烷 \(\ce{CH3Cl}\) 为气体。
- 含 \(\ce O\) 元素:甲醛 \(\ce{HCHO}\) 和二甲醚 \(\ce{CH3-O-CH3}\) 为气体。
室温(\(\pu{25 ^\circ C}\))下:
- 只含 \(\ce{C、H}\) 两种元素,即烃类物质:除标况外,还有新戊烷为气体。
- 含 \(\ce{Cl}\) 元素:除标况外,还有一氯乙烷 \(\ce{CH3CH2Cl}\) 为气体。
- 含 \(\ce O\) 元素:除标况外,还有乙醛 \(\ce{CH3CHO}\) 为气体。
特例:二甲醚的沸点是 \(\pu{-9^\circ C}\),标况下为气体。
醛的化学性质
氧化反应
燃烧
醛在空气中燃烧,生成二氧化碳和水。
酸性 \(\ce{KMnO4}\) 氧化
醛可以被酸性 \(\ce{KMnO4}\) 氧化,形成羧基。如下:
所以醛基可以使得酸性高锰酸钾褪色。
溴水氧化
溴水具有一定的氧化性,醛基的还原性很强,所以二者可以发生氧化还原反应,如下:
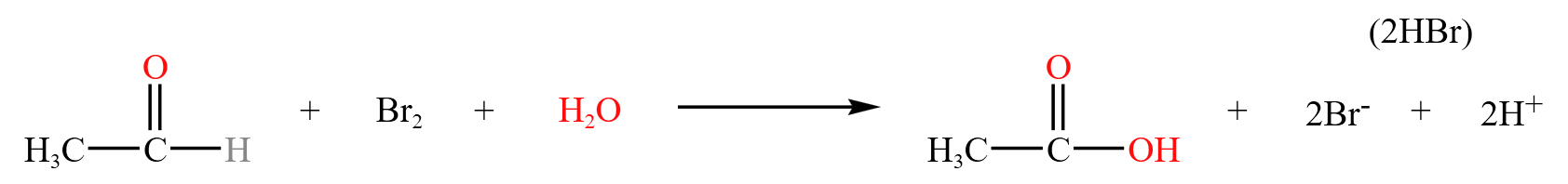
在反应中,醛基 \(+2\) 价,溴 \(-2\) 价。
总结:醛可以使得酸性高锰酸钾和溴水褪色。
催化氧化
醛被催化氧化后形成酸,如下:
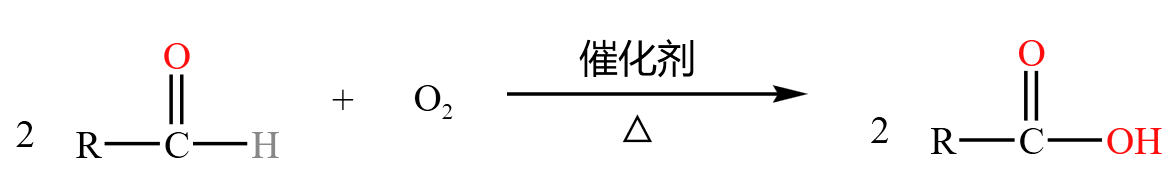
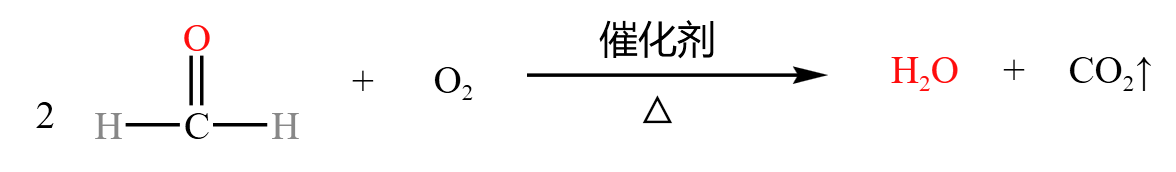
例如甲醛被催化氧化后生成碳酸,碳酸分解形成二氧化碳和水,如下:
弱氧化剂氧化
注:
- 弱氧化剂能氧化醛基说明了醛基的还原性很强。
- 以下两种反应都是检验醛基的思路。
【银镜反应】
银镜反应是指醛基在弱氧化剂的作用下,有可能氧化成羧酸根。如下所示,银镜反应中,醛基升 \(2\) 价,银降 \(1\) 价,醛被氧化成羧酸,羧酸在碱性溶液中变成羧酸根,与铵根结合生成羧酸铵盐。可通过升降化学价,看氧补水配平。
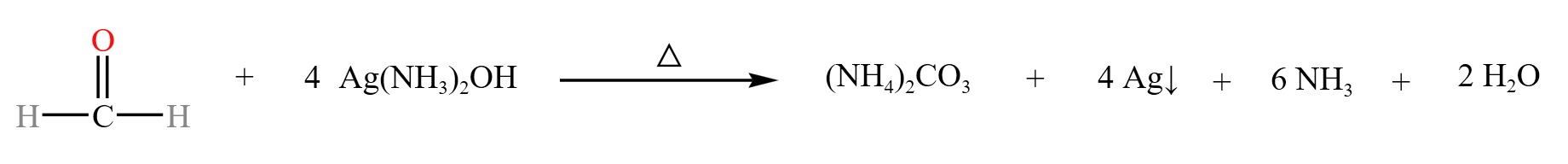
化学方程式分子计量数巧记:\(1,2,3\) 水银氨,醛基变为羧酸铵。

甲醛发生银镜反应,生成无机盐碳酸铵,整个过程中,甲醛升 \(4\) 价,银降 \(1\) 价,如下:
乙二醛发生银镜反应,生成草酸铵,如下:

【与新制 \(\ce{Cu(OH)2}\) 悬浊液反应】
硫酸铜中滴入氢氧化钠,会得到氢氧化铜悬浊液,在生物中叫斐林试剂。
醛和新制 \(\ce{Cu(OH)2}\) 悬浊液反应生成羧酸钠,和氧化亚铜(砖红色沉淀)。反应中,铜降 \(1\) 价,醛升 \(2\) 价。可通过升降化学价,看氧补水配平。如下:

注意:
- 除了醛基外,甲酸、甲酸酯、甲酸盐中都含有醛基结构,所以它们都具有还原性。
- 无论是银镜反应还是与新制氢氧化铜悬浊液反应,检验醛基都必须处于碱性环境下,否则无法检验。
鉴别——用一种试剂鉴别甲酸、乙酸和乙醛:
乙酸是酸,具有酸的特性;乙醛是醛,具有醛基的特性;甲酸
既有氢,又有醛基,同时具有酸和醛的特性。那么可以用新制氢氧化铜悬浊液鉴别它们:
- 对于乙酸而言,会和氢氧化铜发生中和反应,使得氢氧化铜沉淀消失。
- 对于乙醛而言,加热会生成砖红色沉淀 \(\ce{Cu2O}\)。
- 对于甲酸而言,如果不加热则沉淀消失,加热则产生砖红色沉淀 \(\ce{Cu2O}\)。
加成反应
氢气加成(还原反应)
醛除了具有还原性,也具有还原性(属于「中间价态」),还可以发生还原反应,也叫加成反应。
醛被氢气加成得到醇,如下:
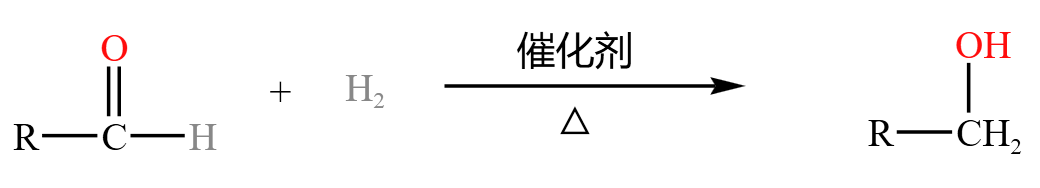
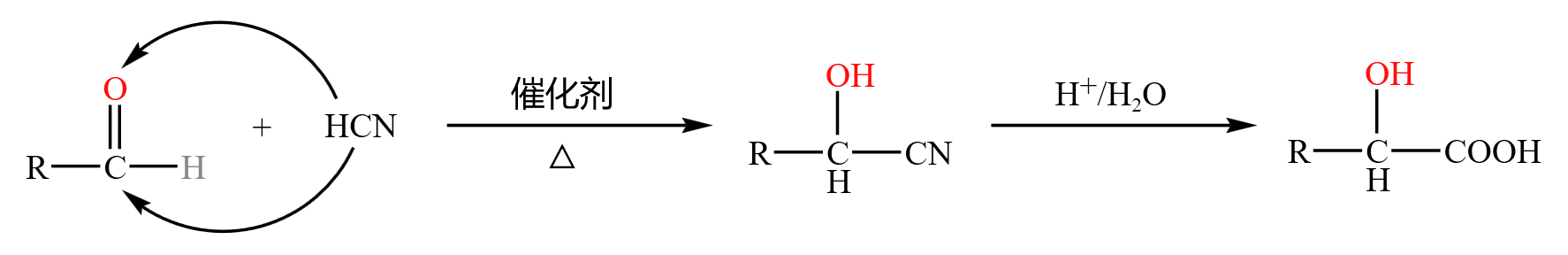
*氢氰酸加成
醛基中碳氧双键的极性较大,由于氧的电负性大于碳的电负性,所以氧带负电,碳带正电;氢氰酸中,氰基带负电,氢带正电。根据异性相吸,醛基中的碳会和氢氰酸中的氰基结合,醛基中的氧会和氢氰酸中的 \(\ce{H+}\) 离子结合,从而发生加成反应。得到的物质通过酸性水解,氰基变羧基,形成 \(\alpha-\) 羟基酸。题目中可能会考到通过处理将该物质的羟基变为氨基,从而得到 \(\alpha-\) 氨基酸。氨基酸和羟基酸能够实现分子内和分子间的脱水缩合,从而形成高聚物和环。
羟醛缩合
后续将会专门讲解,这里不做赘述。
缩聚反应
后续将会专门讲解,这里不做赘述。
总结
除此之外,醛还可以发生歧化反应等,但一般考试会给出信息,根据信息解答即可。
酮的化学性质
酮的化学性质没有醛活泼,相对比较稳定,但仍然有一些羰基的特性。
加成反应
酮中含有羰基,羰基可以被氢气加成,如下:
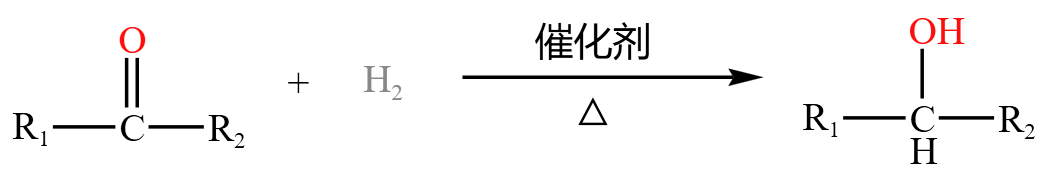
同理醛,酮也可以与氢氰酸发生加成反应,如下:
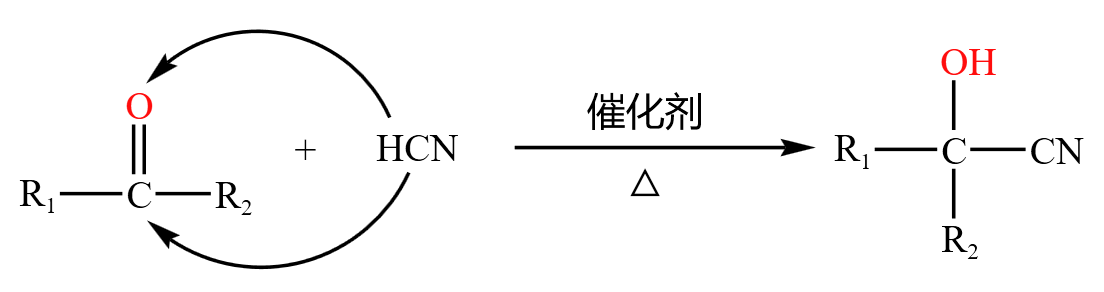
实例:
丙酮
是一种良好的化工材料,它可以和氢氰酸发生加成反应,再水解,得到 \(\alpha-\) 羟基酸
,继续失水会得到很重要的单体——甲基丙烯酸
,甲基丙烯酸发生酯化反应,会得到甲基苯烯酸甲酯,通过加聚反应可得到有机玻璃的主要材料聚甲基丙烯酸甲酯等。丙酮还可以和乙炔 \(\ce{HC#CH}\) 发生类似于氢氰酸的加成反应,得到 除
,通过各种加工处理后会变成合成橡胶。除此之外,丙酮通过羰基的加成,能够增长碳链,实现各种想要的结构。
氧化反应
酮会在氧气中燃烧得到二氧化碳和水。
羧酸、酯和酰胺
前置知识
酰基是 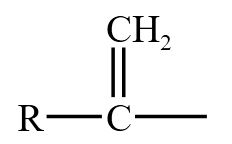 ,乙酰是
,乙酰是 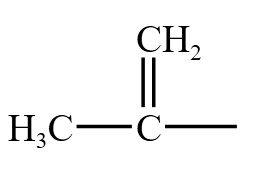 ,乙酰和氨基 \(\ce{-NH2}\) 连接,得到乙酰胺,和 \(\ce{-Cl}\) 连接,得到乙酰氯,和羟基连接,得到羧酸,和 \(\ce{-OR}\) 得到酯,和
,乙酰和氨基 \(\ce{-NH2}\) 连接,得到乙酰胺,和 \(\ce{-Cl}\) 连接,得到乙酰氯,和羟基连接,得到羧酸,和 \(\ce{-OR}\) 得到酯,和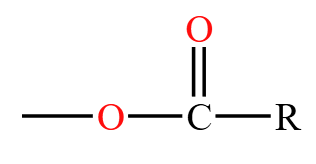 得到酸酐。
得到酸酐。
自然界中的羧酸和酯
酸奶中含有乳酸,是一种比较简单的 \(\alpha\) 羟基酸,可以通过醛和氢氰酸反应合成。
柠檬当中含有柠檬酸,苹果中含有戊酸戊酯,香蕉中含有丁酸丁酯。
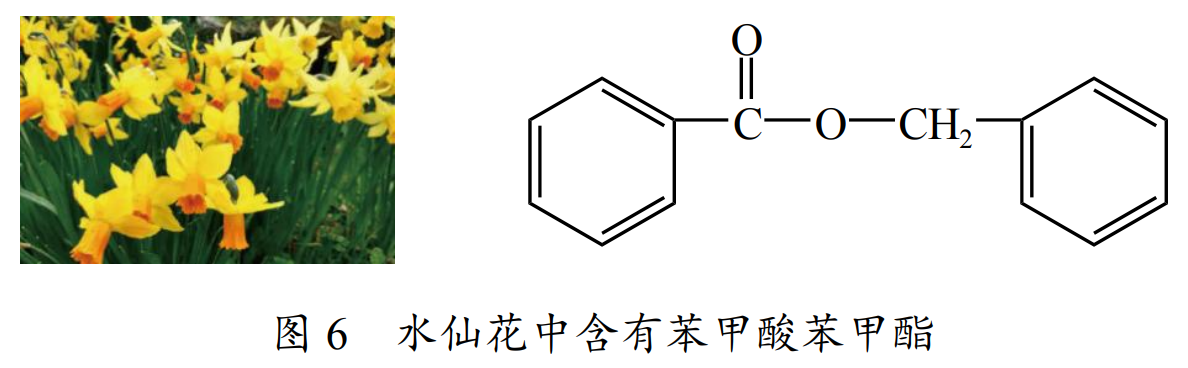
菠萝中含有乙酸异戊酯,水仙花中含有苯甲酸苯甲酯。


物理性质
羧酸
- 低级酸(碳数少的酸)具有强烈的刺激性气味,具有很强的挥发性。
- 碳数 \(\ce C < 4\) 的羧酸可以与水互溶,随分子中碳链(疏水基)的增长,溶解度迅速减小,沸点逐渐升高。
- 纯净的乙酸俗称冰醋酸。
- 甲酸俗称蚁酸,最早在蚂蚁身上提取。是无色、带有刺激性气味的液体。
- 高级脂肪酸是不溶于水的蜡状固体。
- 羧酸与质量相当的其它有机化合物相比,沸点较高。这与羧酸分子间可以形成氢键有关。
酯
- 低级酯具有芳香气味。
- 密度一般比水小。注意:带稠环的不一定,比如萘的密度大于水。
- 微溶于水,难溶于饱和碳酸钠溶液(可以降低酯的溶解度),易溶于有机溶剂。
注:可以通过饱和碳酸钠溶液降低酯的溶解度,但不能使用氢氧化钠,因为氢氧化钠碱性较强可能导致酯的水解。
羧酸的化学性质
弱酸性
羧酸具有弱酸性,可以电离出氢离子,如下:
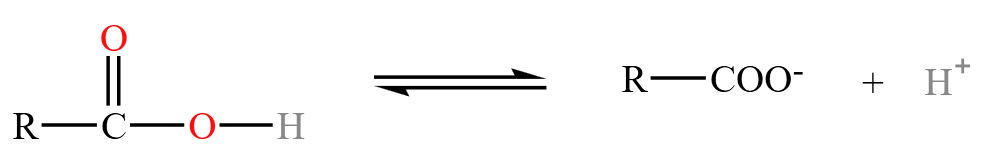
酸性强弱(电离常数 \(K_a\) 依次减小):
那么结合氢的能力(水解常数 \(K_h\) 依次增大):
根据强酸制弱酸可知,上两行的物质中,「左上右下」可以反应。
常见实例:
乙酸可以和钠反应生成羧酸钠,可以与氢氧化钠发生中和反应,也可以与碳酸氢钠反应生成醋酸钠,如下:
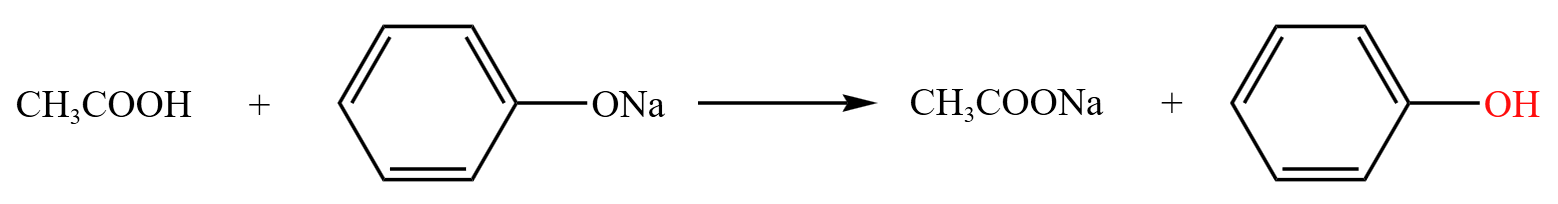
乙酸还可以与苯酚钠反应:
乙酸可以和碳酸钠反应:
酯化反应
酸和醇可以酯化反应生成酯,规则是「酸脱羟基醇脱氢」。反应方程式及相关知识点详见「醇 - 化学性质 - 取代反应 - 酯化反应」。
实验——制备乙酸乙酯
实验装置:
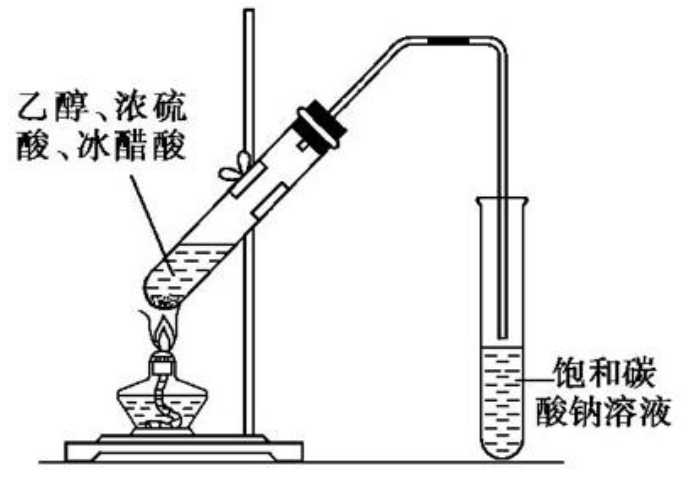
实验原理:使得乙醇和冰醋酸(乙酸)在倾斜试管中加热发生酯化反应,通过试管口进入到含有饱和碳酸氢钠的溶液中除杂。
试剂添加顺序:先加入乙醇,再将浓硫酸加入到乙醇中,并不断搅拌,防止过热酸液四溅,最后把冰醋酸逐滴滴入乙醇和浓硫酸的混合溶液。总结:浓硫酸中间加。
浓硫酸的作用:
- 吸水剂:酯化反应能生成水,生成的水被浓硫酸吸收掉,平衡正向移动,可以提高产率。
- 催化剂:催化反应的进行。
注意:浓硫酸没有脱水剂的作用,浓硫酸换成别的酸也可以使反应进行。
饱和碳酸钠溶液的作用:吸收醇,中和酸,降低酯的溶解度。
注意:右侧进入饱和碳酸钠溶液的试管不能伸入到液面以下。原因:防倒吸。醇和酸都极易溶于水,容易造成管内气压骤减,饱和碳酸氢钠可能会倒吸。
口诀:酯除杂,用苏打,不能伸到液面下。
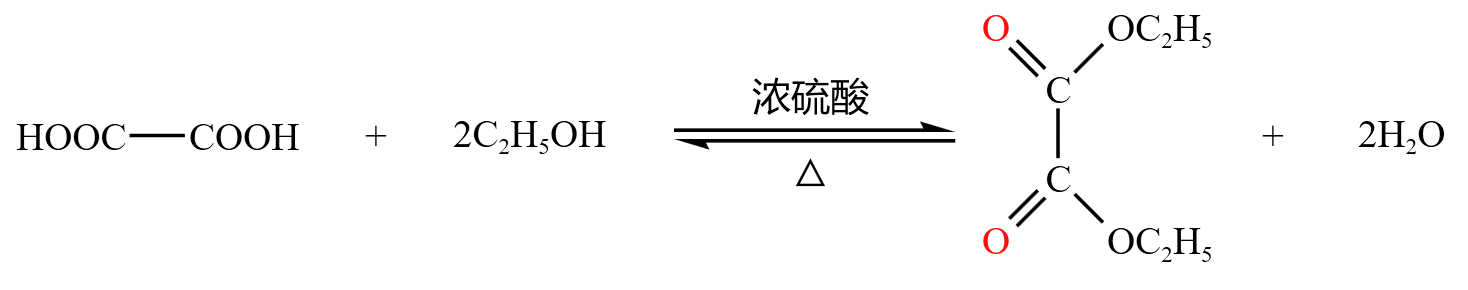
分子间脱水
乙二酸和乙醇酯化生成乙二酸二乙酯,如下:
乙酸和乙二醇酯化生成二乙酸乙二酯,如下:
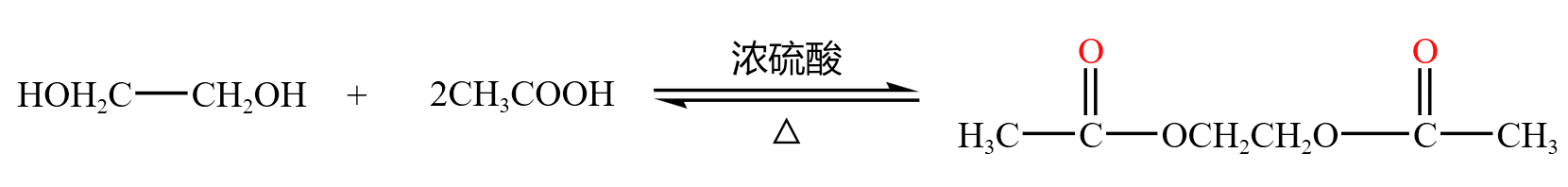
两个羧酸也可以发生类似酯化反应的「成酯反应」,此时是「酸脱羟基酸脱氢」,以 \(\alpha-\) 羟基酸为例:
第一种情况,生成非环状酯类,如下:
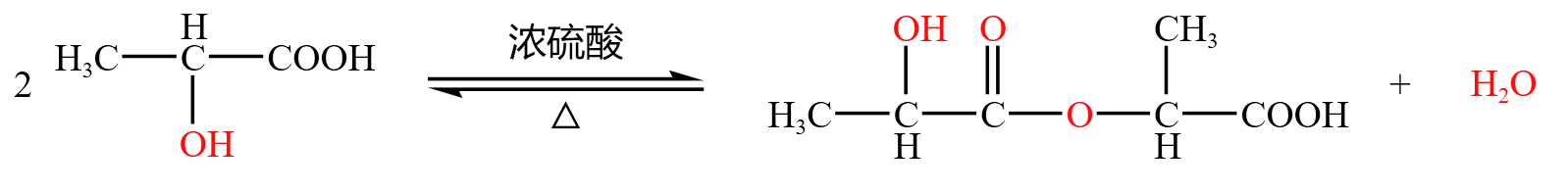
第二种情况,生成「双分子六元环」,如下:
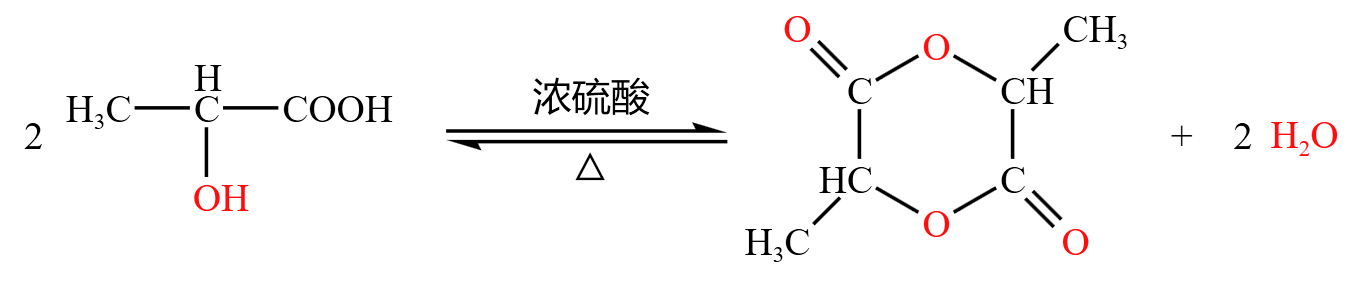
分子内脱水
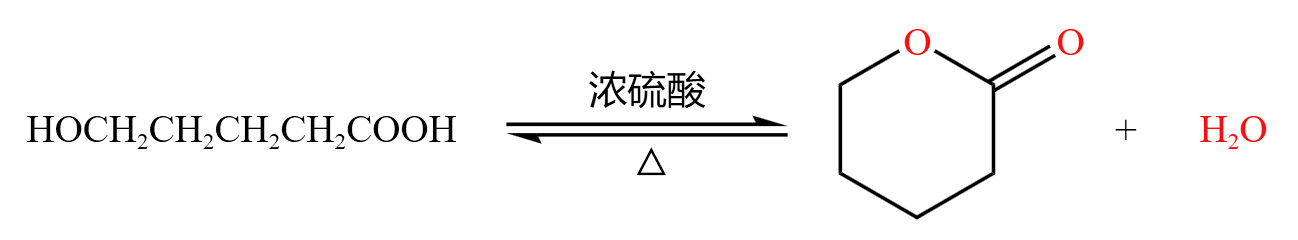
分子内,羧基 \(\ce{-COOH}\) 脱羟基,羟基 \(\ce{-OH}\) 脱氢,一般形成环,如下:
其他取代
羧酸可以与氨气取代反应得到酰胺,如下:
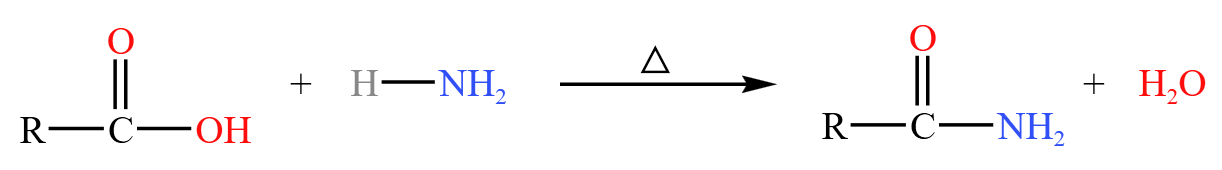
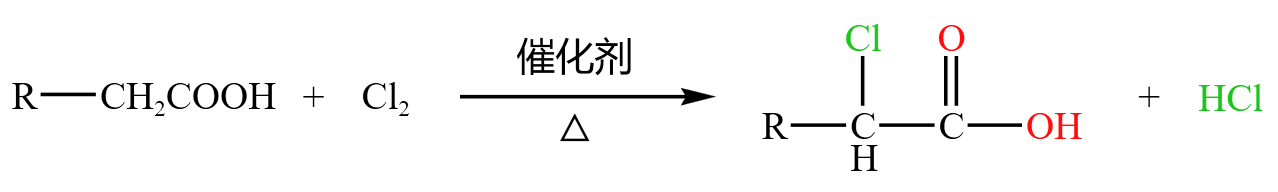
羧酸中的 \(\alpha\) 碳上的氢可能会被卤素取代,被称为「\(\alpha-\) 卤代」,如下:
\(\alpha-\) 卤代后,把得到产物上的 \(\ce{-Cl}\) 水解,就能得到 \(\alpha-\) 羟基酸。
缩聚反应
后续将会专门讲解,这里不做赘述。
酯和酰胺的化学性质
酸性水解
酯的水解相当于酯化反应的可逆反应,生成酸和醇,如下:
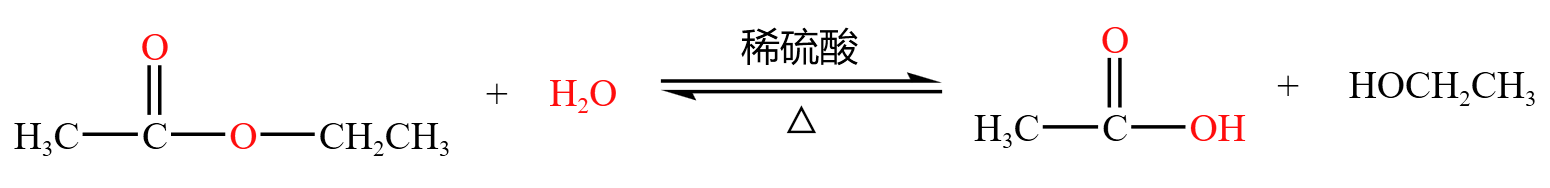
酰胺酸性水解,生成酸和氨气,氨气在酸性条件下变成铵盐,如下:
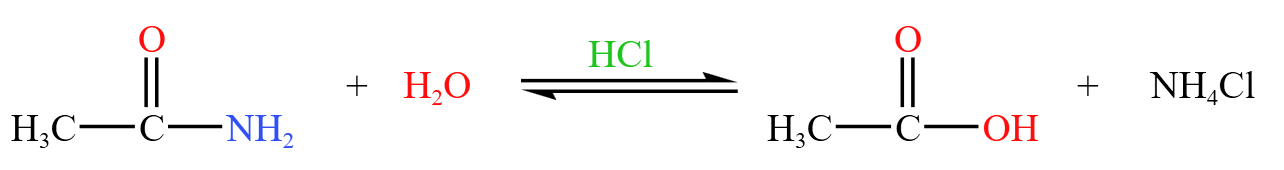
碱性水解
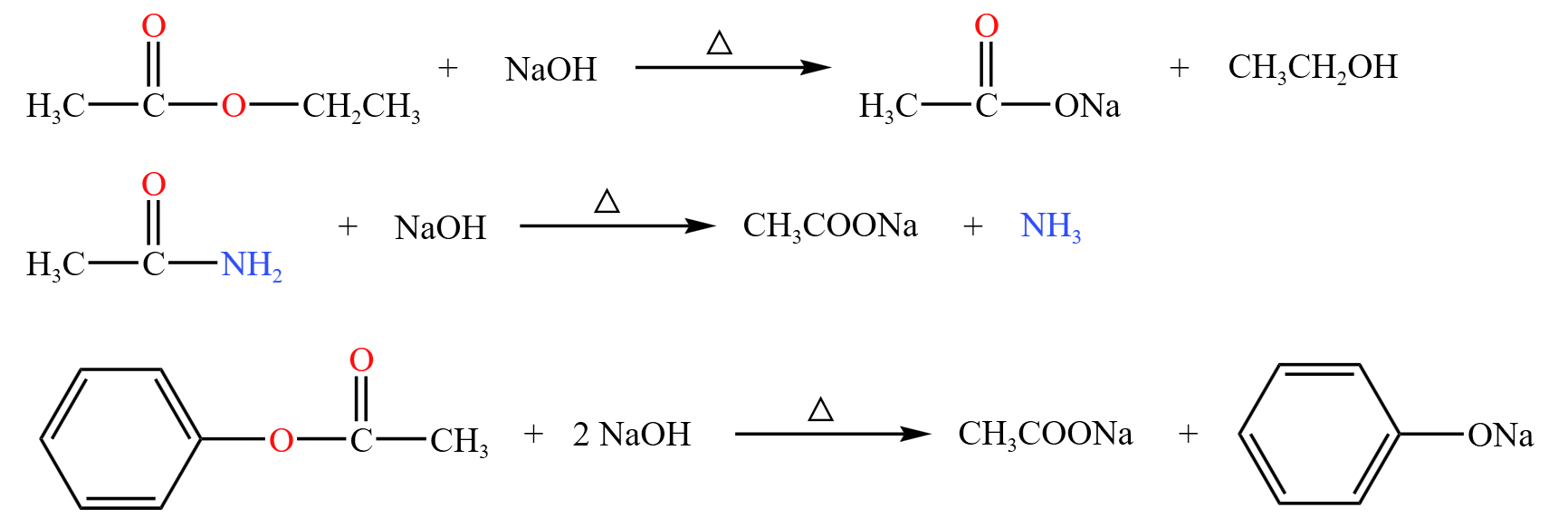
- 第一个方程式中,酯水解生成酸和醇,酸又在碱性条件下发生中和反应,例如酸和氢氧化钠生成羧酸钠。消耗 \(\pu{1 mol}\ \ce{NaOH}\)。
- 第二个方程式中,酰胺水解产生羧酸和氨气,羧酸又在碱性条件下发生中和反应。消耗 \(\pu{1 mol}\ \ce{NaOH}\)。
- 第三个方程式中,酚酯水解产生苯酚和羧酸,二者都会与氢氧化钠反应,分别生成苯酚钠和羧酸钠。消耗 \(\pu{2 mol}\ \ce{NaOH}\)。
对于氢氧化钠的量的消耗,普通酯类是一摩尔,酚酯是二摩尔。
注意:除了酸和苯酚外,还有卤素水解也可以消耗氢氧化钠。
酯交换反应
口诀:酯脱 \(\ce{OR}\) 醇脱氢。
实例:
下面的酯脱去 \(\ce{-O-R2}\),醇脱去 \(\ce{-H}\),发生酯交换反应,如下:

酯交换反应类似于酯化反应。

