【文化课学习笔记】【化学】选必三:烃
【化学】选必三:烃
如果你是从 B 站一化儿笔记区来的,请先阅读我在第一篇有机化学笔记中的「读前须知」(点开头的黑色小三角展开):链接
烷烃
自然界中的烷烃
天然气(主要成分 \(\ce{CH4}\))、液化石油气(主要成分 \(\ce{C3H8}\) 或 \(\ce{C4H10}\))、柴油(\(\ce{C15}\sim \ce{C18}\))、汽油(\(\ce{C5}\sim \ce{C11}\))、凡士林(石油分馏后的产物)、石蜡(\(\ce{C20}\) 以上)、苹果表面的蜡状物(\(\ce{C27}\))、蚂蚁分泌的信息素(\(\ce{C11、C13}\))等的主要成分都是烷烃。
结构
图示
甲烷 \(\ce{CH4}\) 为 \(\ce{sp^3}\) 杂化,正四面体结构。常见烷烃的结构如下图所示。

通式
\(\ce{C_nH_{2n+2}}\),不饱和度为 \(\Omega = 0\)。
共价键数
计算方法:\(\dfrac{4n + m}{2}\),其中 \(n\) 表示碳的个数,\(4\) 是碳能成键的个数,\(m\) 是氢的个数,同时氢能成键的个数为 \(1\)。
例如:甲烷 \(\ce{CH4}\) 的共价键数为 \(\dfrac{4 + 4\times 1}{2} = 4\)。
通式:\(\ce{C_nH_{2n+2}}\) 共价键的个数为 \(\dfrac{4n + 2n + 2}{2} = 3n + 1\)。
物理性质
溶解性
不溶于水,易溶于有机溶剂。
判断有机物是否溶于水的方法:
- 相似相溶原理。
- 判断其是否有与水分子之间的作用,一般情况是看是否能与水分子形成氢键,即判断有机物中的氢原子是否有较高的正电性。例如:\(\ce{NH3}\) 可以与水分子形成氢键,所以氨气溶于水;\(\ce{CH4}\) 中氢的正电性不高,所以无法与水分子形成氢键,所以不溶于水。一般情况只有氮氧氟能让氢显较强的正电性。
密度
- 随着碳数增加,烷烃的密度逐渐增大。
- \(\rho_{烷烃} < \rho_水\)。
状态
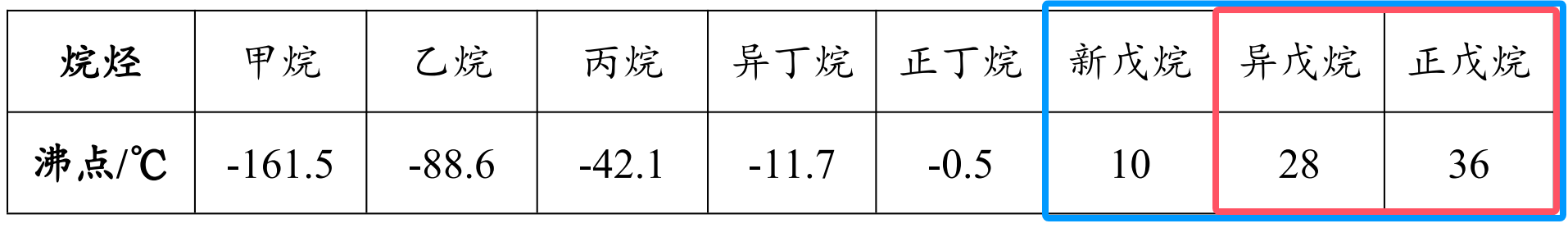
注:
- 图中红框部分常温下是液态,其它为气态。
- 标况(\(\pu{0^\circ C}\))下,蓝框为液态,其它为气态。
规律:
- 碳原子数 \(\le 4\),常温下为气态。
- 碳原子数 \(>4\),新戊烷常温下为气态,其它为液态。
注意:
- 做题时需要注意题目的前提条件是标况下还是常温下,标况新戊烷为液态,而常温下为气态,可以直接记住新戊烷的沸点为 \(\pu{10 ^\circ C}\)。
- 题目中所说的「通常情况下」,一般指的是常温下。
熔沸点
规律:
- 随着碳数增加,溶、沸点逐渐增加。原因:烃类物质的熔沸点主要看相对分子质量 \(M\),\(M\) 越大,分子间作用力越强,溶沸点就越高。
- 碳数相同时,支链越多,溶、沸点越低。原因:支链越多,说明分子间距越大,所以分子间作用力越弱,熔沸点就越低。
步骤:
- 先分组,将需要比较熔沸点的烷烃根据碳数不同分组。
- 再看支链,同碳数烷烃,支链越多熔沸点越低。
例:下列五种有机物:① 正丁烷;② \(2-\) 溴己烷;③ \(2,2-\) 二甲基丙烷;④ 异丁烷;⑤ 己烷。沸点由低到高的顺序是什么?
分析:
先分组,根据碳数由少到多为:②⑤(6 个)\(>\) ③(5 个)\(>\) ①④(4 个)。
然后再同碳数烷烃:
- ② 和 ⑤,\(2-\) 溴己烷支链更多,所以碳数更少。
- ① 和 ④,正丁烷支链较少,所以碳数更多。
那么沸点由低到高的顺序是 ④①③⑤②。
注意:③ 虽然命名为丙烷,但它并不是只有三个碳,而是五个碳,实际上是新戊烷。所以不能只看命名的母体判断碳数。
【拓展】伯仲叔季——有关有机物命名的新规则
一般情况下,对于烷烃而言,我们把烷烃中连有 \(1\) 个碳的碳原子称为「伯碳」,其上的氢原子称为「伯氢」;同理,连有 \(2\) 个、\(3\) 个和 \(4\) 个碳的碳原子称为「仲碳」「叔碳」「季碳」,其上的氢原子称为「仲氢」「叔氢」,「季氢」上没有氢,所以不存在「季氢」。
如下图所示,① 号碳原子为「伯碳」,其上的氢原子为「伯氢」;② 号碳原子为「仲碳」,其上的氢原子为「仲氢」;③ 号碳原子为「叔碳」,其上的氢原子为「叔氢」。
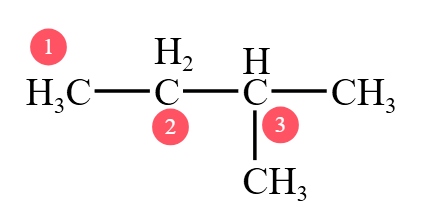
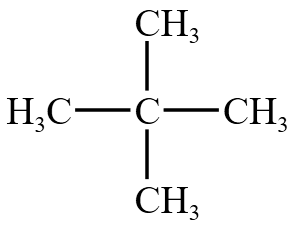
下图的新戊烷,中间的碳原子为「季碳」。
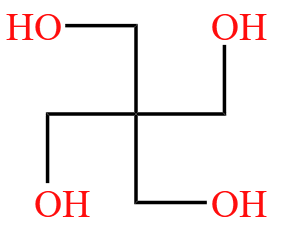
伯仲叔季的规则对有机物命名帮助很大。例如下图的有机物,中间的碳原子为「季碳」,可以命名为「季戊四醇」。
化学性质
取代反应
下面以甲烷与氯气反应为例。
【反应原理】
甲烷上的氢不断被氯取代,得到 \(N\) 氯甲烷,如下:
根据反应原理可知,甲烷被氯取代至少有 5 种产物:一氯甲烷 ~ 四氯甲烷、氯化氢。
【实验装置】
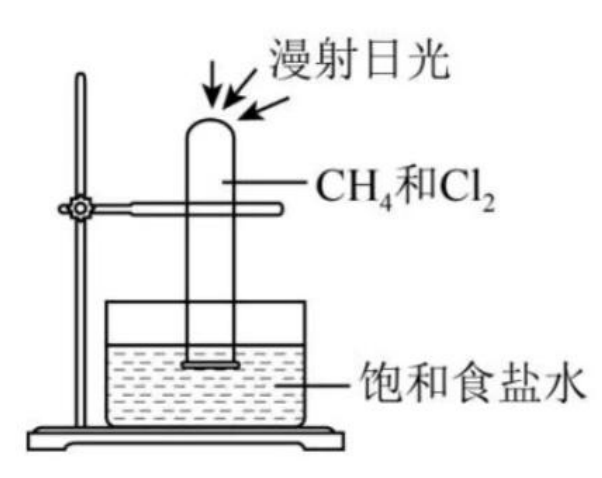
【实验现象】
黄绿色变浅(氯气被消耗),试管中有少量白雾(白雾是 \(\ce{HCl}\) 酸雾),液面上升(除一氯甲烷外其它 \(N\) 氯甲烷都是液态),试管壁有油状液滴。
注意:四种氯甲烷中,只有一氯甲烷是气体,二三四氯甲烷都是油状液体,即生成物为油状混合物。
【其它取代反应】
类比甲烷,乙烷与氯气在光照条件下反应,可能会得到产物 \(\ce{CH3CH2Cl} \sim \ce{CCl3CCl3}\),化学方程式也可类比甲烷写出,这里不做赘述。
烷烃与溴反应,反应条件相对与氯气反应更加苛刻,必须在加热 \(\pu{500^\circ C}\) 时才能发生取代反应。这是由于溴的化学性质没有氯气活泼(在无机化学中学过)。
注意:
- 气态烷烃不能使得溴水褪色,气态烷烃直接通入到溴水中时,不会发生取代反应(没有溴蒸气且没有加热到 \(\pu{500^\circ C}\)),所以不能使得溴水褪色。
- 液态烷烃可以使得溴水褪色,相当于烷烃能将溴水中的溴萃取出来,是物理变化。此时,若己烷和溴水在容器中,己烷在上层(密度比水小),现象是下层中溴水褪色(溴从下层转移到上层)。
拓:
丙烯 \(\ce{CH3-CH=CH2}\) 与溴反应,只有烷基上的氢会被取代,不饱和键周围的氢非常难取代,即不饱和难取代,通常情况下丙烯与溴发生的取代反应反应方程式如下:
\[\ce{CH3-CH=CH2 + Br2(g) ->[\pu{500^\circ C}] CH2Br-CH=CH2 + HBr} \]注意:苯环与氯气不反应,因为苯环上所有的氢连接的碳都是不饱和的,不饱和难取代,所以不反应。
氧化反应
根据元素守恒可知,烷烃在氧气中燃烧,发生氧化反应的通式为:
注意:烷烃不能使酸性高锰酸钾溶液褪色,也不能跟强酸强碱反应。原因:烷烃比较稳定,不能被高锰酸钾氧化,也不能与强酸强碱反应。
在烷烃中,甲烷中碳的质量分数最低。原因:根据烷烃的通式 \(\ce{C_nH_{2n+2}}\) 可知,烷烃中碳的质量分数为 \(\dfrac{12n}{14n + 2}\),随着 \(n\) 的增大而增大,所以当 $n=1 $ 时,碳的质量分数最低。
例题
例:烷烃与氯气的取代反应属于常见的自由基反应,其中甲烷反应的部分历程如下:
① 引发:\(\ce{Cl2 -> Cl* + Cl*}\) 等。
② 链反应:\(\ce{Cl* + CH4 -> CH3* + HCl}\)、\(\ce{CH3* + Cl2 -> Cl* + CH3Cl}\) 等。
③ 终止:\(\ce{Cl* + Cl* -> Cl2}\)、\(\ce{Cl* + CH3* -> CH3Cl}\) 等。
以下说法错误的是()
A. 引发时可以通过热辐射、光照等条件
B. 链反应可以反复进行
C. 反应产物只有四种
D. 产物中可能有 \(\ce{CH3CH3}\)
分析:
A 选项,根据取代反应的条件是加热或光照等可知,A 正确。
B 选项,根据 ② 可知链反应可以反复进行,B 正确。
C 选项,取代反应的产物至少为 5 种,即一氯甲烷 ~ 四氯甲烷以及 \(\ce{HCl}\),C 错误。
D 选项,在链反应中得到 \(\ce{CH3*}\) 和 \(\ce{CH3*}\) 反应有可能得到 \(\ce{CH3CH3}\),D 正确。
烯烃和炔烃
生活中的烯烃
- 如上图,番茄中的番茄红素、鲨鱼油中的角鲨烯都是烯烃。
- 乙烯在生活和工业中有各种各样的用途(例如催熟剂),其产量是一个国家石油化工发展水平的重要标志。
通式
单烯烃:\(\ce{C_nH_{2n}}\),其中 \(n \ge 2\)。不饱和度为 \(\Omega = 1\)。最简单的单烯烃为乙烯 \(\ce{C2H4}\)。
单炔烃:\(\ce{C_nH_{2n-2}}\),其中 \(n \ge 2\)。不饱和度为 \(\Omega = 2\)。最简单的单炔烃为乙炔 \(\ce{C2H2}\)。
双烯烃:\(\ce{C_nH_{2n-2}}\),其中 \(n \ge 4\),一般情况下不能存在 \(\ce{C=C=C}\) 这样的两个双键同时连在一个碳上的烃,即累积双烯烃,因为此结构极其不稳定。不饱和度为 \(\Omega = 2\)。最简单的双烯烃结构为 \(1,3-\) 丁二烯 \(\ce{C=C-C=C}\)。
物理性质
熔沸点
烯烃、炔烃的熔沸点一般随分子中 \(\ce C\) 原子数的增加而增加。原因:碳原子数越大,相对分子质量 \(M\) 越大,所以分子间作用力越大,所以熔沸点越大。
以烯烃为例:
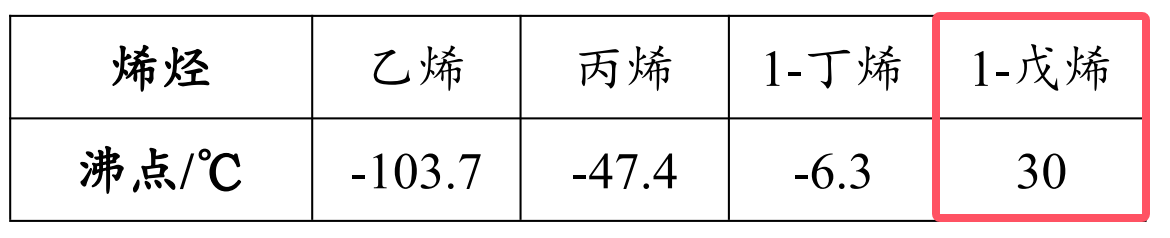
注:红框部分在常温下为液态,其余为气态。
规律(与烷烃类似):
- 碳原子数 \(\le 4\),常温下为气态。
- 碳原子数 \(>4\),常温下为液态。
溶解性
烯烃和炔烃都不溶于水,易溶于有机溶剂。(与烷烃相同)
烷、烯、炔烃合起来叫脂肪烃,所以脂肪烃不溶于水。
密度
密度比水小。(与烷烃相同)
化学性质
加成反应
本质:断开烯烃上的 \(\pi\) 键,形成新的 \(\sigma\) 键与其它原子相连。加成反应发生前,碳原子为 \(\ce{sp^2}\) 杂化;反应结束后,碳原子变为 \(\ce{sp^3}\) 杂化。
单烯烃加成
高中阶段涉及的单烯烃加成,主要有氢气 \(\ce{H2}\)、卤素 \(\ce{X2}\)、氢卤 \(\ce{HX}\) 和水 \(\ce{H2O}\),如下:
说明:
- 第二个方程式中的生成物命名为 \(1,2-\) 二溴乙烷,生成物是液体,这里反应物是溴水或者溴的四氯化碳均可。
- 第四个方程式中,在题目没有说明的情况下,一般情况下遵循「马氏规则」,生成第一种生成物 \(\ce{CH3-CHBr-CH3}\),即本来有氢的碳继续加氢(氢上加氢)。其它情况需要看题目给的信息,例如给定特殊的催化剂,有时候可能会生成 \(\ce{CH3-CH2-CH2Br}\),即「反马氏规则」。
- 第五个方程式的产物为乙醇。通过该方程式可以看出,乙烯可以作为水化的化工原料,通过催化剂加热加压,可以生成乙醇。这是工业制乙醇的方程式,即「乙烯水化法」。
- 第六个方程式和第四个情况相同,本质区别是官能团 \(\ce{-OH}\) 或 \(\ce{-Br}\) 接在里面还是外面,一般一律观察题目信息即可。
双烯烃加成
一般题目中涉及到的双烯烃都是共轭二烯烃,一般共轭二烯烃指的是「双单双」,即 \(\ce{CH2=CH-CH=CH2}\),即结构先是双键,再是单键,最后再是双键。
常见反应如下:
我们考虑将共轭二烯烃的四个碳从左到右编号,则第一个方程式相当于在 \(1\) 号和 \(2\) 号碳上接溴,即「\(1,2\) 加成」;同理第二个方程式为「\(1,4\) 加成 \(2,3\) 双键」,即溴接在 \(1\) 号和 \(4\) 号碳上,\(2,3\) 号碳上断开的键与对方连起来,构成双键。第三个方程式是当 \(\ce{Br2}\) 过量时,那么对于每个碳都可以被溴加成。
第二个反应是双烯烃考察最多的特性,也是反应出现最多的情况。且只有「双单双」的共轭二烯烃才会有这种现象,因为当碳原子更多时,中间断开的键不一定能连成双键。
拓展——单烯烃与双烯烃的加成反应(DA 反应):
乙烯 \(\ce{C2H4}\) 和共轭二烯烃 \(\ce{CH2=CH-CH=CH2}\) 的反应方程式如下:
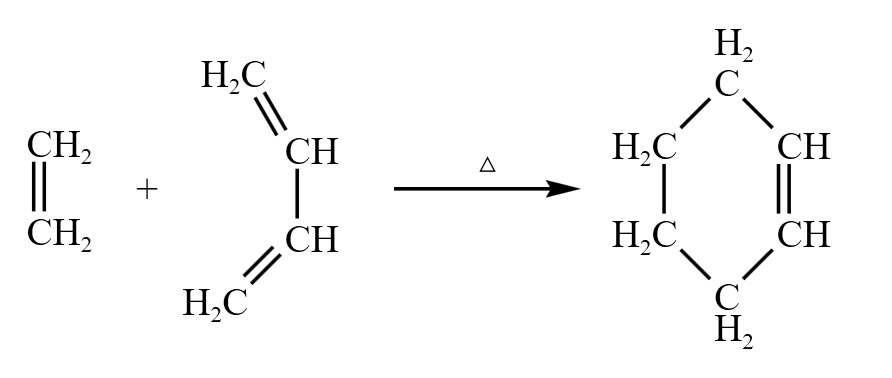
用键线式书写如下:
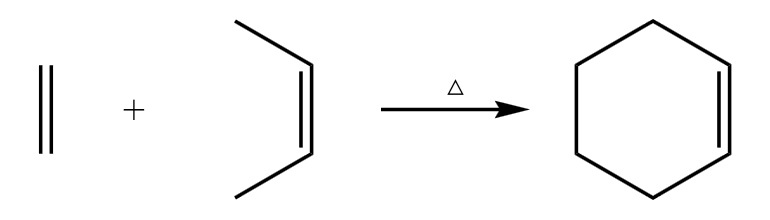
它分别利用了单烯烃的加成和双烯烃的「\(1,4\) 加成」,也叫 DA 反应。
炔烃加成
常见反应:
- 第一个反应加入一份 \(\ce{H2}\) 得到乙烯 \(\ce{CH2=CH2}\),假如两份 \(\ce{H2}\) 得到 \(\ce{CH3CH3}\)。具体到底加了几分生成什么,要看题目信息。
- 第二个反应一般加溴都加两份生成 \(1,1,2,2-\) 四溴乙烷。
- 第三个反应加一份 \(\ce{HCl}\) 生成氯乙烯 \(\ce{CH2=CHCl}\),再加一份 \(\ce{HCl}\) 情况与单烯烃加成的第四个方程式相同。即看题目信息,若题目没有信息则按照「马氏原则」,优先考虑氢上加氢,得到 \(\ce{CH3-CHCl2}\)。加入一份 \(\ce{HCl}\) 后,也可以采用某种方式将氯乙烯变成高氯物聚氯乙烯 PVC
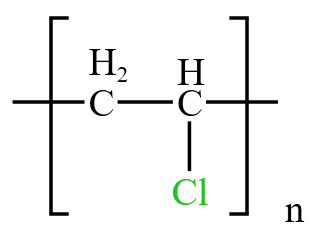 。
。 - 第四个反应中,第一次得到的产物乙烯醇一边连羟基 \(\ce{-OH}\),一边连双键,与两边都连双键的烯烃一样,都不稳定,所以羟基上的氢会转移到第一个碳原子上,同时 \(1,2\) 碳之间的双键转移到 \(2,3\) 碳之间,形成乙醛。这个过程叫「稀醇式重排」。第四个反应在工业中时乙炔水化法制备乙醛。
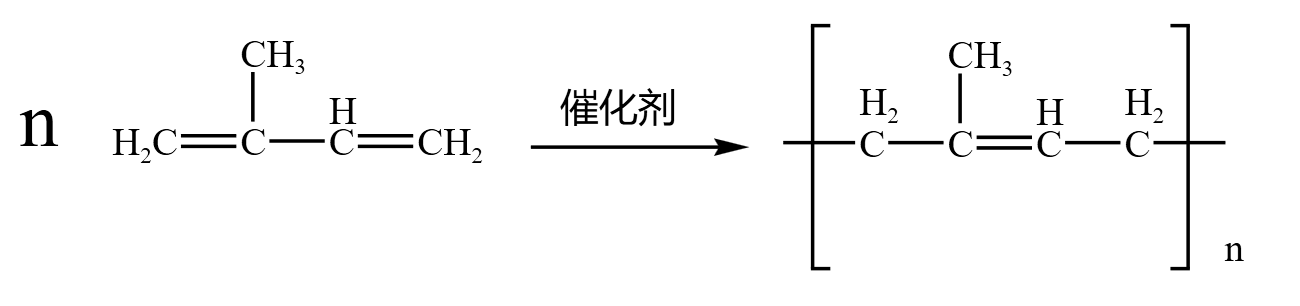
加聚反应
烯烃加聚
丙烯 \(\ce{CH3-CH=CH2}\) 中的双键断裂,形成的单键分别向两边延伸,得到聚丙烯,如下:
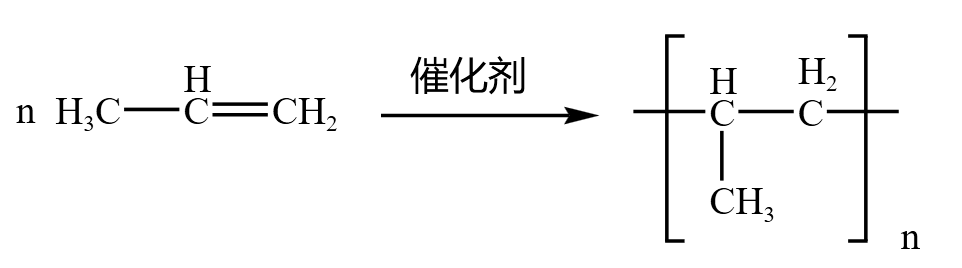
乙烯 \(\ce{CH2=CH2}\) 和丙烯 \(\ce{CH3-CH=CH2}\) 会发生「共聚」,是一种特殊的加聚反应,反应方程式如下:
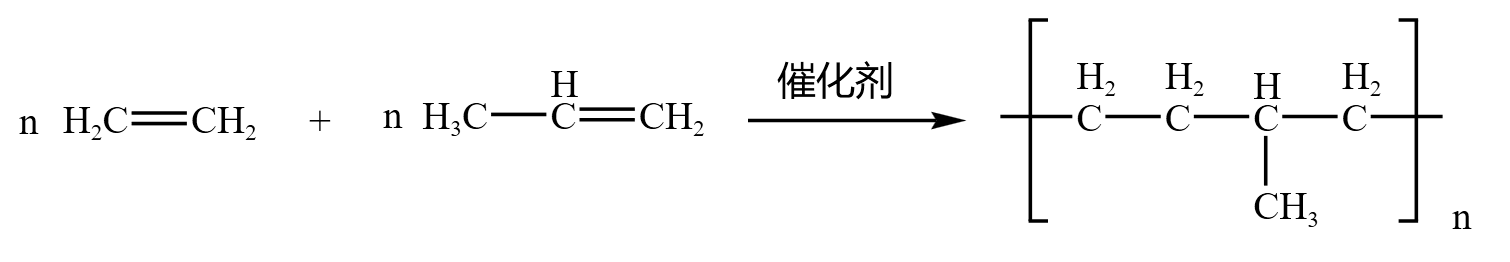
共轭二烯烃加聚反应遵循「\(1,4\) 加成 \(2,3\) 双键」,得到的产物具有顺反异构,「反式」是合成橡胶的主要成分,「顺式」是天然橡胶的主要成分。
生成物由于含有双键,所以会和常见的氧化剂(浓硝酸和高锰酸钾等)反应,所以装入高锰酸钾不能用橡胶塞。
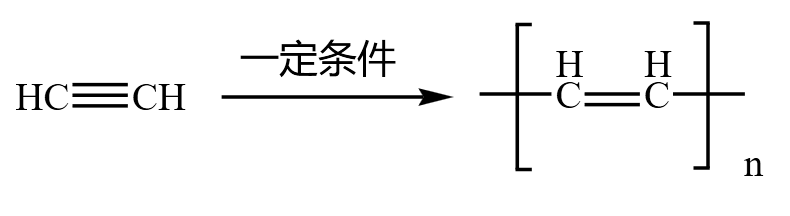
炔烃加聚
乙炔加聚会得到聚乙炔,聚乙炔展开后会得到「双单双」的类似共轭二烯烃的结构,所以相邻的两个碳都可以「肩并肩」形成双键。和苯的结构也有相似之处:苯是在一个环上六个碳肩并肩形成大 \(\pi\) 键,而聚乙炔是在一条链上相邻两个碳肩并肩。由于聚乙炔「单双单」的特殊结构,它是导电聚合物/导电塑料的主要成分。
注意:聚乙炔和苯的结构虽然较为相似,但苯是环状结构,且形成的并不是单双键交替排布的结构,而是大 \(\pi\) 键结构;而聚乙炔是「单双单」交替结构,所以它能够使得酸性高锰酸钾溶液褪色。同理,苯并不能跟溴水反应使得溴水褪色(只能通过萃取使得溴水褪色),但聚乙炔可以(
我觉得理论上可以朋友还讨论过,不过它是固体讨论能不能跟溴水反应可能存在不确定的因素,暂时按照可以反应来处理吧)。碎碎念:但是后来又听朋友说他们老师说 \(1,3-\) 丁二烯也含有大 \(\pi\) 键但是它就能跟高锰酸钾和溴水反应,可能就是苯比较特殊吧这个跟大 \(\pi\) 键也有可能关系不大,有可能是苯的六元环状结构使得它特别稳定(雾),反正在「高中阶段」不能跟高锰酸钾和溴水反应。反正这个东西高中不考就对了(不是)。
氧化反应
燃烧
乙烯燃烧:
现象:火焰明亮并伴有少量黑烟,放出大量热。
乙炔燃烧:
现象:火焰发黄并伴有浓烈黑烟,放出大量热。
注意:由于乙炔含碳量更大,燃烧会产生大量的碳粒,所以会伴有浓烈黑烟,而乙烯燃烧只伴有少量黑烟。这是区分乙炔和乙烯的办法。
应用:氧炔焰是氧气与乙炔燃烧的火焰,温度可达 \(\pu{3000^\circ C}\) 以上,常用作气焊、气割等。
与酸性高锰酸钾溶液反应
烯烃、炔烃可使酸性高锰酸钾溶液褪色。
注意:这里需要与烷烃区分,烷烃不能使高锰酸钾褪色。
鉴别与除杂
乙烷 \(\ce{CH3CH3}\) 和乙烯 \(\ce{CH2=CH2}\) 的鉴别方法:
- 通过溴水鉴别:乙烷不发生加成反应,乙烯发生加成反应。
- 通过溴的四氯化碳鉴别:溴的四氯化碳中溴含量更高,理由同上。
- 通过酸性高锰酸钾鉴别:乙烷不能使酸性高锰酸钾褪色,而乙烯可以。
- 通过燃烧鉴别:乙烷燃烧没有黑烟,乙烯燃烧伴有黑烟。
除去乙烷 \(\ce{CH3CH3}\) 中混有的少量 \(\ce{CH2=CH2}\):
加入溴水:乙烯会与溴发生加成反应,得到 \(1,2-\) 二溴乙烷,是液体,会溶解在溶液中,而乙烷不反应且不溶于水。
注意:
- 不能用溴的四氯化碳除杂,因为乙烷溶于有机溶剂,溶于溴的四氯化碳,加入溴的四氯化碳会造成乙烷的损失。
- 不能用酸性高猛酸钾除杂,因为高锰酸钾会将乙烯变成 \(\ce{CO2}\),是气态,乙烷也是气态,所以达不到除杂的效果。
- 不能燃烧除杂,因为二者均会在氧气中燃烧,二者都会被消耗。
苯及其同系物
结构
苯是平面六边形结构,苯环中的碳是 \(\ce{sp^2}\) 杂化,苯环中十二个原子共面。每个碳都有一个 \(\ce p\) 轨道垂直于苯所在平面,「肩并肩」重叠形成大 \(\pi\) 键。
苯环中有 \(6\) 条碳碳单键,\(0\) 条碳碳双键,苯分子中的碳碳键是一种介于碳碳单键和双键之间的一种特殊的共价键,叫做大 \(\pi\) 键。
苯的同系物是与苯结构相似且组成相差若干个 \(\ce{CH2}\) 的有机物。
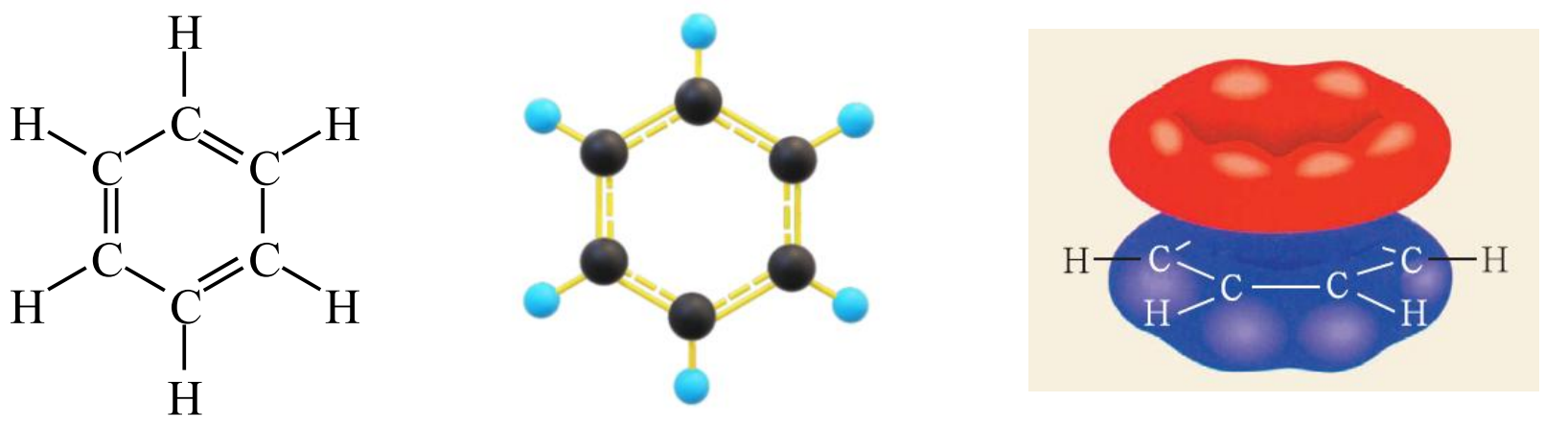
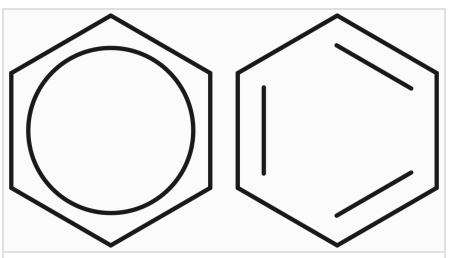
苯环一般有两种写法——凯库勒式和路易斯式,凯库勒式是用键线来描述苯的结构,路易斯式是用大 \(\pi\) 键来描述苯的结构。
如下图,左边是路易斯式,右边是凯库勒式。
物理性质
苯是一种无色、有特殊气味、有毒的液体,易挥发,密度比水小,不溶于水,是良好的有机溶剂。
由于苯不溶于水而且是良好的有机溶剂,所以经常做萃取剂。
【实验一】
如下图所示,将苯滴入溴水中,溶液分层,上层是苯,下层是水。溴在苯中的溶解性更大,所以溴进入苯中。
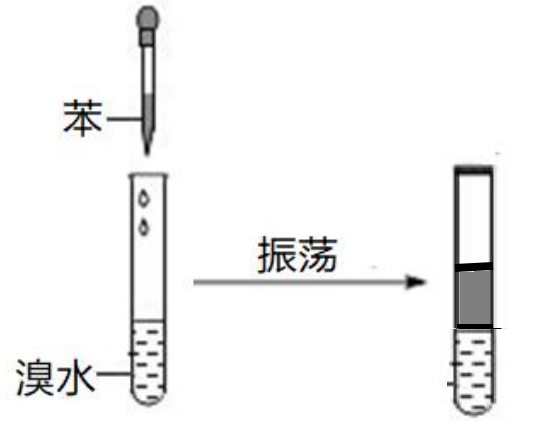
实验现象:溶液分层,上层为红棕色(橙红色)(一般来说溴的量较大时为红棕色反之是橙红色)。
【实验二】
如下图所示,将苯滴入溴的四氯化碳溶液中,由于苯和四氯化碳互溶,且二者溶解溴的能力差不多,所以会形成苯、溴和四氯化碳混合的溶液。
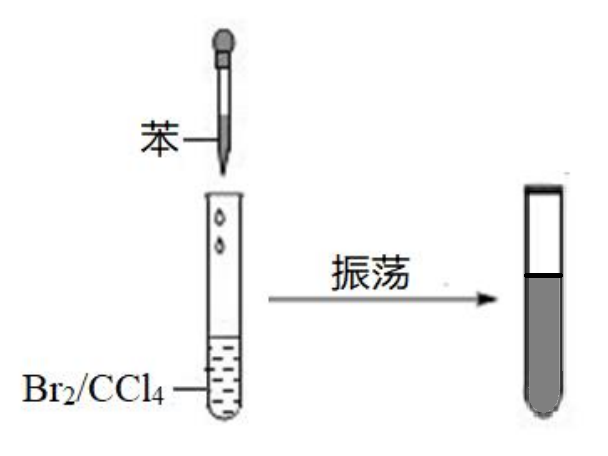
注:苯的同系物也具有和苯相同的物理性质。
注意:苯及苯的同系物密度都小于水,且烷烃、烯烃和炔烃的密度都小于水。但不能因此得到「烃(碳氢化合物)的密度都小于水」的结论,因为稠环类物质萘
的密度是 \(\pu{1.16 g/cm^3}\),密度大于水。一般稠环类物质由于碳的质量分数较大,所以密度很可能比水大。
所以,烷烃、烯烃、炔烃、苯及其同系物的密度都小于水,但芳香烃(尤其是稠环类有机物)的密度不一定小于水。
化学性质
氧化反应
燃烧
现象:产生浓烈的黑烟。
注意:\(\ce{C6H6}\) 燃烧和乙炔 \(\ce{C2H2}\) 含碳量相同,都比较大,所以二者燃烧均不充分,有碳的颗粒,所以有浓烈黑烟。
被酸性高锰酸钾溶液氧化
苯由于很稳定,所以不能被高锰酸钾氧化。高锰酸钾溶液中加入苯,溶液会分层,苯在上层,水在下层高猛酸钾,溶在水中(高锰酸钾是离子型化合物,易溶于水)。
甲苯会使得酸性高锰酸钾褪色,与酸性高锰酸钾反应生成苯甲酸,方程式如下:
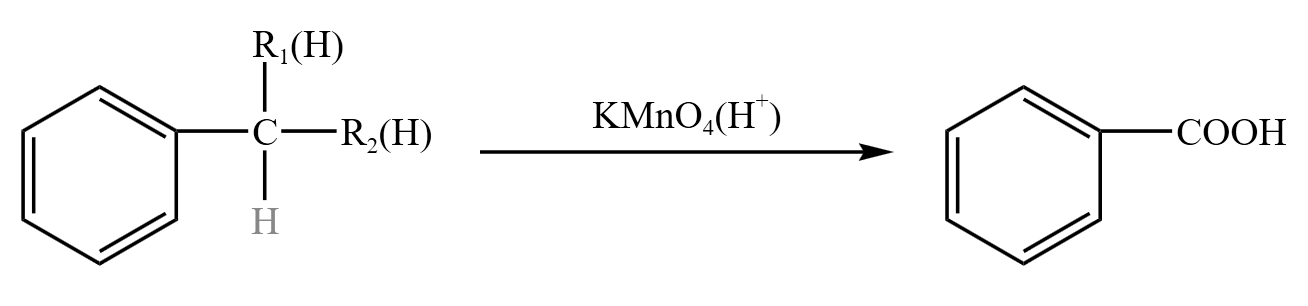
甲苯中甲基上的其中两个 \(\ce{H}\) 可以变为 \(\ce R\),只要甲苯中直接与苯环相连的碳(我们称为 \(\alpha\) 碳)上接有 \(\ce H\),不管数量多少,与酸性高锰酸钾溶液反应都能生成苯甲酸。乙苯丙苯等同理。
乙苯与高锰酸钾反应如下:
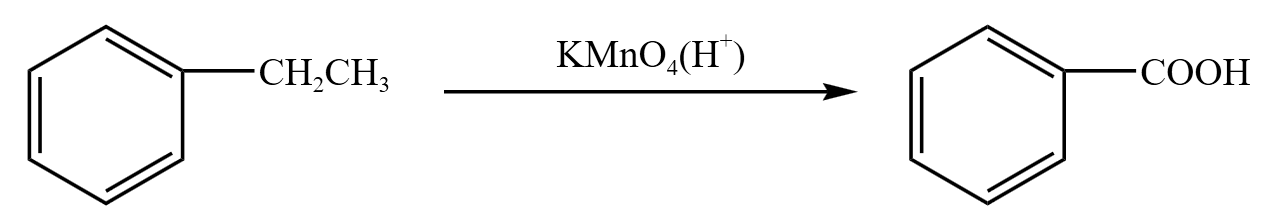
注意:下图的叔丁基苯中的 \(\alpha\) 碳不连 \(\ce{H}\),所以不与高锰酸钾反应。
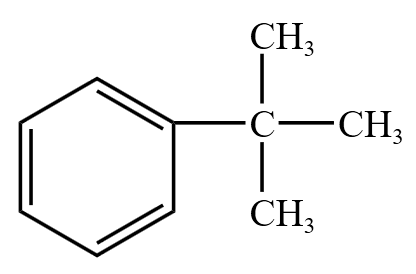
苯不能与高锰酸钾溶液反应,甲苯可以与高锰酸钾溶液反应,由于反应使得甲基变为羧基,所以这体现了苯环对甲基 \(\ce{-CH3}\) 的影响。
鉴别:可以通过酸性高锰酸钾溶液来鉴别苯和甲苯。
取代反应
苯主要由卤素、硝酸、硫酸取代。
卤代反应
特点:苯及其同系物被卤素取代。
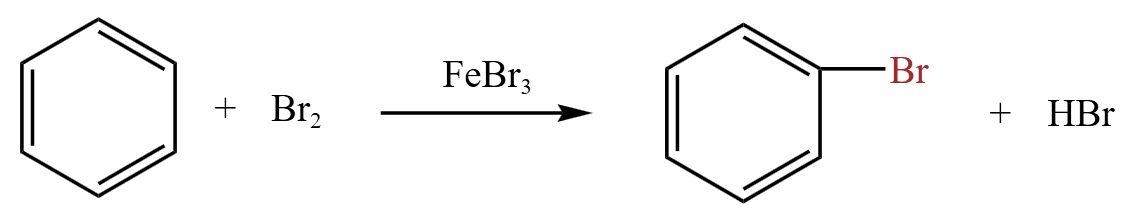
【三价铁催化】
苯环很稳定,一般情况下不容易被取代(甲苯同理),对于溴而言,必须保证是纯的液溴,同时需要加催化剂三价铁,作用是活化苯环,让苯的电子云松动,才能被取代。
现象:有红褐色液体产生;生成白雾。解释:溴苯是无色液体,密度比水大,由于液溴量较大,所以液溴会溶解进溴苯中,从而使得溴苯呈现红褐色。同时溴化氢是白雾。
所以苯可以使得溴水褪色,但是通过萃取这种物理变化的方式,不能通过通过化学使得溴水褪色。
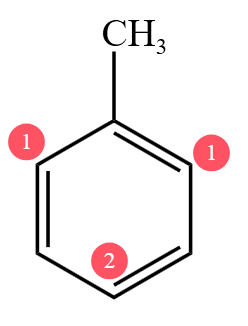
由于三价铁的作用是活化苯环,所以甲苯与溴反应一定不会取代甲基上的氢,一定取代的是苯上的氢。经过研究可知,一般情况取代的是「邻位」或「对位」上的苯,即下图 ① ② 号苯。
如果溴的量较大,则可能「邻位」和「对位」上两个位置甚至三个位置都被取代,方程式如下:
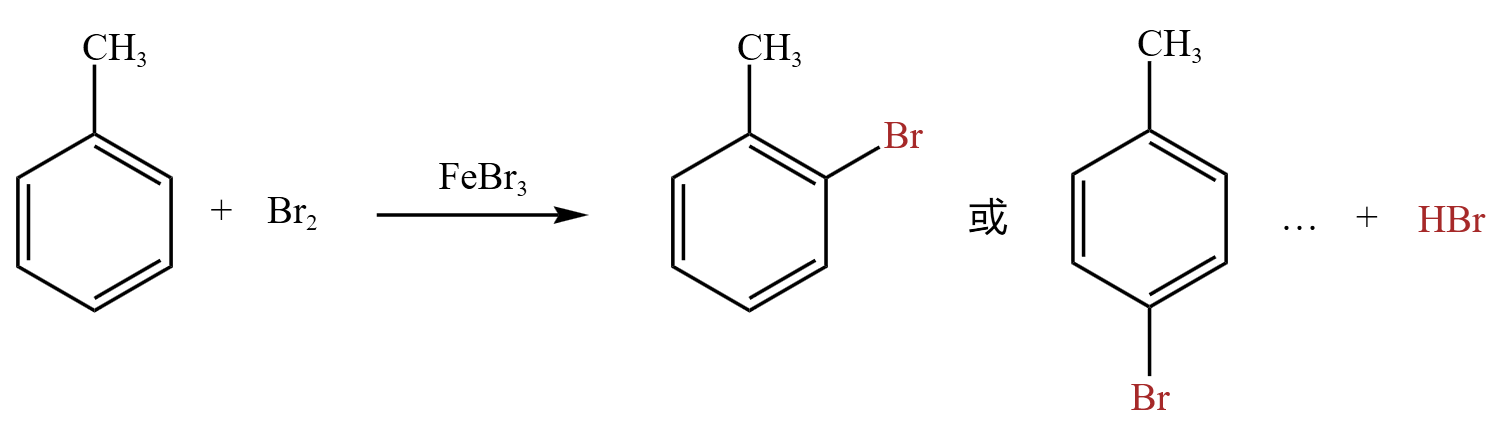
由于甲苯取代反应是苯环中的氢被取代,所以体现了甲基 \(\ce{-CH3}\) 对苯环的影响。这里的甲基是邻对位定位基。
注:除了甲基之外,以后会学到羟基 \(\ce{-OH}\) 也是邻对位定位基,苯酚完全取代后得到的产物是三溴苯酚,其中两个溴的位置是两个「邻位」,一个「对位」。
注意:甲苯可以使得酸性高锰酸钾溶液褪色,但不能使得溴水褪色,甲苯只能和纯溴发生反应,不能和溴水发生反应;苯环既不能与酸性高猛酸钾反应使得其褪色,也不能和溴水/溴的四氯化碳溶液反应,只能和纯的液溴发生反应。
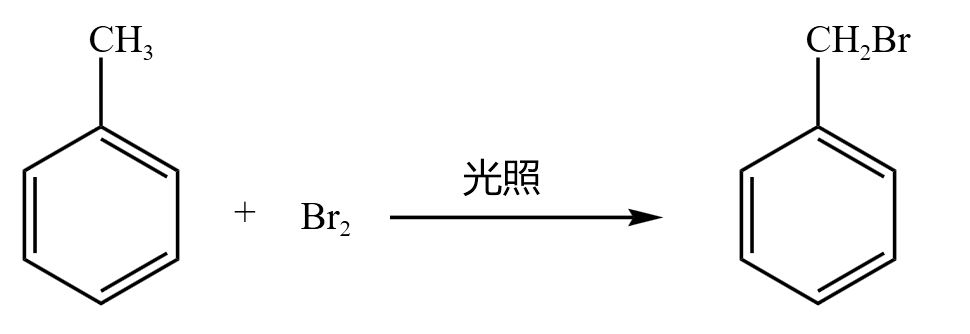
【光照条件下反应】
如果在光照条件下反应,则甲苯中甲基上的氢被取代,如下:
【总结】
光照(加热)条件下,甲苯中甲基侧链上的氢被取代;
\(\ce{FeBr3}\) 催化条件下:甲苯中苯环上的氢被取代。
硝化反应
苯和浓硝酸 \(\ce{HNO3}\)(可写为 \(\ce{HO-NO2}\))反应,苯环上的 \(\ce{H}\) 被取代成硝基 \(\ce{-NO2}\),生成硝基苯,浓硝酸中剩下的 \(\ce{-OH}\) 与被取代的 \(\ce{H}\) 生成水,如下:
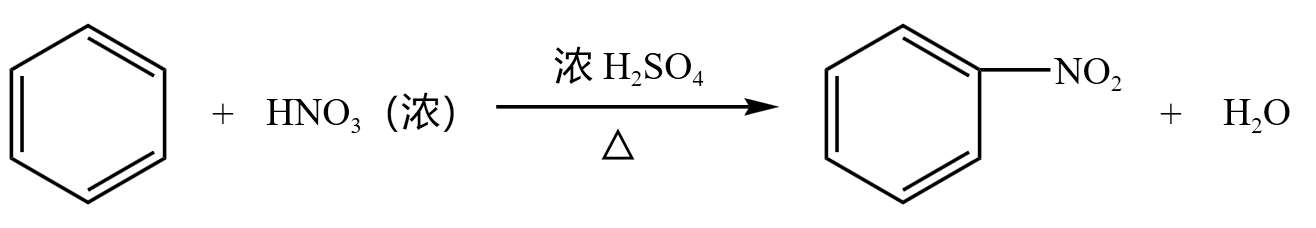
硝基型的化合物大多易燃易爆,所以加热一般是 \(\ce{55 ^\circ C\sim 60 ^\circ C}\) 水浴加热,所以实验装置需要将温度计插入水中。
硝基苯是苦杏仁味的物质,密度比水大。
注意:取代反应得到的产物,溴苯和硝基苯密度都比水大。
拓展:生成物硝基苯如果加入 \(\ce{Fe/HCl}\) 会得到苯胺
,苯胺与羧基 \(\ce{-COOH}\) 反应得到类似酰胺的化合物
。一般情况下在有机推断题中,如果出现了硝化反应,大概率需要把硝基还原成氨基让氨基进行反应。
甲苯中苯环由于甲基的活化作用,会使得「邻位」和「对位」上的氢发生取代反应,完全取代下反应方程式如下:
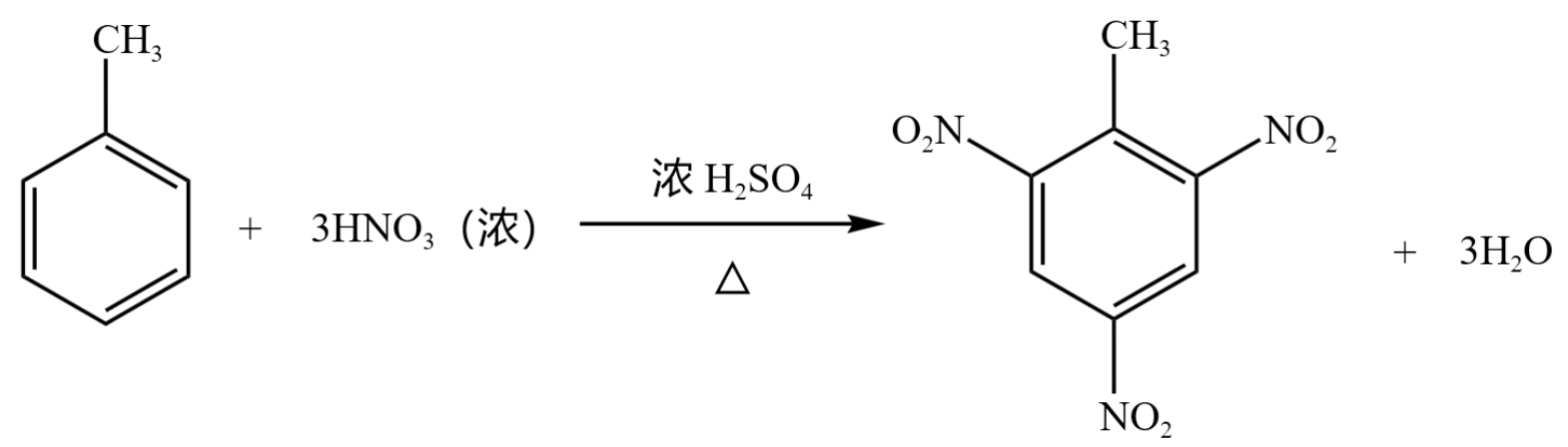
生成的三硝基甲苯是 TNT 的主要成分。
磺化反应
苯环和浓硫酸直接发生反应,浓硫酸的结构式为 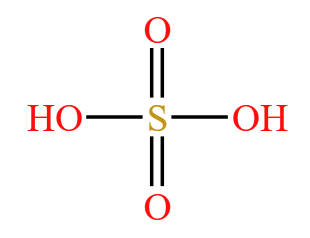 ,其中一个 \(\ce{-OH}\) 会与苯环中的 \(\ce{H}\) 反应生成 \(\ce{H2O}\),反应方程式如下:
,其中一个 \(\ce{-OH}\) 会与苯环中的 \(\ce{H}\) 反应生成 \(\ce{H2O}\),反应方程式如下:
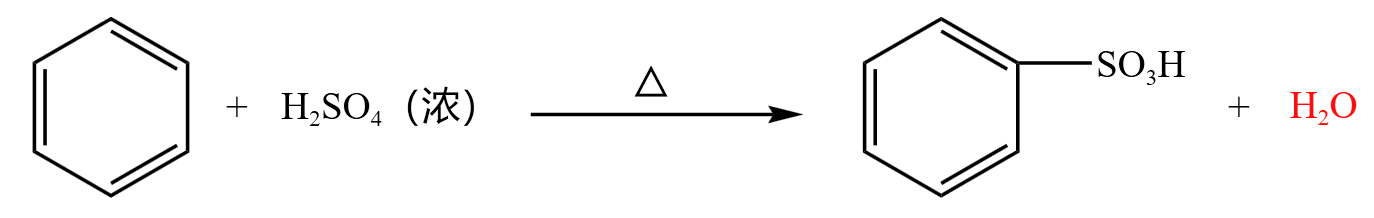
生成物为苯磺酸和水,苯磺酸一般在生活中作洗涤剂等。
加成反应
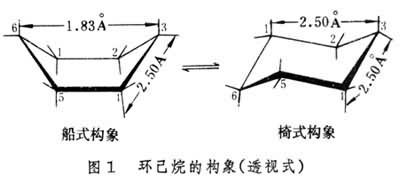
苯环与氢气加成,得到环己烷。苯环中每个碳原子都是 \(\ce{sp^2}\) 杂化,得到的环己烷每个碳原子变为 \(\ce{sp^3}\) 杂化,所以原苯环中所有碳原子共平面,而环己烷中碳原子一定不会共平面,而是立体结构。环己烷有两种构象,一个是「船式构象」,一个是「椅式构象」,体现了环己烷的立体结构,如下图所示。
苯环被氢气加成的反应方程式如下:
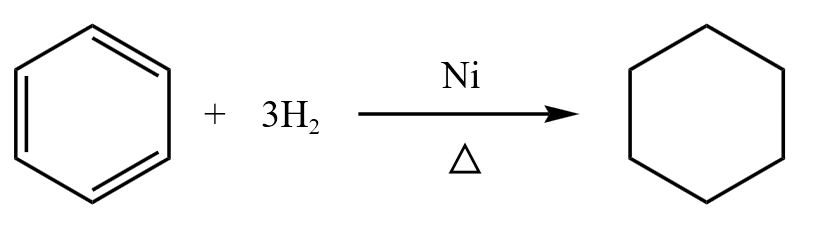
甲基被氢气加成同理,会生成甲基环己烷,如下:
拓展:
苯环还能被氯气加成,得到六氯环己烷 \(\ce{C6H6Cl6}\),是一种农药的主要成分。反应方程式如下:
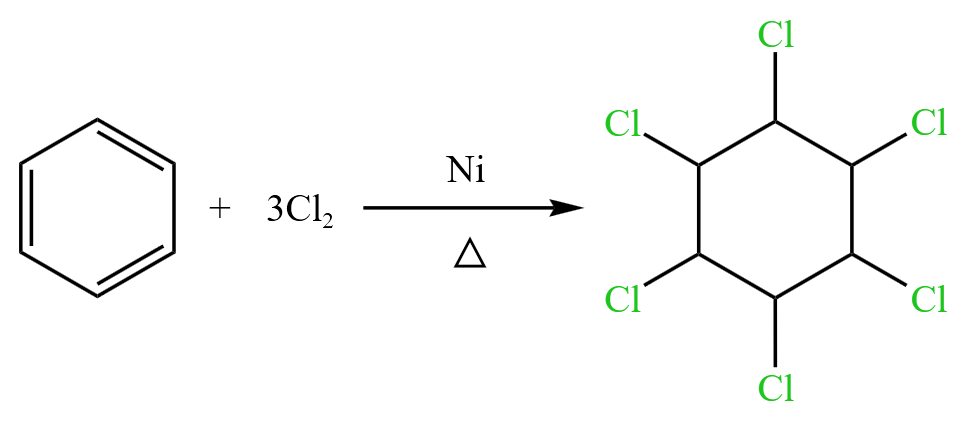
例题
例:下列能说明苯分子中的碳碳键不是单、双键交替排布的事实是()
A. 苯的邻位二元取代物只有一种
B. 苯的间位二元取代物只有一种
C. 苯不能使酸性高锰酸钾溶液褪色
D. 苯分子中碳碳键键长相同
E. 苯分子中所有原子在同一平面上
分析:
A 选项:如果苯分子中的碳碳键是单双键交替排布,那么苯应该有两种邻位二取代物,即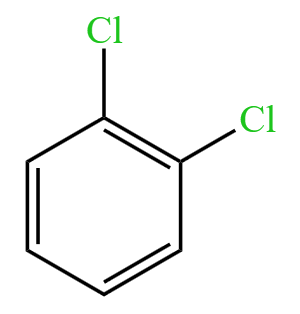 和
和 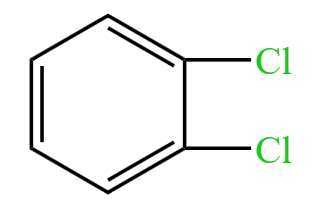 ,即连有 \(\ce{Cl}\) 的两个碳之间是碳碳双键或碳碳单键。所以邻位二元取代物只有一种可以说明苯分子中的碳碳键不是单双键交替排布。
,即连有 \(\ce{Cl}\) 的两个碳之间是碳碳双键或碳碳单键。所以邻位二元取代物只有一种可以说明苯分子中的碳碳键不是单双键交替排布。
B 选项:无论苯分子中的碳碳键如何排布,间位二元取代物中,连有取代基的两个碳之间一定有一个碳碳单键一个碳碳双键,所以无论如何邻位二元取代物都有一种,所以不能说明苯分子中碳碳键不是单双键交替。
对位二元取代物同理,对位二元取代物只有一种也不能说明碳碳键不是单双键交替排布。
C 选项:若苯分子中含有碳碳双键,则能够使得高锰酸钾溶液褪色,所以苯分子不能使得酸性高锰酸钾褪色则证明了苯不是单双键交替排布。
D 选项:若苯分子中单双键交替排布,则由于单键和双键键长不同,所以苯分子中碳碳键键长一定不完全相同,所以苯分子碳碳键键长相同可以说明苯分子中的碳碳键不是单双键交替排布。
E 选项:单双键交替排布时,由于双键已经是平面结构,所以一定所有原子在同一平面上,所以苯分子中所有原子在同一平面上不能说明碳碳键不是单双键排布。
综上所述,选 ACD。


