【文化课学习笔记】【化学】选必三:有机化合物的结构特点与研究方法(上)
【化学】选必三:有机化合物的结构特点与研究方法
读前须知
我个人高中文化课是纯自学的,化学从元素化学开始一直跟的是 B 站一化儿基础大合集,一直跟到结构化学结束,有机化学实际上也看了这篇博客笔记相关的内容。可以说一化儿讲课的某些方面还是很不错的,至少选必一化学平衡、水溶液离子平衡的部分,我跟着一化儿 + 做必刷题,把高考选择压轴题难度的那道离子平衡正确率提高到 80% 以上,这很大程度上要归功于一化儿的讲课。 但是,到了结构化学部分我发现一化儿这部分的课程缺乏体系化,对我这种完全没有学校老师教的野孩子来说,其实第一遍学并不是很友好,并且有些地方有点乱,存在后面才讲的内容就在前面的课程中用到的情况。但因为结构化学相对较为简单,我还是跟完了一化儿基础大合集的结构化学部分,然后用 B 站化学超人的讲义做补充。但到了有机化学部分,我发现或许是因为这块难度高了,我直接跟着一化儿然后用化学超人的讲义补充已经不够了,所以实际上有机化学的学习我走了很多弯路。先是跟一化儿 + 化学超人讲义补充,后来又改为跟化学超人的课程 + 一化儿的讲义补充,导致其实我光在「有机化合物的结构特点与研究方法」这块,我花费了整整一个月的时间来找最适合我的课,同时我几乎听完了同一部分一化儿 + 化学超人的所有课程,但做题感觉还是不是很顺。一化儿讲课方式不错,但缺乏体系化,化学超人讲课方式和体系化都不错,但是或许是因为我刚开始连化学超人主要的课在哪都不知道然后乱听了好久,同一个知识点听了好几遍,本来刚开始不扎实的东西又要重新听,反正因为各种原因吧,我一直觉得我有机学的很狗屎。后来我想起来 xht 学长在知乎回答中曾经推过的李政化学,就试一试的心态买了李政老师在 B 站上的课程,然后从 0 开始又把李政老师这块的课程全部听了一遍。然后我结合了我听过的三个老师的课程,整理了这份笔记。说实话,在我看来,李政老师是三位老师里面讲的我认为相对最清楚,最有体系化,也是最适合我的,在他这里我确实能感受到花钱的课程比不花钱的课程的好的地方。所以我之后的笔记内容可能整体也会直接跟着李政老师的课程体系做笔记,按照他的课程逻辑写笔记。我仍然会把接下来的有机化学的笔记更新在我的博客,同时存档在 B 站一化儿和李政老师下面的笔记区,可能从 B 站来看我笔记的大部分都是从一化儿来的,可能要让你们失望了,很抱歉,我的笔记接下来不太会按照一化儿的讲课体系去写了。但是或许你也能从我的笔记中学习到一些东西,这些笔记将永久免费存放在我博客内,希望它能对你有所帮助,感谢阅读。更新日志:
- 2024.5.26:听完了一化儿基础大合集的相关内容,写完了一化儿讲到的部分。
- 2024.7.1:对比了一化儿、化学超人和李政老师三个对应的课程,把三个老师的课程听完之后整合成为现在的最终版,并分为上、下两份,存档在我的博客园。
有机物的六式两模型
有机物的「六式」
分子式
定义:用元素符号表示物质分子组成的式子。
例如:甲烷的分子式为 \(\ce{CH4}\),乙烷的分子式为 \(\ce{C2H6}\),乙炔的分子式为 \(\ce{C2H2}\),蔗糖(麦芽糖)的分子式是 \(\ce{C12H22O11}\)。
注意:只有分子才有分子式。
实验式(最简式)
定义:分析实验中,通过燃烧法测定。有机物主要含有 \(\ce{C、H、O}\) 三种元素,燃烧之后,\(\ce{C}\) 全部变成 \(\ce{CO2}\),\(\ce{H}\) 全部变成 \(\ce{H2O}\),可通过 \(\ce{CO2}\) 和 \(\ce{H2O}\) 的质量计算出有机物中的 \(\ce{C、H、O}\) 最简整数比。
例:\(\ce{C2H4、C3H6}\) 的实验式都是 \(\ce{CH2}\)。
电子式
定义:用 \(·\) 或 \(\times\) 表示原子最外层电子的成键情况。
例:甲基 \(\ce{-CH3}\) 的电子式是 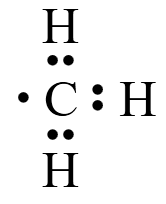 。注意:不能单纯通过电子式中电子的数量来判断电子的数目,它只表示最外层电子的成电情况。比如甲基电子式中虽然只标明了 \(7\) 个电子,但它实际上有 \(6 + 3 = 9\) 个电子。
。注意:不能单纯通过电子式中电子的数量来判断电子的数目,它只表示最外层电子的成电情况。比如甲基电子式中虽然只标明了 \(7\) 个电子,但它实际上有 \(6 + 3 = 9\) 个电子。
结构式
定义:再电子式中用一条短线表示一对共用电子对将每个原子连接起来的式子。即将有机物分子内部所有原子的成键都画出来。
例:甲烷的结构式为 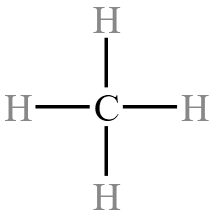 ,丙烯的结构式为
,丙烯的结构式为 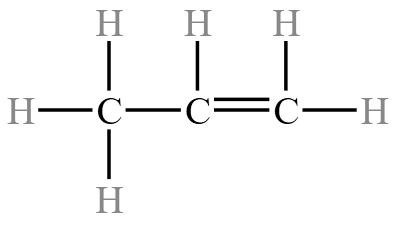 ,而不是
,而不是 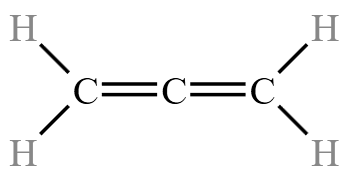 ,它是丙二烯。
,它是丙二烯。
结构简式
定义:将有机物分子中的碳碳单键和碳氢单键省略掉所得到的结构,也可以只省略碳氢键,得到的结构就叫结构简式。
书写:先建立碳骨架,然后填入氢。
例:正戊烷从结构式简化到结构简式的过程如下:
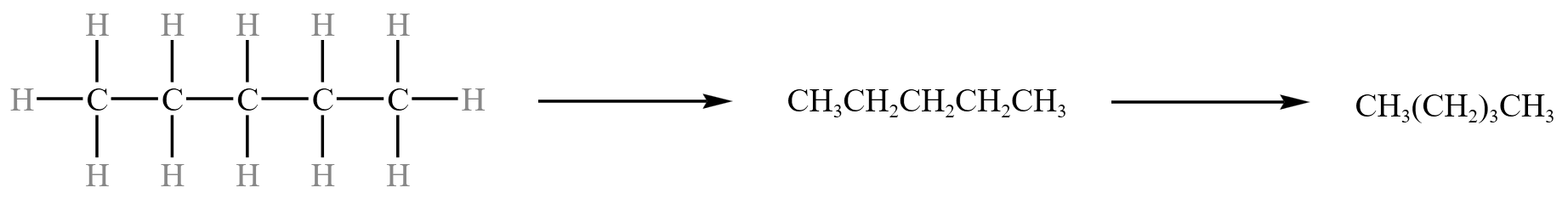
后两种都是结构简式。
\(1-\) 丁烯从结构式简化到结构简式的过程:
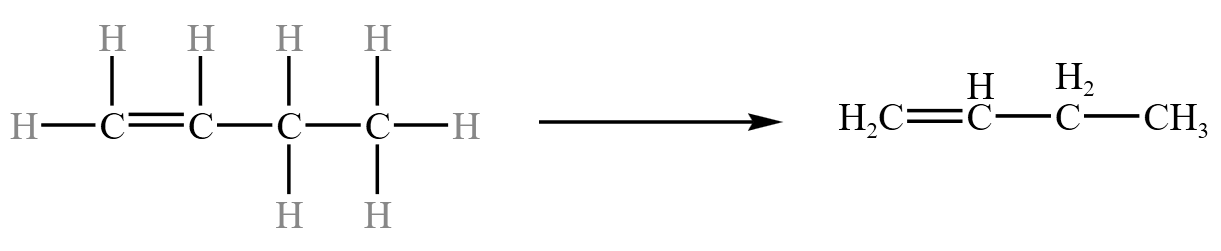
乙酸从结构式简化到结构简式的过程:
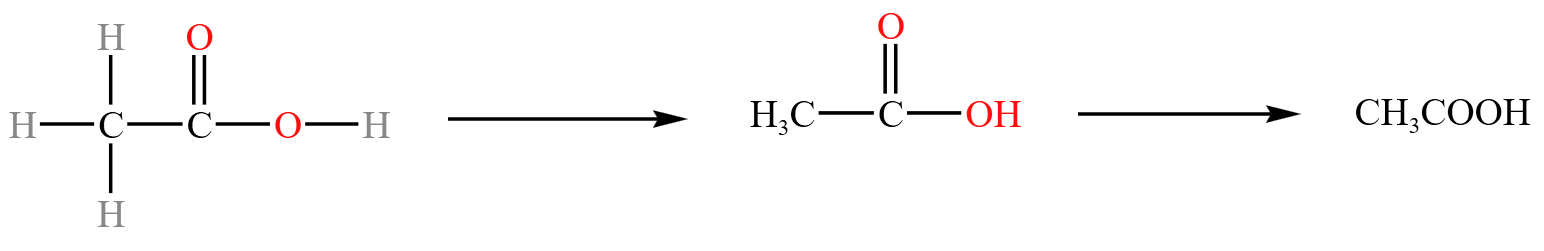
注意:氢氧键可以合并为 \(\ce{-OH}\),氮氢键也可以合并为 \(\ce{-NH2}\),碳氧键、碳氮键也可以合并在一起,例如 \(\ce{CH3CH2OH、CH3NH2}\)。
注意事项:
- 应该先写出主碳链,再补上氢原子与后续官能团。
- 需要准确表示分子中原子的成键情况。绝大多数情况下,化学键应该写在成键原子旁,如 \(\ce{-NO2}\) 不能写成 \(\ce{NO2 -}\)。物质「肼」必须写成 \(\ce{H2N-NH2}\),以确保化学键连接的是成键原子 \(\ce N\)。但对于碳原子而言,由于实在用得太多,人们为了方便书写,可以不精确区分成键原子。如 \(\ce{-CH3}\) 与 \(\ce{CH3 -}\) 在一般情况下没有区别。同理,\(\ce{H2C=CH2}\) 与 \(\ce{CH2=CH2}\) 等效。
- 可以省略的键:醛基 \(\ce{-CHO}\) 中各键,羧基 \(\ce{-COOH}\) 中各键,氰基 \(\ce{-CN}\) 中各键。
- 不可省略的键:碳碳双键、碳碳三键。
键线式
定义:将有机物的碳原子和氢原子全部省略掉,只表示出碳碳键以及与碳原子项链的官能团,以碳骨架来表示有机物的结构。
通过键线式写出结构简式的方法:先数出碳原子的个数,建立碳骨架;再在碳原子上填入氢。
例: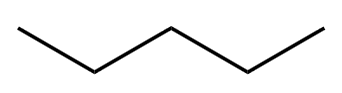 的结构简式为 \(\ce{CH3-CH2-CH2-CH2-CH3}\)。
的结构简式为 \(\ce{CH3-CH2-CH2-CH2-CH3}\)。
\(\ce{HOOC-CH2-CH2-COOH}\) 的键线式为 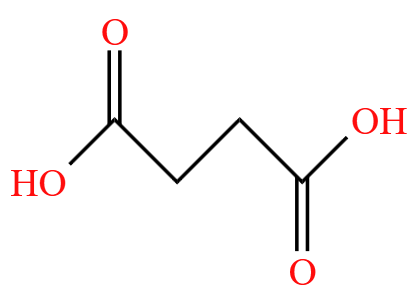 。
。
如图所示,下图从左到右,分别是有机物 \(2-\) 甲基 \(-1-\) 丁烯的结构式、结构简式和键线式的表示方法。
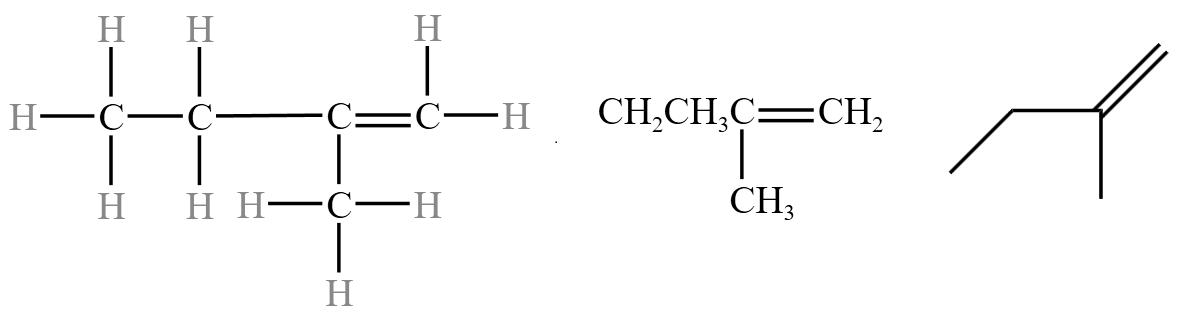
注意事项:
- 键线式一般之忽略 \(2\) 个碳原子以上的有机物。
- 只忽略 \(\ce{C-H}\) 键,其余不能忽略。
- 只忽略碳上的氢原子,官能团的氢原子不省略。
- 计算分子式时不要忘记顶端碳原子。
有机物的「两型」
球棍模型
定义:可以反应分子的三维空间分布的模型。主要描述原子大小、成键特性、分子构型。
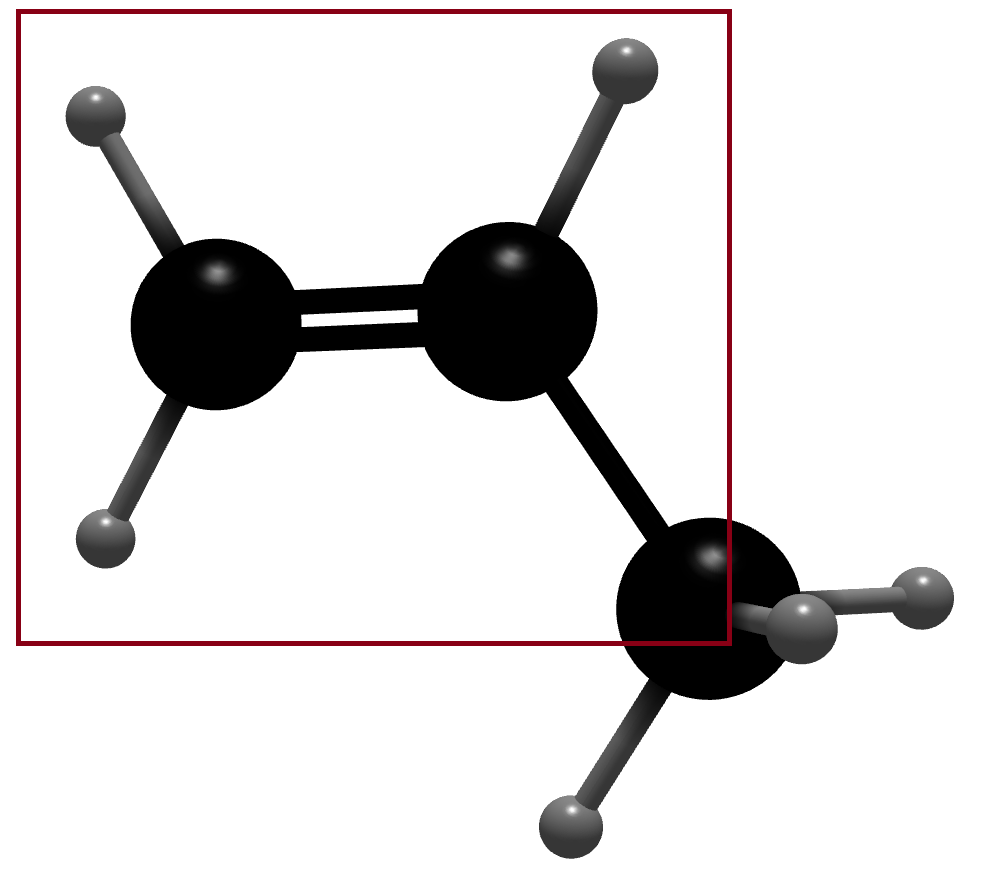
例: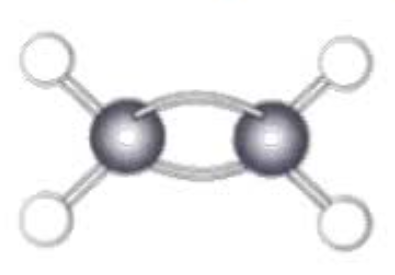 表示乙烯。
表示乙烯。
空间填充模型(比例模型)
定义:表示分子中各原子的实际大小和连接情况。(没有表示出成键特性)
例: 表示乙烯。
表示乙烯。
注意:判断空间填充模型时,需重点分析原子的半径。例如:\(\ce{CCl4}\) 的空间填充模型不能是 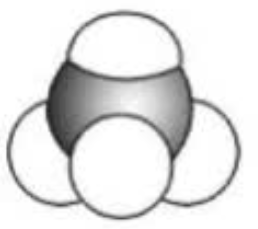 ,因为 \(\ce{Cl}\) 的原子半径比 \(\ce{C}\) 大。
,因为 \(\ce{Cl}\) 的原子半径比 \(\ce{C}\) 大。
有机物的分类方法
按元素分类
注意:碳酸 \(\ce{H2CO3}\),以及 \(\ce{HCN、SiC}\) 等属于无机物,而草酸 \(\ce{H2C2O4}\) 属于有机物。有机物和无机物并没有特别明确的界限。
按碳骨架分类
有机化合物
脂肪烃的衍生物举例: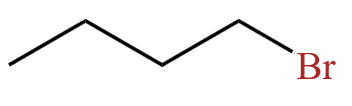 。
。
脂环烃举例: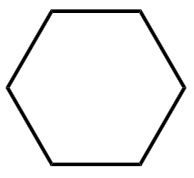 。
。
脂环烃的衍生物举例:环己醇 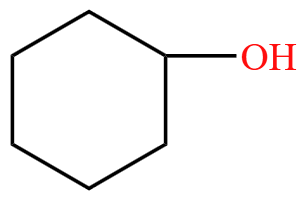 ,四氢呋喃
,四氢呋喃 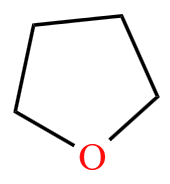 。
。
芳香化合物举例(含有苯环):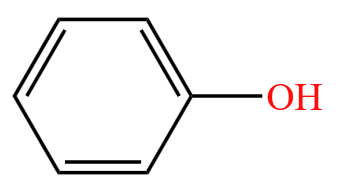 。
。
烃
只含有碳、氢两种元素的有机物。
脂环烃举例:环丙烷 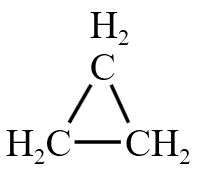 。
。
苯的结构式: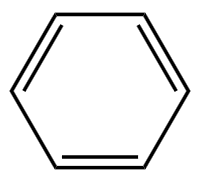 。
。
苯的同系物举例: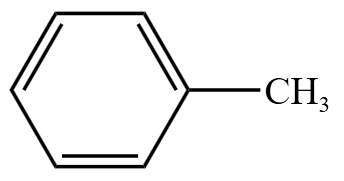 。
。
稠环芳香烃: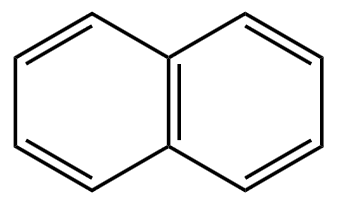 。
。
按官能团分类
官能团的定义
官能团是决定有机化合物特殊性质(主要是化学性质)的原子或原子团。
有机物的主要类别、官能团和典型代表物
| 类别 | 官能团 | 代表物名称、结构简式 |
|---|---|---|
| 烷烃 | 无官能团 | 甲烷 \(\ce{CH4}\) |
| 烯烃 | 碳碳双键 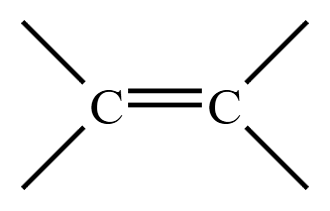 |
乙烯 \(\ce{CH2=CH2}\) |
| 炔烃 | 碳碳三键 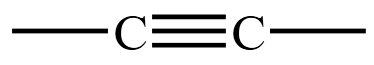 |
乙炔 \(\ce{CH#CH}\) |
| 卤代烃 | 卤代原子 \(\ce{-X}\),或叫碳卤键 | 溴乙烷 \(\ce{C2H5Br}\),官能团为碳溴键 \(\ce{-Br}\) |
| 醇 | 羟基 \(\ce{-OH}\) | 乙醇 \(\ce{C2H5OH}\) |
| 酚 | 羟基 \(\ce{-OH}\) | 苯酚  |
| 醚 | 醚键 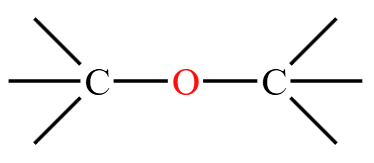 |
乙醚 \(\ce{CH3CH2OCH2CH3}\) |
| 醛 | 醛基 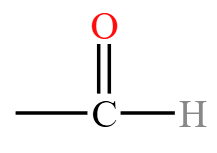 |
乙醛 \(\ce{CH3CHO}\) |
| 酮 | 酮羰基 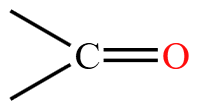 |
丙酮 \(\ce{CH3COCH3}\) |
| 羧酸 | 羧基 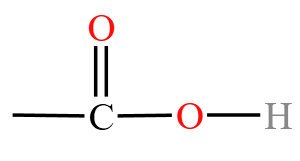 |
乙酸 \(\ce{CH3COOH}\) |
| 酯 | 酯基 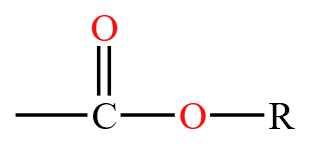 |
乙酸乙酯 \(\ce{CH3COOCH2CH3}\) |
| 氨基酸 | 氨基 \(\ce{-NH2}\),羧基 \(\ce{-COOH}\) | 甘氨酸 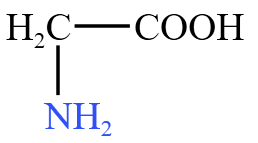 |
| 胺 | 只含有氨基 \(\ce{-NH2}\) | 甲胺 \(\ce{CH3NH2}\) |
| 酰胺 | 酰胺基 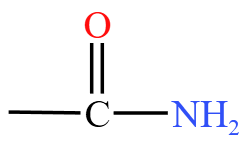 或酰胺键 或酰胺键 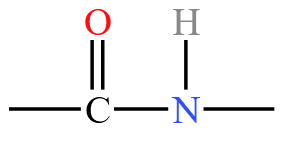 ,例如酰氯 ,例如酰氯 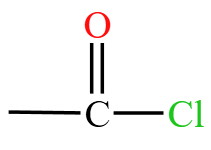 |
乙酰胺 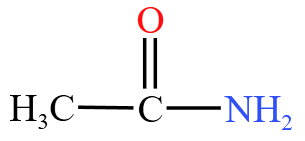 |
| 硝基化合物 | 硝基 \(\ce{-NO2}\) | 硝基苯 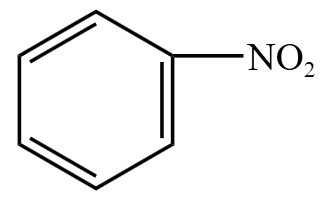 |
| 腈 | 氰基 \(\ce{-CN}\) | 丙烯腈 \(\ce{CH2=CH-CN}\) |
注:
- 卤代烃指的是烃的氢原子被卤族原子代替后形成的产物。
- 羰基碳氧双键左右都要连碳原子。
- 酚羟基中,羟基一般与芳香环(大概分为苯环、萘环、\(\alpha -\) 甲基萘等)相连,而醇羟基中,羟基一般与脂肪类(脂肪烃、脂环等)相连,据此可以根据结构式区分有机物是醇羟基还是酚羟基。
- 酮羰基碳原子两边必须连碳。
例:问高聚物(聚酯) 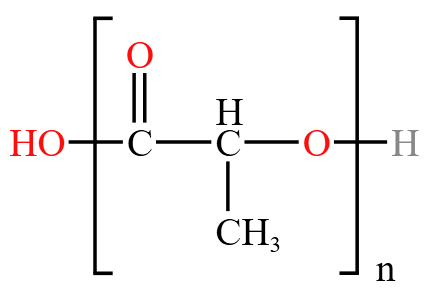 中含有哪些官能团?
中含有哪些官能团?
高聚物相当于中间框内部分重复 \(n\) 次,框外两边部分不变。那么首先考虑框外部分,两边含有羧基 \(\ce{-COOH}\) 和羟基 \(\ce{-OH}\),将框内部分展开如下:
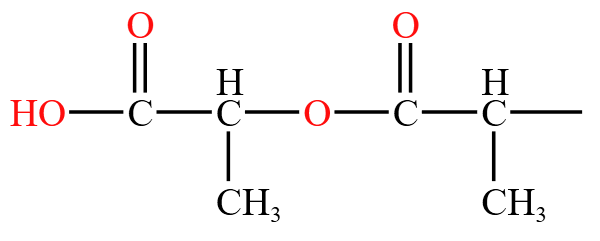
从而可以看出其中还有酯基。
有机物中的共价键
有机物碳原子成键特点
有机物碳原子成键特点:(碳碳)单键可以旋转,(碳碳)双键、三键不能旋转。简而言之,\(\sigma\) 键可以旋转,但 \(\pi\) 键不能旋转。
甲烷型
成键
甲烷分子中有 \(4\) 条 \(\ce{C-H}\) 单键。
在甲烷分子中,\(\ce{H}\) 原子的 \(\ce{1s}\) 轨道与 \(\ce{C}\) 原子的一个 \(\ce{sp^3}\) 杂化轨道以「头碰头」的形式相互重叠,形成 \(\sigma\) 键。
通过 \(\sigma\) 键连接的原子或原子团可绕键轴旋转而不会导致化学键破坏。
结构
甲烷是正四面体结构。凡是碳原子与 \(4\) 个原子形成 \(4\) 个共价键时,其空间结构都是四面体形。\(5\) 个原子中最多有 \(3\) 个原子共平面。
例如:二氯甲烷 \(\ce{CH2Cl2}\) 碳上另外四个位置完全等效,所以没有同分异构体。
乙烯型
成键
乙烯分子中有 \(4\) 条 \(\ce{C-H}\) 单键,\(1\) 条 \(\ce{C-C}\) 双键(一条 \(\ce{C-C}\) \(\sigma\) 键,一条 \(\ce{C-C} ~\pi\) 键)。
乙烯分子中,碳原子以 \(\ce{sp^2}\) 杂化轨道与氢原子的 \(\ce{1s}\) 轨道及另一个碳原子的 \(\ce{sp^2}\) 杂化轨道进行重叠,形成 \(4\) 个 \(\ce{C-H}\) \(\sigma\) 键与一个 \(\ce{C-C}\) \(\sigma\) 键;两个碳原子未参与杂化的 \(\ce p\) 轨道以「肩并肩」的形式从侧面重叠,形成 \(\pi\) 键。
通过 \(\pi\) 键连接的原子或原子团不能绕键轴旋转。
结构
乙烯未平面结构。与碳碳双键直接相连的 \(4\) 个原子与 \(2\) 个碳原子共平面。
例:\(\ce{CH2=CHCH3}\) 至少有 \(6\) 个原子共面(下图中红框中的 \(6\) 个原子共面),最多有 \(7\) 个原子共平面(在原来 \(6\) 个原子的基础上,红框外的三个氢原子通过旋转,使得其中有一个氢原子与红框中的 \(6\) 个原子共面)。
乙炔型
成键
乙炔分子中有 \(2\) 条 \(\ce{C-H}\) \(\sigma\) 键,\(1\) 条 \(\ce{C-C}\) \(\sigma\) 键和 \(2\) 条 \(\ce{C-C}\) \(\pi\) 键。
乙炔分子中,\(\ce C\) 原子以 \(\ce{sp}\) 杂化轨道与氢原子的 \(\ce{1s}\) 轨道及另一个 \(\ce{C}\) 原子的 \(\ce{sp}\) 杂化轨道进行重叠,形成 \(2\) 个 \(\ce{C-H}\) \(\sigma\) 键与 \(1\) 个 \(\ce{C-C}\) \(\sigma\) 键;两个 \(\ce{C}\) 原子未参与杂化的 \(\ce p\) 轨道以「肩并肩」的形式从侧面重叠,形成 \(2\) 个 \(\pi\) 键。
结构
乙炔为直线结构。与碳碳三键直接相连的 \(2\) 个原子与 \(2\) 个碳原子共直线。
苯型
成键
苯分子中有 \(6\) 条 \(\ce{C-H}\) \(\sigma\) 键,\(6\) 条 \(\ce{C-C}\) \(\sigma\) 键和 \(1\) 条环状的离域 \(\pi\) 键(大 \(\pi\) 键)。
苯分子中,\(\ce C\) 原子以 \(\ce{sp^2}\) 杂化轨道与 \(\ce{H}\) 原子的 \(\ce{1s}\) 轨道及另一个 \(\ce{C}\) 原子的 \(\ce{sp^2}\) 杂化轨道进行重叠,形成 \(6\) 个 \(\ce{C-H}\) \(\sigma\) 键与 \(6\) 个 \(\ce{C-C}\) \(\sigma\) 键。\(6\) 个 \(\ce{C}\) 原子未参与杂化的 \(\ce{p}\) 轨道以「肩并肩」的形式相互重叠且程度相同,由此在环平面的上下形成了离域 \(\pi\) 键。
结构
苯为平面六边形结构。
位于苯环上的 \(12\) 个原子共平面,位于对角线位置上的 \(4\) 个原子共直线。
总结
- 一般情况下,有机化合物中的单键是 \(\sigma\) 键,双键中含有一个 \(\sigma\) 键和一个 \(\pi\) 键,三键中含有一个 \(\sigma\) 键和两个 \(\pi\) 键。
- 共价键的类型与有机反应的类型密切相关:甲烷分子中含有 \(\ce{C-H}\) \(\sigma\) 键,能发生取代反应;乙烯和乙炔分子的双键和三键中含有 \(\pi\) 键,能发生加成反应。即结构决定性质。
共线共面问题
基本思路:
- 问最少:画出构型,判断。
- 问最多:旋转单键,判断。
技巧:只要有 \(\ce{sp^3}\) 杂化的碳原子,有机物一定不可能所有原子共平面。
例题:
例 1: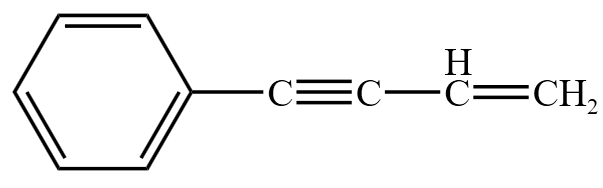 最多有多少个原子共直线,多少个原子共平面?
最多有多少个原子共直线,多少个原子共平面?
画出其构型,如下图所示。根据下图可知,最多有 \(6\) 个原子共直线,所有原子(\(18\) 个原子)共平面。
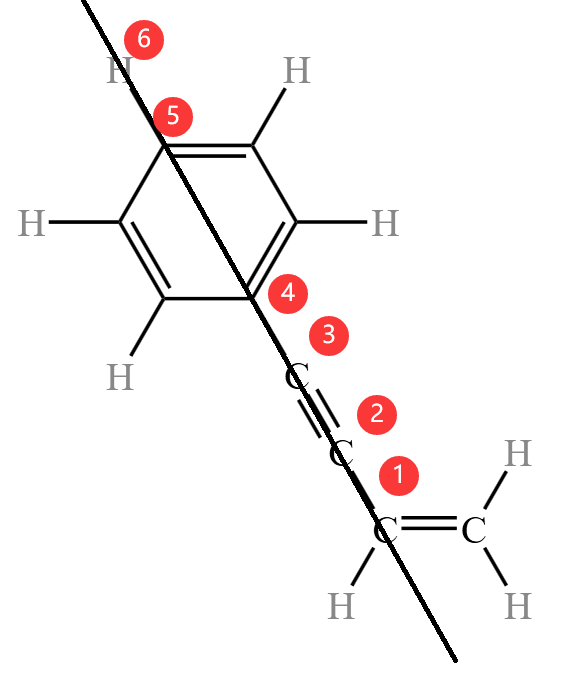
例 2: 分子中,同一平面内的碳原子至少有多少个?
分子中,同一平面内的碳原子至少有多少个?
首先左边的苯环,加上其连着的碳原子,总共有 \(7\) 个碳一定共面,然后考虑绕中间轴旋转,则另一个苯环上页也一定有 \(2\) 个碳原子与其共面,那么同一平面内的碳原子至少有 \(9\) 个。
同系物和同分异构现象
同系物
定义:结构相似、分子组成相差若干个 \(\ce{CH2}\) 原子团的有机物互称为同系物。
注意:结构相似指有机物的官能团种类、数目必须相同。
性质:同系物的不饱和度也一定相同。
判断:
- 首先判断给定两种有机物含有官能团的种类、数目相同。
- 然后再判断两种有机物分子式是否相同:在不含环的情况下,一般只需判断碳数是否一致即可,若碳数不一致,则说明是同系物;否则是同分异构体。
例:
对于烷烃而言,所有不含碳碳双键、三键、环的链状烷烃,都互为同系物。
对于烯烃而言,其同系物中含有碳碳双键的个数一定与原烯烃中含有碳碳双键的个数相同。例如: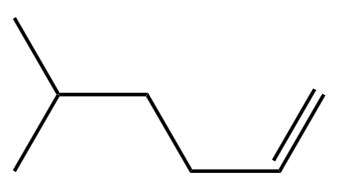 是乙烯的同系物,但
是乙烯的同系物,但 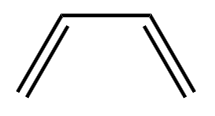 不是乙烯的同系物。
不是乙烯的同系物。
注意:醇羟基和酚羟基不属于同一种官能团,需要区分。
同分异构现象
定义&性质
同分异构现象:化合物具有相同的分子式,但具有不同结构的现象。
同分异构体:分子式相同而结构不同的有机物互为同分异构体。
性质:互为同分异构体的有机物,分子式和不饱和度一定相同。
分类
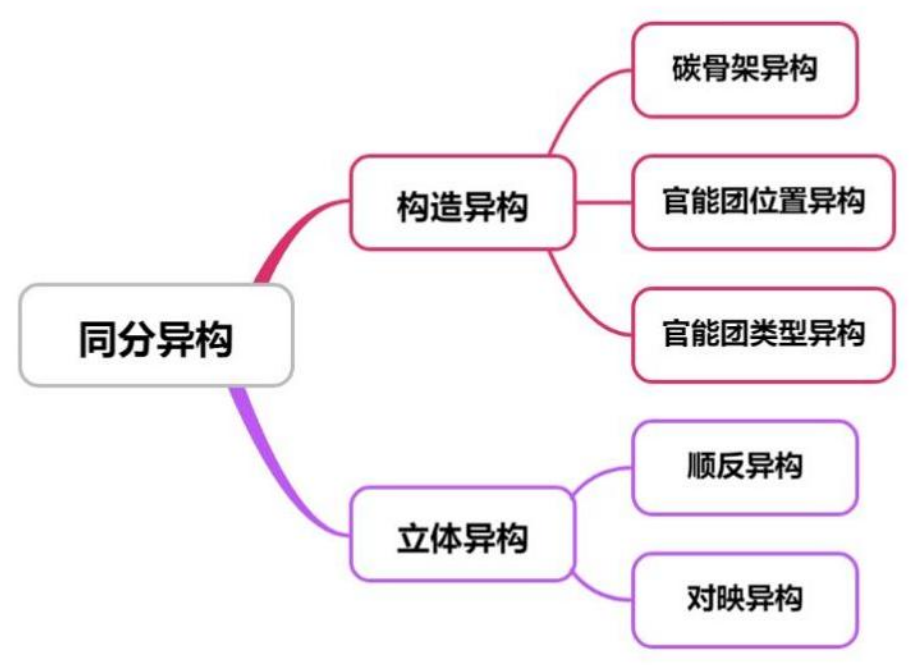
构造异构
定义:化合物中原子及原子团的连接次序不同。
碳骨架异构:碳骨架不同而产生的异构,如下图。
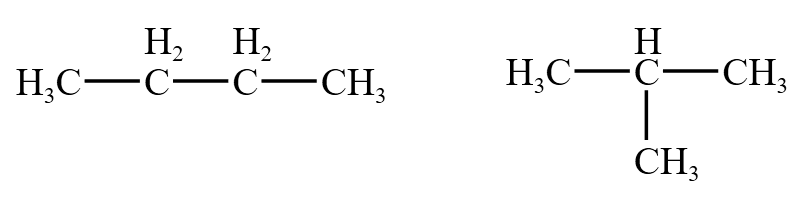
官能团位置异构:官能团位置不同而产生的异构,如下图。
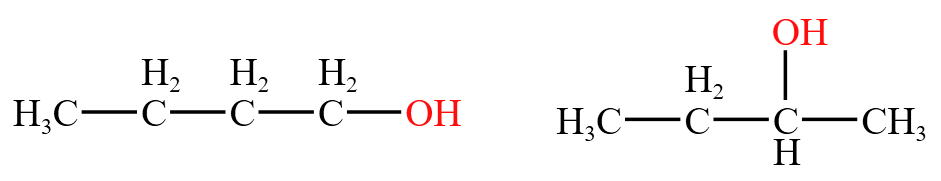
注:左图的醇是端基醇,右图的图是非端基醇。
官能团类型异构:官能团种类不同而产生的异构,如下图。
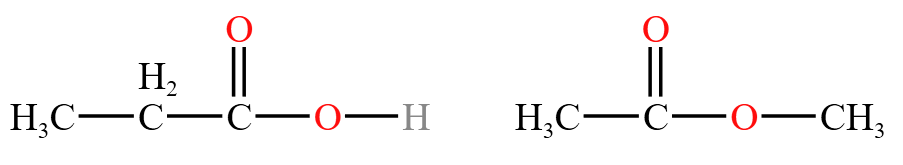
立体异构
定义:原子或原子团互相连接的次序相同,但在空间的排列方式不同。
顺反异构:
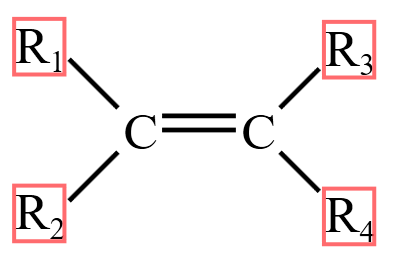
顺反异构,又名几何异构,属于立体异构中的一种。顺反异构是指化合物分子中由于具有自由旋转的限制因素,使各个基团在空间的排列方式不同而出现的非对映异构现象。如图所示,若 \(\ce{R_1\ne R_2}\) 且 \(\ce{R_3\ne R_4}\) 则存在顺反异构。若相同原子团在同一侧,则称为顺式;若在不同侧,则称为反式。
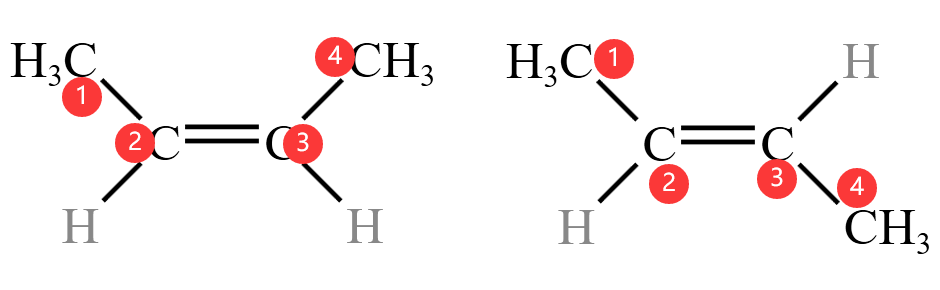
例如,下面左图中的烯烃由于上面的两个碳原子在同一侧,所以就是顺式,称为顺 $- 2 - $ 丁烯;而右图中烯烃由于碳原子在不同侧,所以就是反式,称为反 \(-2-\) 丁烯。
顺反异构产生的本质:碳碳双键或氮氮双键 \(\ce{N=N}\) 不可旋转。例如
该结构存在顺反异构。
注意:只含有 \(\ce{N-N}\) 键的物质不存在顺反异构。
对映异构(手性异构或旋光异构):
两分子呈镜像关系,相似但不能完全重叠,互称为对映异构体。
手性原子:是指与四个各不相同的原子或基团相连的原子,用星号 * 表示。对于环状物质,不能只看与碳原子相连的最近的原子,例如
该物质中,① 号碳原子,虽然有两个位置都连的是碳原子,但右边经过 \(2\) 个碳就到达分叉口了,而左边需要经过 \(3\) 个碳,所以两个碳并不等价,所以 ① 号碳仍然是手性碳。
不饱和度
定义及计算方法
【定义】不饱和度指的是缺氢指数,符号:\(\Omega\)。它是和饱和烷烃相比,每少 \(2\) 个氢不饱和度 \(+1\)。例:对于 \(\ce{C4H8}\) 的不饱和度,和 \(4\) 个碳的饱和烷烃 \(\ce{C4H10}\) 对比,氢原子少了两个,所以不饱和度为 \(1\)。
【计算不饱和度规则】卤族原子当氢看,氧原子直接忽略,分子式有氮时,需要减掉 \(\ce{NH}\) 再算不饱和度。
【计算口诀】碳数加一氢减半,卤加氮减氧不算。例如:\(\ce{C7H10}\) 的不饱和度,可以直接碳数 \(7+1\) 减一半氢 \(-5\),所以不饱和度为 \(3\);\(\ce{C7H12}\) 的不饱和度,首先遇到氮,减去一个 \(\ce{NH}\),得到 \(\ce{C7H10Cl2}\),再把 \(\ce{Cl}\) 看成氢,得到 \(\ce{C7H12}\),碳数 \(7+1\) 减一半氢 \(-6\),所以不饱和度为 \(2\)。
【作用】在分子式和结构式之间建立了链接,可以帮助我们快速书写复杂有机物的分子式,也可以判断给定分子式的有机物中可能含有哪些官能团。
有机物中特殊结构的不饱和度
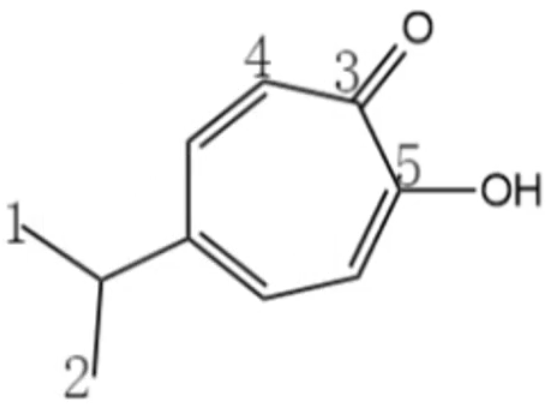
双键是 \(1\) 个不饱和度,三键是 \(2\) 个不饱和度,苯环是 \(4\) 个不饱和度,硝基 \(\ce{-NO2}\) 是 \(1\) 个不饱和度,氨基 \(\ce{-NH2}\) 是 \(0\) 个不饱和度。环是 \(1\) 个不饱和度,例如环丁烷分子式为 \(\ce{C4H8}\),相比丁烷少了两个氢,不饱和度为 \(1\)。立体结构可能存在多个环,立体结构计算不饱和度方法为环总数(总面数) \(-1\),例如立方烷 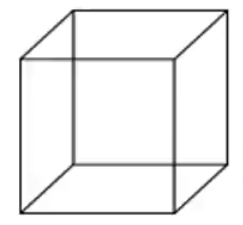 ,分子式为 \(\ce{C8H8}\),六个面有 \(6\) 个环,但是不饱和度为 \(5\)。
,分子式为 \(\ce{C8H8}\),六个面有 \(6\) 个环,但是不饱和度为 \(5\)。
当面数不好数时,可以采用最保险的分子式法,即根据立体结构写出有机物的分子式,然后根据不饱和度的一般求法解决问题。
所以当有一个不饱和度时,需要考虑分子中可能有醛基  ,羧基
,羧基  等;当没有氧,有一个不饱和度时,需要考虑分子中可能有碳碳双键,环烷烃等;当不饱和度 \(\ge 4\) 时,一般默认分子中含有苯环。
等;当没有氧,有一个不饱和度时,需要考虑分子中可能有碳碳双键,环烷烃等;当不饱和度 \(\ge 4\) 时,一般默认分子中含有苯环。
苯环 \(4\) 个 \(\Omega\) 的另一种计算方法:相当于一个环(\(1\) 个 \(\Omega\))加上三个碳碳双键(\(3\) 个 \(\Omega\)),总共 \(4\) 个 \(\Omega\)。
给定有机物结构式求分子式
思路:
- 根据特殊结构的不饱和度,求出整个有机物分子的不饱和度。
- 数出有机物结构式中 \(\ce C\) 的个数,写出假设只考虑碳氢原子时的分子式。
- 若题目有其它原子,再替换或增加其他原子:卤素原子要替换掉同等数量的氢原子,氧原子直接加上,有多少个 \(\ce{N}\) 就加多少个 \(\ce{NH}\)。
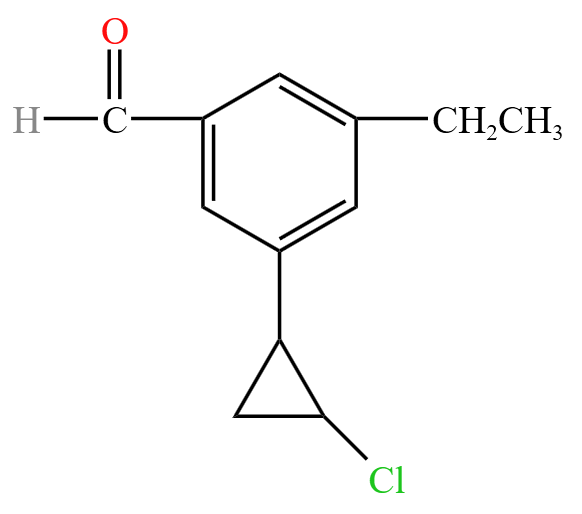
如下图所示,该有机物有 \(1\) 个双键,\(1\) 个苯环,\(1\) 个碳环,所以不饱和度为 \(1 + 4 + 1 = 6\)。该有机物中有 \(12\) 个 \(\ce C\),那么若不考虑卤素原子和氧原子,有机物应该为 \(\ce{C12H14}\),考虑把原来的 \(\ce{Cl}\) 换回去,并加上氧原子,得到有机物分子式为 \(\ce{C12H13ClO}\)。
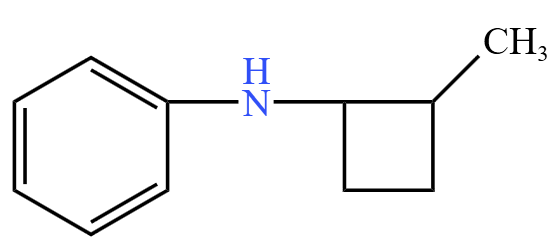
下图的有机物,有 \(1\) 个苯环,\(1\) 个碳环,所以不饱和度为 \(4 + 1 = 5\),有 \(11\) 个 \(\ce{C}\),只考虑碳氢原子,分子式应为 \(\ce{C11H14}\),由于有 \(1\) 个氮原子,所以考虑加回来一个 \(\ce{NH}\),所以最后有机物的分子式为 \(\ce{C11H15N}\)。
下图有机物,不饱和度为 \(1 + 4 + 2 + 4 = 11\),有 \(16\) 个碳,只考虑碳氢原子分子式为 \(\ce{C16H12}\),加上氧,有机物分子式为 \(\ce{C16H12O7}\)。

注意:多个苯环相连,若苯环数量为 \(n\),则不饱和度为 \(4n - n + 1 = 3n + 1\)。
不饱和度的意义
看待有机物组成的两种视角:
- 传统方法:有机物分子式、有机物结构式。
- 新视角:碳原子数、氧原子数、不饱和度 \(\Omega\)、官能团。
新视角不用数出氢原子个数。
总结:不饱和度 \(\Omega\) 是有机物分子式与结构式之间的桥梁,可以确定有机物基本信息。
等效氢和等效碳
定义
化学环境相同的氢原子/碳原子。「化学环境」可以理解为共价键的电子云环境。
识别
情况一
连在同一个碳上且结构相同的碳等效。
如图,\(1,2\) 号碳连在同一个碳上且结构相等(都为 \(\ce{-CH3}\)),他们就是等效碳。同时,连在同一个碳上的氢等效,所以 \(1,2\) 上接的所有氢均等效。而 \(4,5\) 号碳虽然都连在 \(3\) 号碳上,但它们结构明显不同,不能通过旋转或对称重合,所以 \(4,5\) 号碳并非等效碳。
那么该有机物中,连有氢原子的碳原子一共有 \(6\) 种,那么其一氯代物有 \(6\) 种情况。
有机物分子中有多少非等效碳原子,就有多少氢原子,那么就有多少种情况。
注意:高中阶段,\(\ce{-OH}\)、\(\ce{-CHO}\) 和 \(\ce{-COOH}\) 等官能团上的氢原子不考虑取代。
情况二
可以通过对称轴对称或旋转而重合的碳原子等效。
如下图,单键是可以旋转的,通过旋转:1 和 2、3 和 4 号位碳原子分别可以完全重合,可以完全重合、且结构相同的碳等效。
若 1 号碳多连一个甲基而 2 号碳没有甲基,那么他们不可能等效。
情况三
连在等效碳上的氢原子互相等效。
连在同一个碳上/等效碳上的氢原子,相当于同一种氢原子。所以一个邮寄结构种有几种碳原子(碳上连氢),就有几种氢原子。
例如:甲基 \(\ce{-CH3}\) 中三个 \(\ce{H}\) 连在同一个碳上,是等效氢;甲烷上四个碳原子等效,所以其一氯代物、二氯代物、三氯代物和四氯代物都只有 \(1\) 种情况。
常见的等效氢
- 连在同一个碳原子上的氢原子等效。
- 连载同一个碳原子上的甲基上的氢原子等效。
- 处于对称位置上(中心对称或轴对称)的氢原子等效。
求等效氢的一般方法
- 对于链状物质,先找到分岔口,即连在同一个碳上的官能团/原子,若官能团/原子相同,则两个官能团/原子上的氢原子等效;若官能团/原子不同,则两个官能团/原子上的氢原子均不等效。
- 对于环状物质,先找到对称轴或对称中心,则对称图形上对应点上的氢原子完全等效。
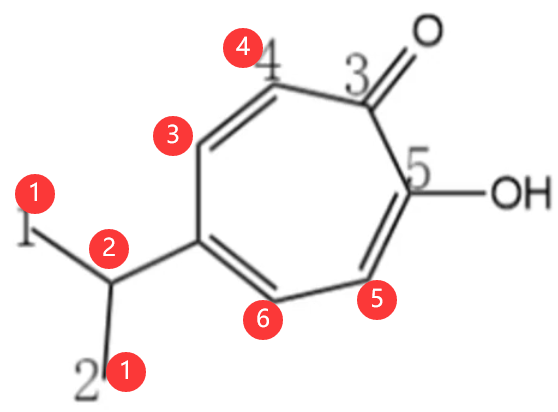
注意:对于烃来说,有几种等效氢,就有几种一取代物。但是对于其他物质而言,这句话并不成立。例如,下图中的有机物,有 \(3\) 种等效氢,但羧基上的氢原子,不能被氯取代,所以它的一氯代物只有 \(2\) 种。
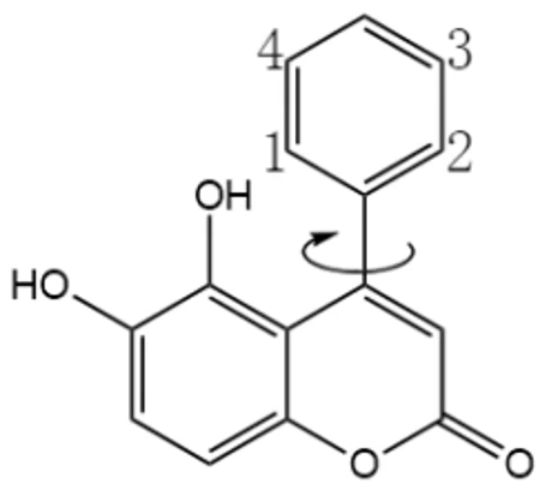
再如下图中的有机物,有 \(3\) 个等效氢,但羟基上的氢不考虑取代,所以只有 \(2\) 种一氯代物。
例题
例(2021 河北):苯并降冰片烯是一种重要的药物合成中间体,结构简式如图。关于该化合物,下列说法正确的是()
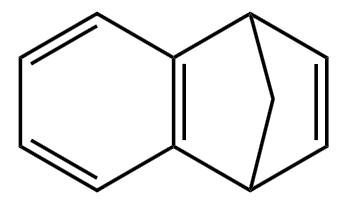
A. 是苯的同系物
B. 分子中最多 \(8\) 个碳原子共平面
C. 一氯代物有 \(6\) 种(不考虑立体异构)
D. 分子中含有 \(4\) 个碳碳双键
分析:
对于 A 选项,由于含有官能团的数目不同(比苯多了碳碳双键),或不饱和度不同,所以不是苯的同系物,A 选项错误。
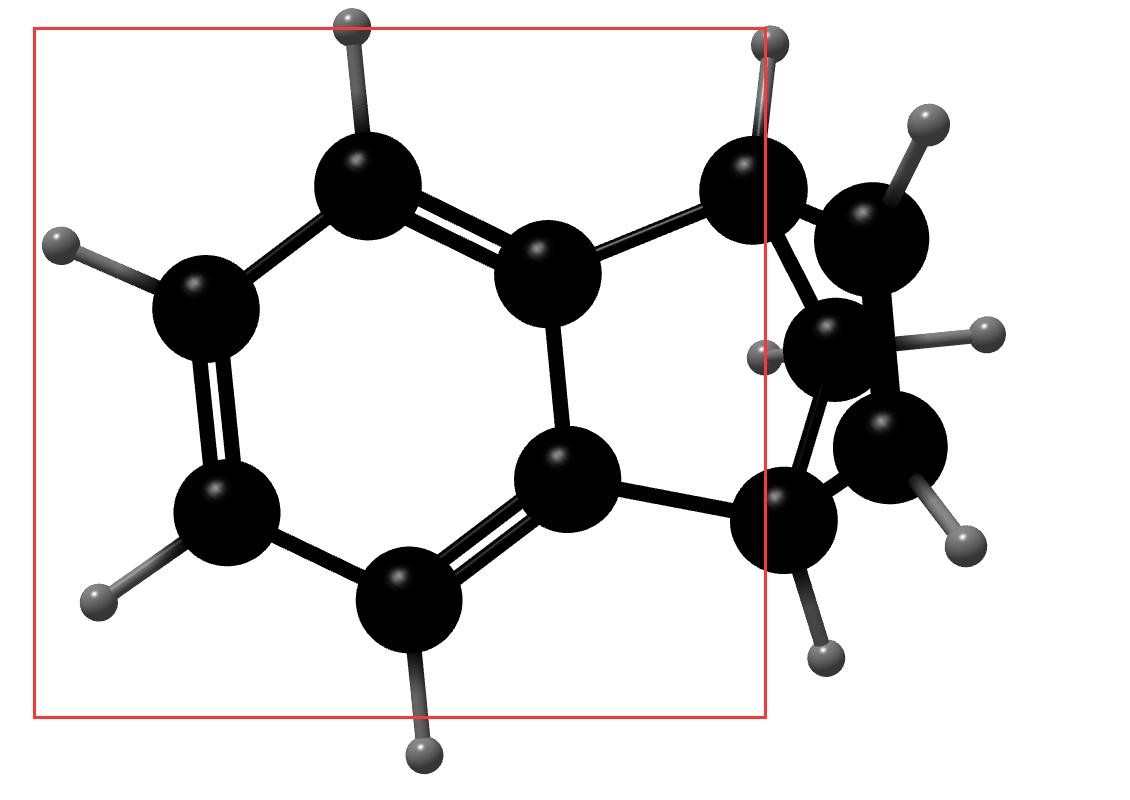
对于 B 选项,苯上的 \(6\) 个碳一定共平面,除此之外,与苯相连的两个碳一定共平面,其余不可能共平面,如下图所示(红框内共平面),B 选项正确。
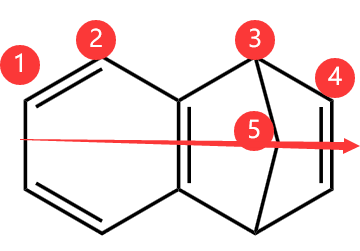
对于 C 选项,如下图,按照箭头所在直线为对称轴,等效氢有 \(5\) 种,所以有 \(5\) 种一氯代物,C 选项错误。
对于 D 选项,分子中含有一个碳碳双键和一个大 \(\pi\) 键,不是含有 \(4\) 个碳碳双键,D 选项错误。

 浙公网安备 33010602011771号
浙公网安备 33010602011771号