【文化课学习笔记】【化学】选必一:金属的腐蚀与防护
【化学】选必一:金属的腐蚀与防护
金属的腐蚀
定义
金属或合金与周围的气体或液体发生氧化还原反应而引起的损耗现象。
实质
金属原子失去电子,被氧化,即:
例如:铁的腐蚀指铁单质失去电子变成二价铁;铜腐蚀形成铜绿(碱式碳酸铜 \(\ce{Cu2(OH)2CO3}\))。
注意:电化学中铁的腐蚀一般指 \(\ce{Fe -> Fe^2+}\),被氧气氧化是 \(\ce{Fe -> Fe^3+}\)。
分类
由于与金属接触的气体或液体物质不同,发生腐蚀的情况也不同,一般可分为化学腐蚀和电化学腐蚀。
电化学腐蚀和化学腐蚀往往同时发生,但电化学腐蚀更普遍,腐蚀速率更快,危害也更严重。
化学腐蚀
定义:金属与其表面接触的一些物质(如 \(\ce{O2 、Cl2 、SO2}\) 等)直接反应而引起的腐蚀。
特点:无电流产生。
影响因素:与金属本性、接触物质的氧化性及温度有关。
电化学腐蚀
定义:不纯金属接触到电解质溶液发生原电池反应,比较活泼的金属发生氧化反应而被腐蚀。
特点:有微弱电流产生。
*钢铁的电化学腐蚀
析氢腐蚀
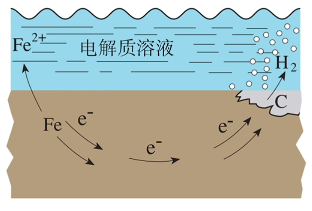
发生条件:水膜酸度较高的特殊环境(如某些工厂附近的酸性气氛)。
负极(\(\ce{Fe}\)):
正极(\(\ce{C}\)):
总反应:
吸氧腐蚀
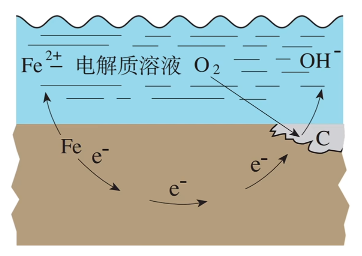
发生条件:在钢铁表面吸附的水膜酸性很弱或呈中性,但溶有一定量的氧气,此时会发生吸氧腐蚀。
负极(\(\ce{Fe}\)):
正极(\(\ce{C}\)):
总反应:
注意:电极反应不写 \(\ce{Fe(OH)2}\) 的原因是刚开始反应是溶液中的 \(\ce{OH-}\) 不够高,\(\ce{Fe^2+}\) 大多不会与 \(\ce{OH-}\) 结合。而随着反应的进行,\(\ce{Fe^2+}\) 会与 \(\ce{OH-}\) 生成 \(\ce{Fe(OH)2}\) 沉淀。
后续反应:
其中 \(\ce{Fe2O3*nH2O}\) 是铁锈的化学式。
金属的防护
改变金属材料组成
例如,铁加入铬和镍等金属,可以制成不锈钢盆、不锈钢高压锅,加入钛金属可以制成钛合金炒锅。
在金属表面覆盖保护层
例如,包裹材料、涂矿物性油脂、搪瓷、喷漆、镀铬、发蓝处理等。
电化学保护法
金属在发生电化学腐蚀时,总是作为原电池负极(阳极)的金属被腐蚀,作为正极(阴极)的金属不被腐蚀。如果能使被保护的金属称为阴极,则该金属就不易被腐蚀。
牺牲阳极法
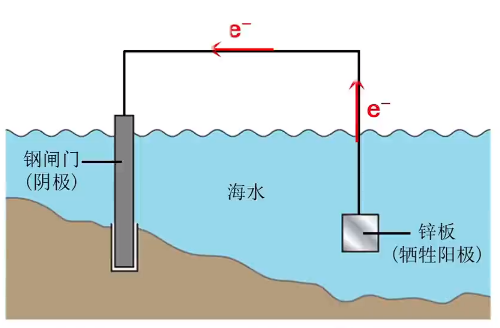
原理:原电池原理。
电极要求:被保护的金属作正极,活泼性更强的金属作负极。
应用:锅炉内壁、船舶外壳安装镁合金或锌块。
注意:
- 牺牲锌块来保护钢闸门,锌块必须定期更换。
- 如果在铁上镀锡,由于金属活动性 \(\ce{Fe > Sn}\),所以如果镀锡铁出现缺口,水膜产生直接形成原电池,铁作阳极会直接加速被腐蚀。
外加电流法
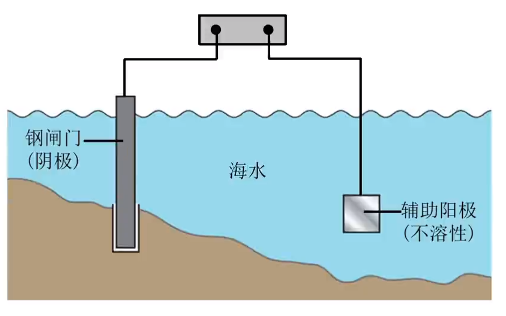
原理:电解池原理。
点击要求:被保护的金属作阴极,与电源的负极相连。
应用:钢铁闸门,地下管道连接电源负极。
金属的腐蚀与保护题型
解题技巧&注意事项
-
利用牺牲阳极,在铁上镀锌后,若镀层有破损,则将有破损的镀锌铁片直接放入到电解质溶液中会直接形成原电池,由于金属活动性 \(\ce{Zn > Fe}\),所以锌做负极,铁做正极,牺牲锌来保护铁。
-
淀粉碘化钾可以检验溶液中 \(\ce{Fe^3+}\) 的存在。根据反应:
\[\ce{2Fe^3+ + 2I- = 2Fe^2+ + I2 } \]可知若溶液中含有 \(\ce{Fe^3+}\) 则加入碘化钾后生成碘单质,遇到淀粉溶液变蓝。
-
加入铁氰化钾 \(\ce{K3[Fe(CN)6]}\) 可以验证溶液中是否存在 \(\ce{Fe^2+}\),两者反应会生成 \(\ce{KFe[Fe(CN)6]}\) 蓝色沉淀。
-
原电池不可能让化学能全部转化为电能。
-
钢铁设施在海水中腐蚀速率会比在河水中快,因为海水中含有的电解质比河水中多,电解质浓度增大会加速电子的转移速率,从而加大腐蚀速率。
-
铁棒浸润在水中,在水与空气的交界处腐蚀最快。
-
将铁氰化钾 \(\ce{K3[Fe(CN)6]}\) 直接加入到含有铁棒的溶液中,由于铁氰化钾中的铁是正三价,所以有可能直接与铁单质发生氧化还原反应生成蓝色沉淀,所以不能验证铁是否被腐蚀;应该取出少量的 \(\ce{Fe}\) 附近的溶液滴加 \(\ce{K3[Fe(CN)6]}\) 来验证铁是否被腐蚀。
-
在外加电流法中,如果铁没有被保护,那么会失去电子,使得其表面腐蚀,有微弱电流通过;外加电流后, 会保护铁不被腐蚀(氧化)从而使得铁表面腐蚀电流接近于 \(0\)。
-
若题目中涉及到惰性辅助电极,则说明该电极不会直接参与氧化反应,不会被损耗。
-
在不同的电解环境中,铁腐蚀的程度不同,所以在外加电流法中,通入的保护电流应该根据环境条件变化进行调整。


 浙公网安备 33010602011771号
浙公网安备 33010602011771号