【文化课学习笔记】【化学】选必一:电化学——电解池
【化学】选必一:电化学——电解池
基本概念
能量转化
将电能转变为化学能的装置。
电解、电镀和充电都发生在电解池上。
工作原理
- 阴极:发生还原反应,得电子,与外电源负极相接。口诀:降 得 还原 氧化剂。
- 阳极:发生氧化反应,失电子,与外电源正极相接。
- 离子移动:阴离子向阳极移动,阳离子向阴极移动。(阴阳相吸)
电解池是非自发反应,需要接外接电源/原电池,而原电池是自发反应,不需要接外接电源。
电解规律
阴极产物的判断
考虑谁「得电子」
阳离子或水中的 \(\ce{H+}\)。注意:\(\ce{H2O}\) 是在水溶液中需要考虑的,其他状态(例如熔融态)不需要考虑。
得电子的顺序(氧化性顺序)
例如:同时含有 \(\ce{Fe^2+,H+}\) 和 \(\ce{Cu^2+}\) 的溶液中,先得电子的是 \(\ce{Cu^2+}\),再是 \(\ce{H+}\),最后是 \(\ce{Fe^2+}\)。
对于 \(\ce{Fe^3+}\),在溶液中得电子会先还原为 \(\ce{Fe^2+}\),\(\ce{Fe^2+}\) 再还原成 \(\ce{Fe}\)。
对于 \(\ce{H+(酸) > H+(H2O)}\) 的理解(拿 \(\ce{Fe^2+}\) 作为中间离子举例):
- 对于 \(\ce{H2SO4}\) 和 \(\ce{FeSO4}\) 的混合溶液,此时 \(\ce{H+}\) 浓度较大,酸中的 \(\ce{H+}\) 会先得电子,\(\ce{Fe^2+}\) 再得电子。
- 对于 \(\ce{FeSO4}\) 水溶液,溶液中虽然有极少量水电离出的 \(\ce{H+}\),但依然是 \(\ce{Fe^2+}\) 先得电子,水中的 \(\ce{H+}\) 再得电子。
若是电解水溶液中的 \(\ce{K+/Ca^2+/Na+/Mg^2+/Al^3+}\),等同电解水(即其中水的 \(\ce{H+}\) 得电子最多,其他可忽略不计)。
此时的电极方程式为:
这就是「放氢生碱」的化学方程式。
阳极产物的判断
考虑谁「失电子」
阴离子或水中的 \(\ce{OH-}\) 或电极材料。
原则:一般情况下,优先考虑电极材料。
若是活性电极(除 \(\ce{Pt,Au}\) 和石墨外):则金属单质失电子。
若是惰性电极(\(\ce{Pt,Au}\) 和石墨):电极材料只导电,不反应。
失电子顺序(还原性顺序)
主要是对于惰性电极而言 。
口诀:留(硫)点(碘)铁生锈长氯锰(毛)。电解池中一般不考虑锰离子。
若是电解最高价含氧酸根(\(\ce{NO3-,SO4^2-,ClO4-,PO4^3-,MnO4-}\) 等),等同电解水。
此时的电极方程式为:
这就是「放氧生酸」的方程式。
有关电解水:
阳极是「放氧生酸」,方程式:
\[\ce{2H2O - 4e- = O2 ^ + 4H+} \]阴极是「放氢生碱」,方程式:
\[\ce{2H2O + 2e- = H2 ^ + 2OH-} \]口诀:「负氢正氧」或「阴氢阳氧」。理解:负极电解水生成氧气,阴极电解水生成氢气。
惰性电极电解电解质溶液的四大类型
电解水型
总的电解反应式都是电解水方程式的类型。
\(\ce{H2SO4}\) 溶液
阴极可以得电子的有酸电离的 \(\ce{H+}\) 和水电离的 \(\ce{H+}\),根据优先顺序可知,此处以酸电离出的 \(\ce{H+}\) 得电子为主。
阴极反应式:
阳极可以失电子的有阴离子 \(\ce{SO4^-}\) 和水电离的 \(\ce{OH-}\),由于 \(\ce{SO4^2-}\) 属于最高价含氧酸根,所以其失电子可忽略不计。所以整体上相当于以水电离出的 \(\ce{OH-}\) 失电子为主。
阳极反应式:
将阴阳极反应式合并得到电解方程式:
\(\ce{NaOH}\) 溶液
阴极可以得电子的有阳离子 \(\ce{Na+}\) 和水电离的 \(\ce{H+}\),由于电解 \(\ce{Na+}\) 等同电解水,所以相当于水电离的 \(\ce{H+}\) 得电子。
阴极反应式:
阳极可以失电子的有 \(\ce{NaOH}\) 电离的 \(\ce{OH-}\) 和水电离的 \(\ce{OH-}\),水电离的 \(\ce{OH-}\) 很少,所以主要以 \(\ce{NaOH}\) 电离的 \(\ce{OH-}\) 失电子为主。
阳极反应式:
将阴阳极反应式合并得到电解方程式:
\(\ce{KNO3}\) 溶液
阴极可以得电子的有阳离子 \(\ce{K+}\) 和水电离的 \(\ce{H+}\),由于电离 \(\ce{K+}\) 等同电解水,所以相当于水电离的 \(\ce{H+}\) 得电子。
阴极反应式:
阳极可以失电子的有阴离子 \(\ce{NO3^2-}\) 和水电离的 \(\ce{OH-}\),由于 \(\ce{NO3^2-}\) 属于最高价含氧酸根,所以其失电子可忽略不计。所以整体上相当于以水电离出的 \(\ce{OH-}\) 失电子为主。
阳极反应式:
将阴阳极反应式合并得到电解方程式:
总结
电解带有最高价含氧酸根的酸, 其总的电解方程式等价于电解水。
电解大部分强酸,其总的电解方程式也等价于电解水。
电解对象
水。
浓度变化
电解水使得水的含量减少,电解质溶液中溶质浓度增大。
\(\ce{pH}\) 变化
电解质是酸性,电解后 \(\ce{pH}\) 减小。
电解质是碱性,电解后 \(\ce{pH}\) 增大。
电解质是中性,电解后 \(\ce{pH}\) 不变。
恢复电解质溶液所加物质
由于水被电解,所以应该加水。
电解电解质型
电解质本身被消耗的类型。
\(\ce{HCl}\) 溶液
同理 \(\ce{H2SO4}\) 溶液可知,阴极反应式为:
阳极可以失电子的有阴离子 \(\ce{Cl-}\) 和 \(\ce{H2O}\) 电离的 \(\ce{OH-}\),主要以 \(\ce{Cl-}\) 失电子为主。
阳极反应式:
将阴阳极反应式合并得到电解方程式:
\(\ce{CuBr2}\) 溶液
阴极可以得电子的有阳离子 \(\ce{Cu^2+}\) 和水电离的 \(\ce{H+}\),主要以 \(\ce{Cu^2+}\) 得电子为主。
阴极反应式:
同理 \(\ce{HCl}\) 溶液可知,阳极反应式为:
将阴阳极反应式合并得到电解方程式:
电解对象
对应电解质。
浓度变化
对应电解质浓度降低。
\(\ce{pH}\) 变化
酸性电解质溶液 \(\ce{pH}\) 升高。
碱性电解质溶液 \(\ce{pH}\) 降低。
中性电解质溶液 \(\ce{pH}\) 不变。
恢复电解质溶液所加物质
对应电解质。
*放氢生碱型
\(\ce{NaCl}\) 溶液
同理 \(\ce{NaOH}\) 溶液可知,阴极反应式:
同理 \(\ce{HCl}\) 溶液可知,阳极反应式:
电解方程式:
电解对象:\(\ce{NaCl}\) 和 \(\ce{H2O}\)。更加严谨的说,应该是 \(\ce{NaCl}\) 中的 \(\ce{Cl-}\) 和 \(\ce{H2O}\) 电离的 \(\ce{H+}\)。
浓度变化:\(c(\ce{NaOH})\) 增加。
\(\ce{pH}\) 变化:\(\ce{pH}\) 增大。
恢复电解质溶液所加物质:根据电解方程式,相当于 \(\ce{H:Cl}\) 按照 \(\ce{1:1}\) 离开溶液,所以应该加入 \(\ce{HCl}\) 恢复电解质溶液。
*放氧生酸型
\(\ce{CuSO4}\) 溶液
同理 \(\ce{CuBr2}\) 溶液可知,阴极方程式为:
同理 \(\ce{H2SO4}\) 溶液可知,阳极方程式为:
电解方程式:
电解对象:\(\ce{CuSO4}\) 和 \(\ce{H2O}\)。更严谨的说,应该 \(\ce{CuSO4}\) 中的 \(\ce{Cu^2+}\) 和 \(\ce{H2O}\) 电离出的 \(\ce{H+}\)。
浓度变化:\(c(\ce{H2SO4})\) 增加。
\(\ce{pH}\) 变化:\(\ce{pH}\) 降低。
恢复电解质溶液所加物质:
根据电解方程式,相当于 \(\ce{Cu:O}\) 两种原子按照 \(1:1\) 离开溶液,所以应该加入 \(\ce{CuO}\) 恢复电解质溶液。
注意:
- 加入 \(\ce{CuCO3}\) 是可以的,其可以拆解成 \(\ce{CuO}\) 和 \(\ce{CO2}\),遇到酸会直接反应生成 \(\ce{CO2}\) 离开溶液。
- 不能加入 \(\ce{Cu(OH)2}\),会多引入氢原子和氧原子。
电解的应用
*氯碱工业
前置知识——粗盐提纯:
在含有 \(\ce{MgCl2}\) 和 \(\ce{CaCl2}\) 的粗盐中提纯 \(\ce{NaCl}\):
先加入过量 \(\ce{NaOH}\),使得 \(\ce{Mg^2+}\) 沉淀;再加入过量 \(\ce{BaCl2}\) 使得 \(\ce{SO4^2-}\) 沉淀;最后加入过量 \(\ce{Na2CO3}\) 使得 \(\ce{Ca^2+}\) 沉淀。最后加入适量盐酸,除去过量的 \(\ce{NaOH}\) 和 \(\ce{Na2CO3}\)。最后可以得到精致饱和 \(\ce{NaCl}\) 溶液。
注意 \(\ce{BaCl2}\) 必须在 \(\ce{Na2CO3}\) 之前加入。
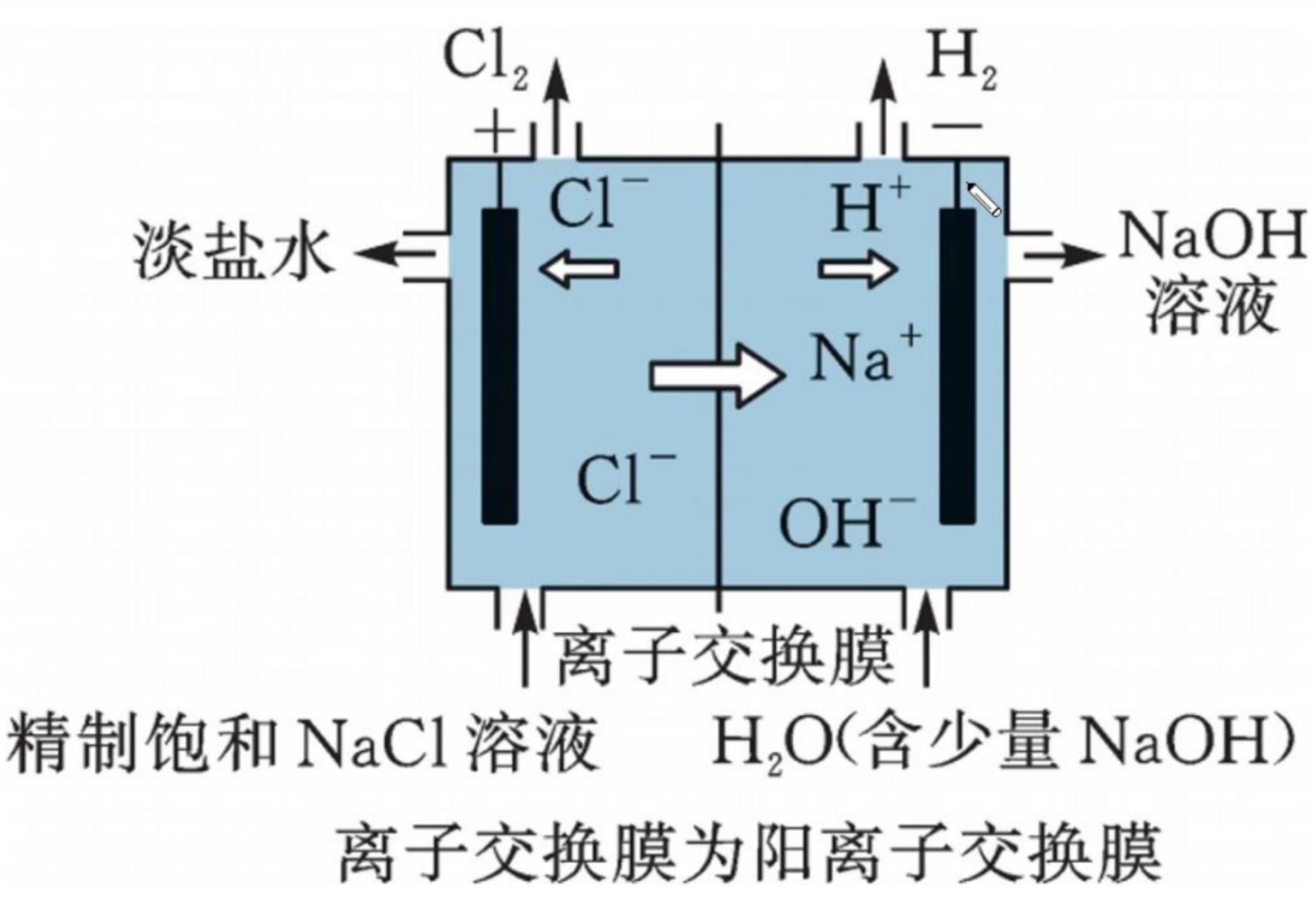
阳极反应式:
阴极反应式:
注意:虽然水溶液中含有少量 \(\ce{NaOH}\),但由于其碱含量不足,所以失电子的主要还是水电离的 \(\ce{OH-}\)。
总电解方程式:
注意:这里的「离子交换膜」只能用阳离子交换膜,即只能让 \(\ce{Na+}\) 向阴极移动。不能用阴离子交换膜,如果使用阴离子交换膜,会使得 \(\ce{OH-}\) 向阳极移动,\(\ce{Cl-}\) 会直接跟 \(\ce{OH-}\) 发生歧化反应,\(\ce{Cl-}\) 就不能失电子产生 \(\ce{Cl2}\) 了。如果需要得到 \(\ce{HClO}\) 可以使用阴离子交换膜。
所以「离子交换膜」的类型与装置的目的有关。
电镀
以用铁做「待镀金属」,铜做「镀层金属」为例。
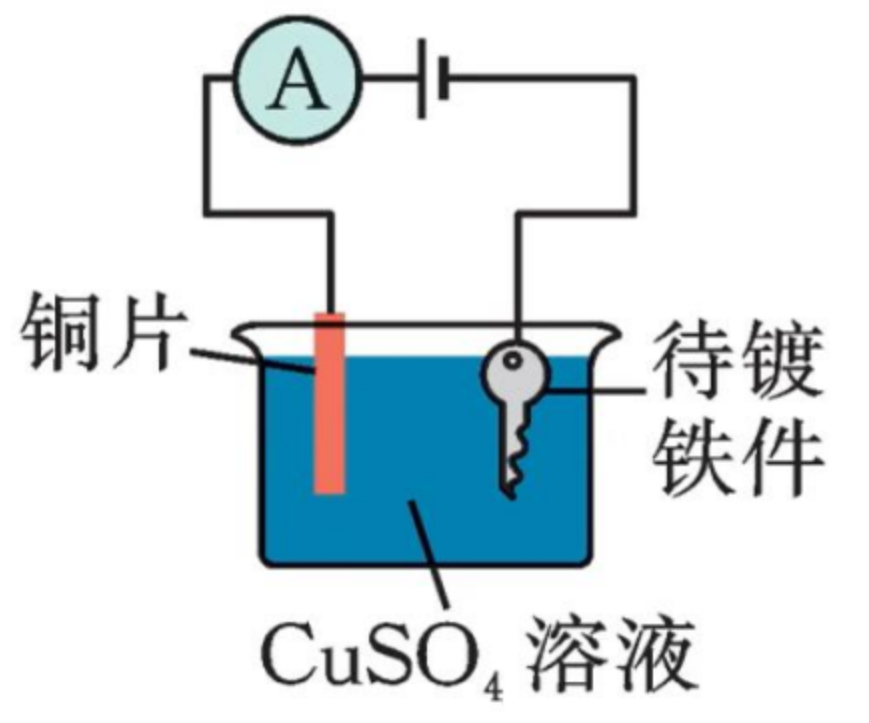
【阴阳极】
待镀金属作阴极,镀层金属作阳极,用含镀层金属离子的电解质溶液作电镀液。
口诀:阳镀阴被镀。
【特点】
一增:阴极质量增加。
一碱:阳极质量减少。
一不变:电解质溶液浓度不变(不考虑水的挥发)。
且阴极增加的质量与阳极减少的质量相等。
电解精炼铜
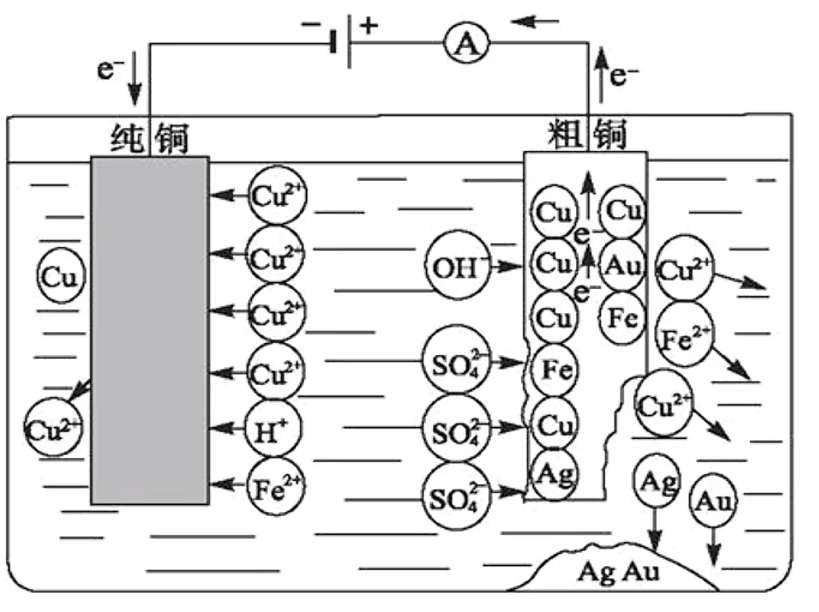
【目的】提纯粗铜。
【电极材料】阳极为粗通,阴极为纯铜。口诀:阴纯阳粗。
【电解质溶液】含 \(\ce{Cu^2+}\) 的盐溶液,如 \(\ce{CuSO4}\)。
【阴阳极反应】
阳极:
第一阶段:
第二阶段:
注意:
- 阳极减少的质量,不是只有 \(\ce{Cu}\),还有 \(\ce{Zn,Fe}\) 等。
- 阳极的铜溶解之后,比铜更不活泼的 \(\ce{Ag,Au}\) 等金属就会再阳极形成沉积,我们称它为「阳极泥」。
阴极:
电冶金
| 阴极 | 阳极 | 总反应 | |
|---|---|---|---|
| 冶炼钠 | \(\ce{2Na+ + 2e- = 2Na}\) | \(\ce{2Cl- - 2e- = Cl2 ^}\) | \(\ce{2NaCl(熔融) \xlongequal{电解} 2Na + Cl2 ^}\) |
| 冶炼镁 | \(\ce{Mg^2+ + 2e- = Mg}\) | \(\ce{2Cl- - 2e- = Cl2 ^}\) | \(\ce{MgCl2(熔融) \xlongequal{电解} Mg + Cl2 ^}\) |
| 冶炼铝 | \(\ce{Al^3+ + 3e- = Al}\) | \(\ce{2O^2- - 4e- = O2 ^}\) | \(\ce{2Al2O3(熔融) \xlongequal[冰晶石]{电解} 4Al + 3O2 ^}\) |
注意:
- 冶炼钠和冶炼镁必须是熔融状态下的 \(\ce{NaCl}\) 和 \(\ce{MgCl2}\),如果是水溶液,\(\ce{Na+}\) 无法在水中得电子得到钠单质。
- 不能通过熔融状态下的 \(\ce{AlCl3}\) 来冶炼铝,因为共价化合物熔融态不导电。
- 主要选择氯化物来冶炼金属是因为氯化物成本较低。
- 冰晶石的化学式是 \(\ce{Na3AlFe6}\)。
电解池电极判断
| 与外接电源的接法 | 电极反应 | 电子流向 | 离子移向 | |
|---|---|---|---|---|
| 阳极 | 与外接电源正极相连 | 氧化反应 | 流出 | 阴离子移向 |
| 阴极 | 与外接电源负极相连 | 还原反应 | 流入 | 阳离子移向 |
口诀:「阴阳相吸」,即阴离子移向阳极,阳离子移向阴极。
判断技巧:
-
阴极的电极反应与阴极的电极材料无关,但阳极的电极反应必须优先考虑电极材料,若为活性电极,则金属电极本身失去电子;若为惰性电极(如 \(\ce{Pt,Au}\) 和石墨等),则电极只导电,不反应。书写电解池的电极反应式时,一定要优先看阳极的电极材料。
-
若题目已经给出反应物与生成物信息,则按照「阳极、氧化、化合价升高,阴极、还原、化合价降低」确定阴阳极的放电物质。
-
电解水溶液中的 \(\ce{K+,Ca^2+,Na+,Mg^2+,Al^3+}\) 等,阴极的电极反应等同于电解水:
\[\ce{2H2O + 2e- = H2 ^ + 2OH-} \]即「放氢生碱」,化学计量数:2 2 1 2。
若用惰性电极电解水溶液中的 \(\ce{SO4^2-,NO3-,ClO4-}\) 等最高价含氧酸根离子,阳极的电极反应等同于电解水:
\[\ce{2H2O - 4e- = O2 ^ + 4H+} \]即「放氧生酸」,化学计量数:2 4 1 4。
电解池电极反应式书写
第一步
根据题目信息写出电极反应式「架构」。
阳极:
阴极:
通过化合价变化确认得失电子数,并且需要先搞定「变价元素的原子守恒」。
第二步
调平电荷:
酸性溶液用 \(\ce{H+}\)、碱性溶液用 \(\ce{OH-}\)、熔融碳酸盐用 \(\ce{CO3^2-}\)、氧化物电解质用 \(\ce{O^2-}\)、锂离子用 \(\ce{Li+}\) 等,按照题目灵活调整。
第三步
配平:
水溶液电解质:看 \(\ce{H}\) 补 \(\ce{H2O}\),用 \(\ce{O}\) 检查;
熔融碳酸盐:看 \(\ce{C}\) 补 \(\ce{CO2}\).
按照题目灵活调整。
示例
以熔融电解池捕获二氧化碳的装置为例。
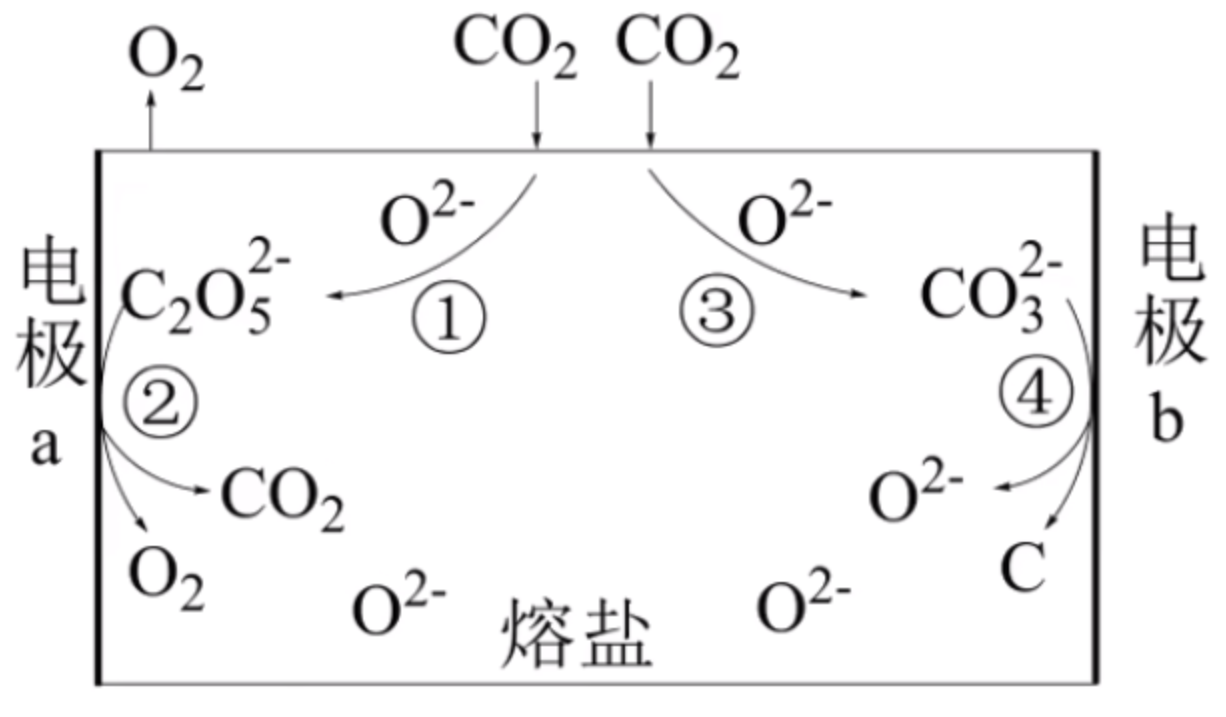
由于 \(\ce{CO3^2-}\) 失电子变成 \(\ce{C}\),\(\ce{C2O5^2-}\) 得电子变成 \(\ce{CO2}\),所以电极 \(a\) 是阳极,电极 \(b\) 是阴极。
阴极反应式:
阳极反应式:
例题
用惰性电极电解硝酸工业的尾气 \(\ce{NO}\) 可制备 \(\ce{NH4NO3}\),其工作原理如图所示。
为使电解产物全部转化为 \(\ce{NH4NO3}\),需向电解产物中补充适量 \(\ce{NH3}\)。
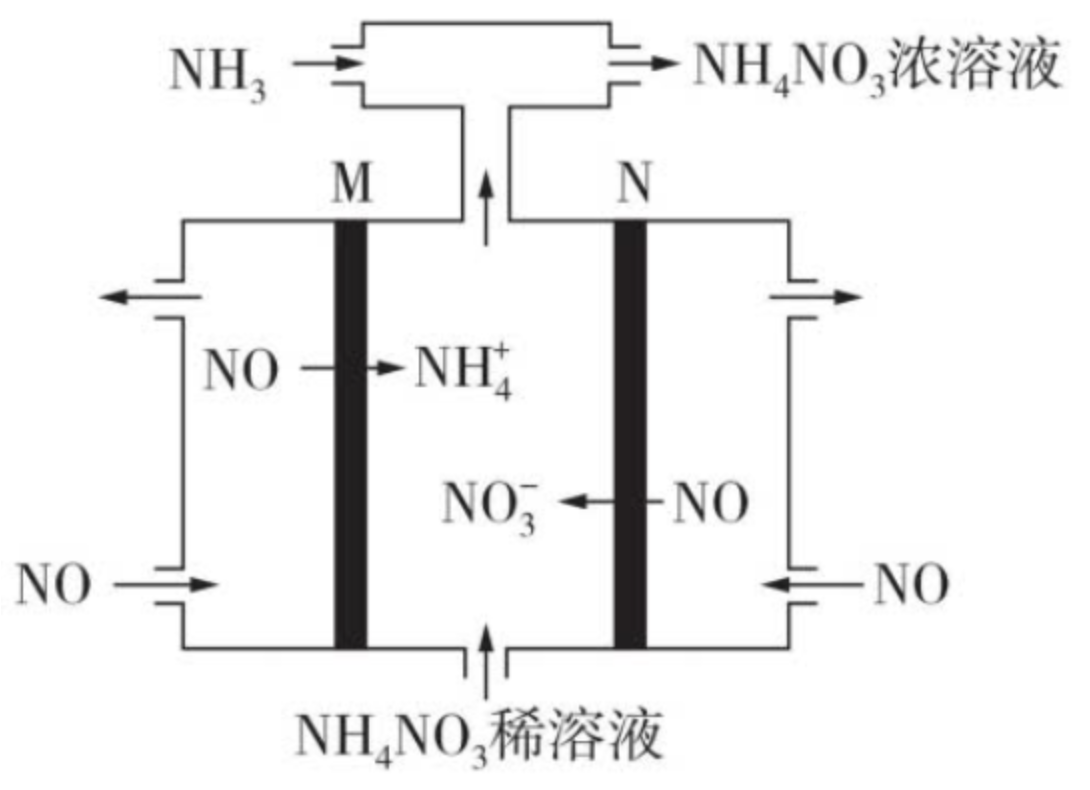
当实际参加反应的 \(\ce{NO}\) 为 \(\pu{8 mol}\) 时,要将电解产生的硝酸全部转化为硝酸铵,还应至少通入多少 \(\pu{mol}\) \(\ce{NH3}\)?
分析:
一般此类计算题需要通过总的电解反应方程式配合「关系式关系量」求解。
阴极反应式:
阳极反应式:
合并得到总电解方程式为:
根据 \(\ce{8 NO \sim 2HNO3 \sim 2NH3}\) 可知,需要通入 \(\ce{2 mol NH3}\)。
电解池题型强化
解题技巧
- 一般题目中有外接电源就说明是电解池,「通入一定电流」等字眼说明要从电解池角度考虑。
- 海水中主要含有的离子:\(\ce{Na+、Cl-、Mg^2+}\) 等。
- 涉及到有关电解过程中某离子量的变化问题(包含 \(\ce{pH}\) 变化问题),可以考虑根据等物质的量电子的转移时,阴阳极对应离子量的变化来判断。
- 有机反应中,加 \(\ce{H}\) 或去 \(\ce{O}\) 发生还原反应。
- 求电解过程中产生某气体的体积,必须知道温度压强。只有在标况下,\(\pu{1mol}\) 气体的体积才是 \(\pu{22.4 L}\)。
- 涉及到离子交换膜通过离子的问题,需要考虑电解池的目的,通过电解目的分析反应。
- 去离子水发生电解等同于电解水。
例题
例 1(2022 广东):以熔融盐为电解液,以含 \(\ce{Cu、Mg}\) 和 \(\ce{Si}\) 等的铝合金废料为阳极进行电解,实现 \(\ce{Al}\) 的再生。该过程中()
A. 阴极发生的反应为 \(\ce{Mg - 2e- = Mg^2+}\)
B. 阴极上 \(\ce{Al}\) 被氧化
C. 在电解槽底部产生含 \(\ce{Cu}\) 的阳极泥
D. 阳极和阴极的质量变化相等
分析:
首先考虑整个流程,阳极含有 \(\ce{Cu、Mg}\) 等各种杂质,由于单质还原性:
离子还原性:
所以 \(\ce{Mg}\) 会优先于 \(\ce{Al^3+}\) 在阳极溶解,但由于氧化性 \(\ce{Mg^2+ < Al^3+}\) 所以可以控制电解环境,使得 \(\ce{Al^3+}\) 被还原,但 \(\ce{Mg^2+}\) 不还原。
\(\ce{Cu^2+}\) 氧化性高于 \(\ce{Al^3+}\),所以溶液中的 \(\ce{Cu^2+}\) 会优先于 \(\ce{Al^3+}\) 在阴极还原,为了只让 \(\ce{Al^3+}\) 还原,应该控制电解环境使得 \(\ce{Cu}\) 在阳极始终不溶解。
- A 选项:只有阳极才会失电子,A 错误。
- B 选项:阴极上 \(\ce{Al}\) 被还原,B 错误。
- C 选项:由于 \(\ce{Cu}\) 在阳极上始终没有溶解,所以最后在电解槽底部会产生含 \(\ce{Cu}\) 的阳极泥,C 正确。
- D 选项:由于阳极上 \(\ce{Mg}\) 和 \(\ce{Al}\) 都溶解,但阴极上只有 \(\ce{Al^3+}\) 被还原为 \(\ce{Al}\),所以阴阳极质量变化不相等,D 错误。
例 2(2021 全国乙)沿海电厂采用海水为冷却水,但在排水管中生物的附着和滋生会阻碍冷却水排放并降低冷却效率。为解决这一问题,通常在管道口设置一对惰性电极(如图所示),通入一定的电流。下列叙述错误的是()
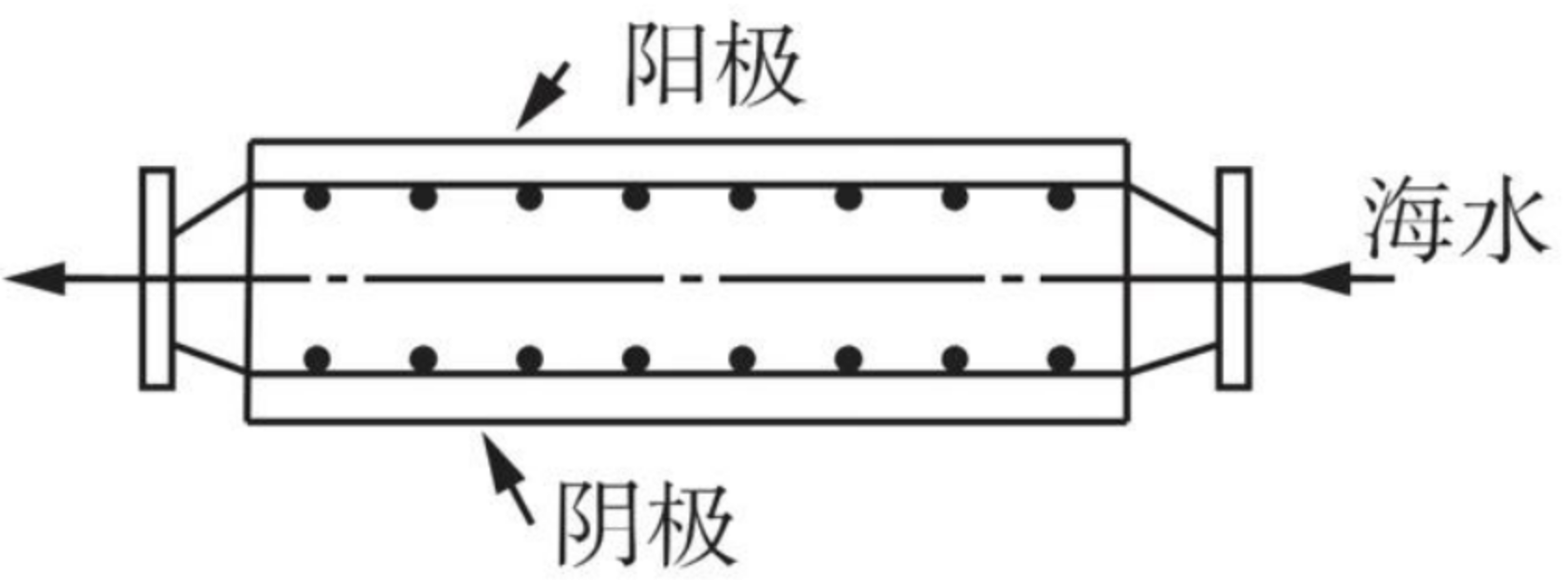
A. 阳极发生将海水中的 \(\ce{Cl-}\) 氧化生成 \(\ce{Cl2}\) 的反应
B. 管道中可以生成氧化灭杀附着生物的 \(\ce{NaClO}\)
C. 阴极生成的 \(\ce{H2}\) 应及时通风稀释安全地排入大气
D. 阳极表面形成的 \(\ce{Mg(OH)2}\) 等积垢需要定期清理
分析:
海水中主要的离子有 \(\ce{Cl- 、Na+、Mg^2+}\),具体分析如下:
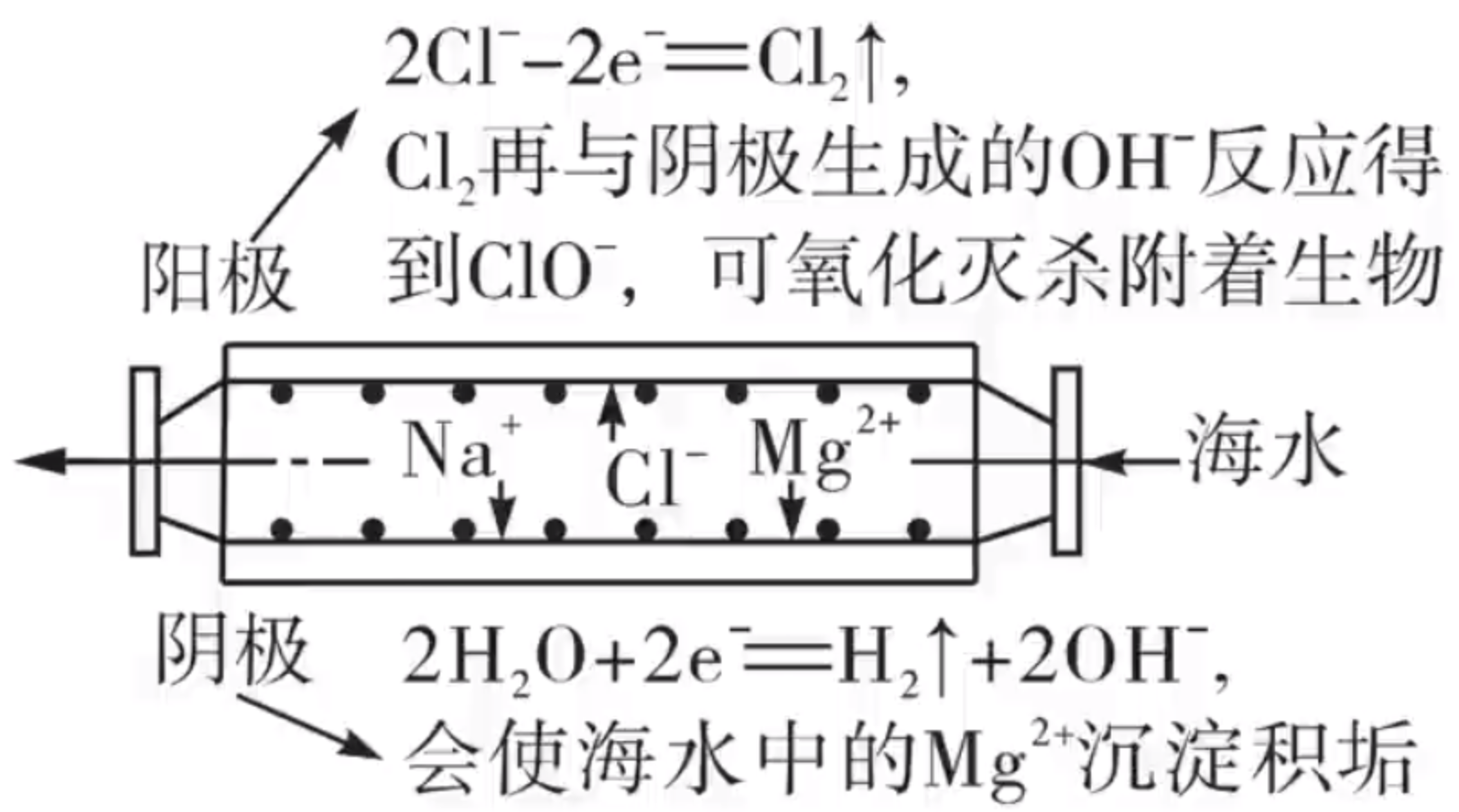
生成的 \(\ce{Cl2}\) 与 \(\ce{OH-}\) 反应:
也可以视为:
-
A 选项:根据上图可以看出 A 正确。
-
B 选项:根据上述方程可知 B 正确。
-
C 选项:该装置是密闭装置,氢气过量会爆炸,所以 C 选项正确。
-
D 选项:阴极产生的 \(\ce{OH-}\) 与海水中的 \(\ce{Mg^2+}\) 结合生成 \(\ce{Mg(OH)2}\),不是阳极,所以 D 错误。
例 3(2021 辽宁)利用有机物 \(\ce{Q}\) 和 \(\ce{QH2}\) 电解转化法从烟气中分离 \(\ce{CO2}\) 的原理如图,已知气体可选择通过膜电极,溶液不能通过,下列说法错误的是()
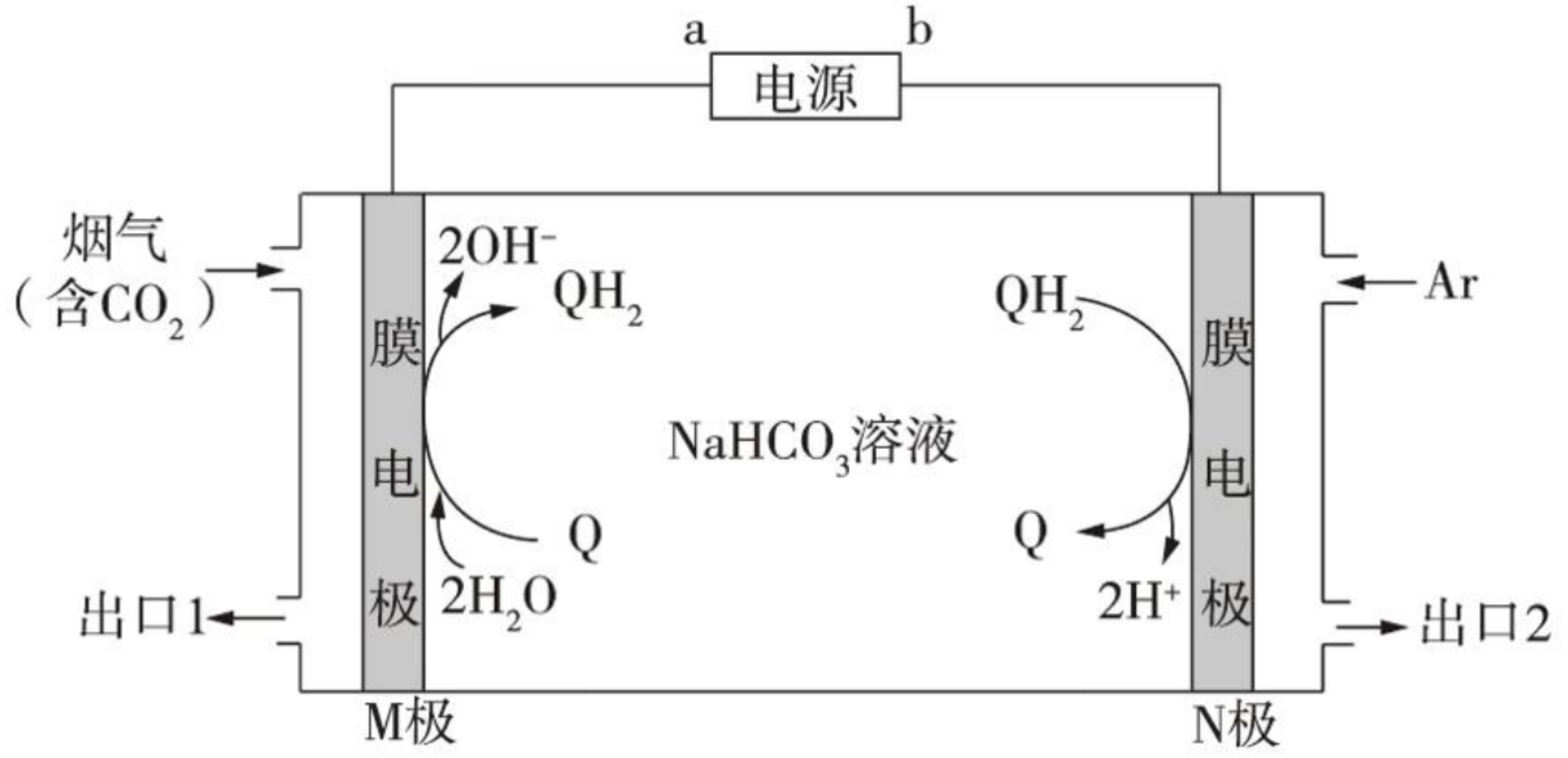
A. \(a\) 为电源负极
B. 溶液中 \(\ce{Q}\) 的物质的量保持不变。
C. \(\ce{CO2}\) 在 \(\mathrm{M}\) 极被还原
D. 分离出的 \(\ce{CO2}\) 从出口 \(2\) 排除。
其 他选项容易判断,这里只分析 C D 中涉及 \(\ce{CO2}\) 的分离过程。
有下图分析:
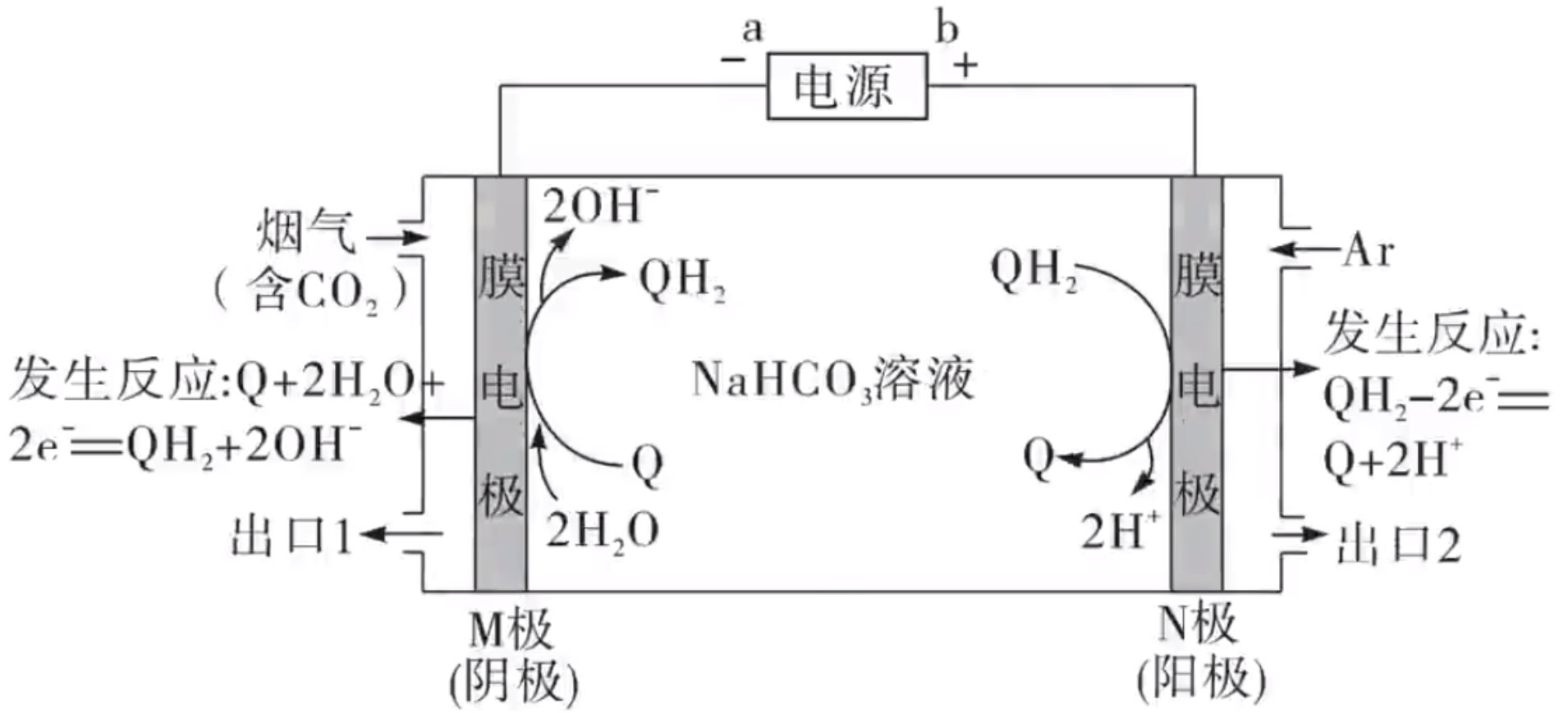
当含有 \(\ce{CO2}\) 的烟气从右侧入口进入时,会通过膜电极,与阴极的 \(\ce{OH-}\) 反应,生成 \(\ce{HCO3-}\),根据「阴阳相吸」,\(\ce{HCO3-}\) 离子向右移动会与阳极的 \(\ce{H+}\) 反应,生成 \(\ce{CO2}\) 和 \(\ce{H2O}\),所以 \(\ce{CO2}\) 没有被还原,对应分离出的 \(\ce{CO2}\) 会从出口 \(2\) 排出。
例 4(2022 浙江 6 月选考)通过电解废旧锂电池中的 \(\ce{LiMn2O4}\) 可获得难溶性的 \(\ce{Li2CO3}\) 和 \(\ce{MnO2}\),电解示意图如下(其中滤布的作用时阻挡固体颗粒,但离子可自由通过。电解过程中溶液的体积变化忽略不计)。下列说法不正确的是()
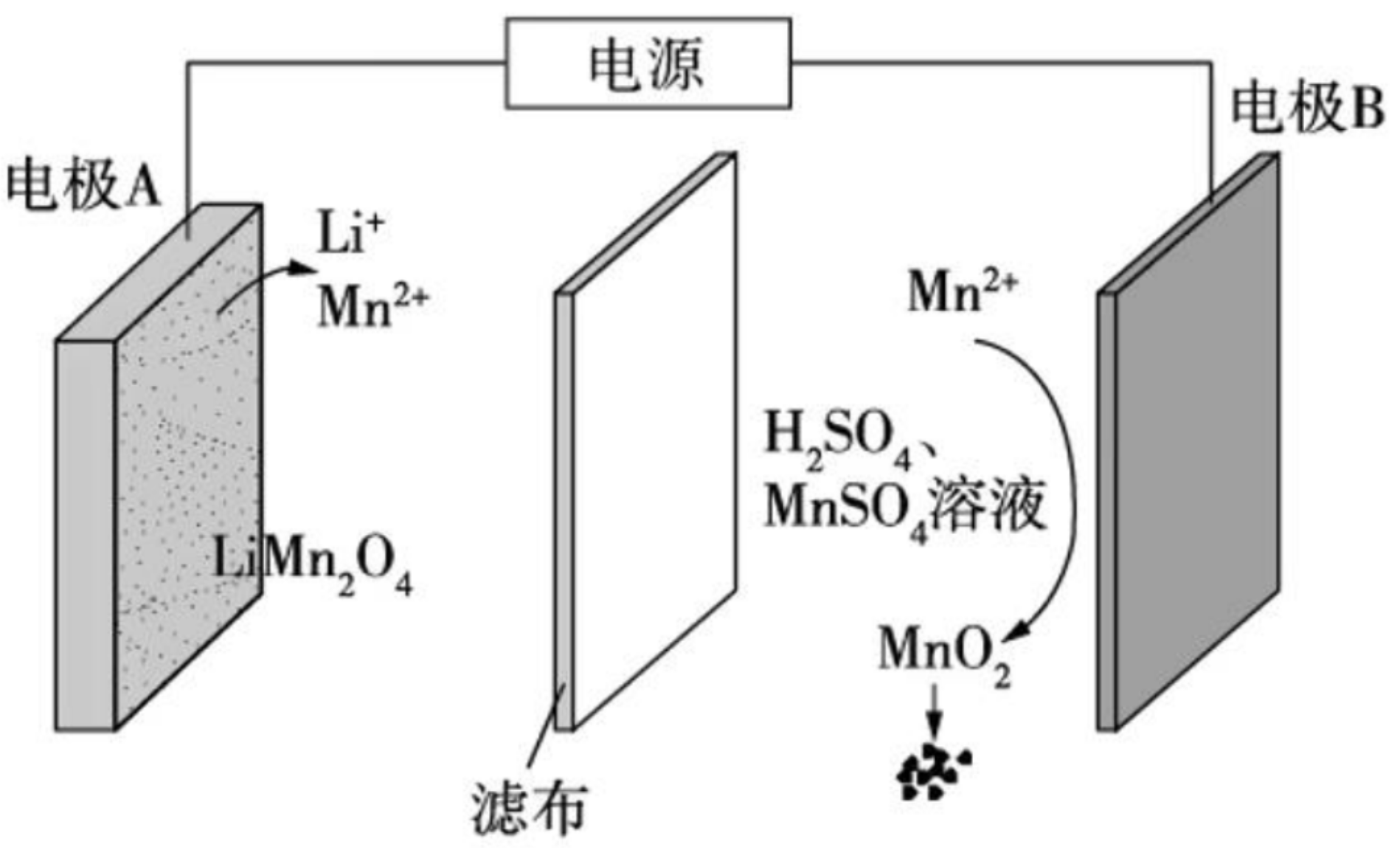
A. 电极 \(\mathrm{A}\) 为阴极,发生还原反应
B. 电极 \(\mathrm{B}\) 的电极反应:\(\ce{2H2O + Mn^2+ - 2e- = MnO2 + 4H+}\)
C. 电解一段时间后溶液中 \(\ce{Mn^2+}\) 浓度保持不变
D. 电解结束,可通过调节 \(\ce{pH}\) 除去 \(\ce{Mn^2+}\),再加入 \(\ce{Na2CO3}\) 溶液以获得 \(\ce{Li2CO3}\)。
分析:
根据对应离子前后价态变化可知:电极 \(\mathrm{A}\) 为阴极,电极 \(\mathrm{B}\) 为阳极。
阳极反应式:
由于在 \(\ce{H2SO4}\) 溶液中,所以阳极反应式应该用 \(\ce{H+}\) 调平电荷。这里的沉淀符号可以不写。
阴极反应式:
由于 \(\ce{Mn(OH)2}\) 是白色沉淀,所以 \(\ce{Mn^2+}\) 不能与 \(\ce{OH-}\) 在溶液中大量共存,所以应该用 \(\ce{H+}\) 调平电荷。
这里反应物中 \(\ce{H+}\) 是从阳极反应生成经过滤布(离子交换膜)到阴极的。
- A 选项:根据上述分析可知 A 正确。
- B 选项:根据上述分析可知 B 正确。
- C 选项:阴极生成 \(\ce{2Mn^2+}\) 转移 \(\ce{3 e-}\),阳极消耗 \(\ce{Mn^2+}\) 转移 \(\ce{2e-}\),所以转移等量电子,\(\ce{Mn^2+}\) 离子的量增加,C 错误。
- D 选项:可通过增加溶液中的 \(c(\ce{H+})\) 使得 \(\ce{Mn^2+}\) 沉淀为 \(\ce{Mn(OH)2}\);再加入 \(\ce{Na2CO3}\) 就可以使得 \(\ce{Li+}\) 变为 \(\ce{Li2CO3}\) 沉淀,D 正确。
例 5(2021 湖北)\(\ce{Na2Cr2O7}\) 的酸性水溶液随着 \(\ce{H+}\) 浓度的增大会转化为 \(\ce{CrO3}\)。电解法制备 \(\ce{CrO3}\) 的原理如图所示。下列说法错误的是()
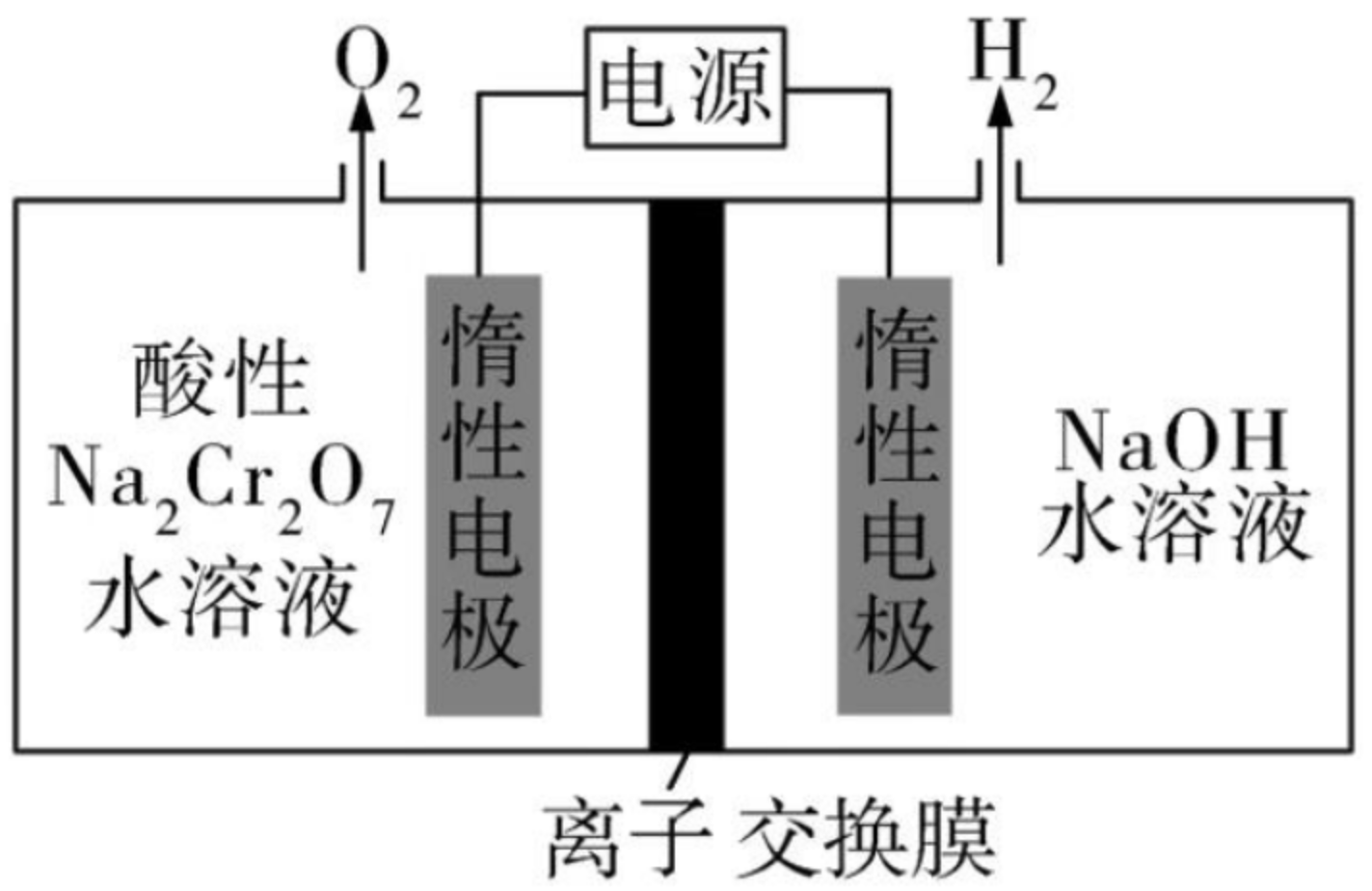
A. 电解时只允许 \(\ce{H+}\) 通过离子交换膜
B. 生成 \(\ce{O2}\) 和 \(\ce{H2}\) 的质量比是 \(8:1\)
C. 电解一段时间后阴极区溶液 \(\ce{OH-}\) 的浓度增大
D. \(\ce{CrO3}\) 的生成反应为 \(\ce{Cr2O7^2- + 2H+ = 2CrO3 + H2O}\)
分析:
由于 \(\ce{NaOH}\) 和 \(\ce{Na2Cr2O7}\) 水溶液的电解反应相当于电解水,且根据「负氢正氧」可知,左边是阳极,右边是阴极。
所以阴极的电解反应式是「放氢生碱」,阳极的电解反应式是「放氧生酸」。
- A 选项:根据题意可知,阳极会生成 \(\ce{H+}\),从而使得阳极水溶液 \(c(\ce{H+})\) 增大转化为 \(\ce{CrO3}\)。根据「阴阳相吸」,若 \(\ce{H+}\) 通过离子交换膜,会达到阴极,从而使得阳极水溶液 \(c(\ce{H+})\) 减小,不能达到目的,A 错误。
- B 选项:电解池总的电解方程式为 \(\ce{2H2O \xlongequal{电解} 2H2 ^ + O2 ^}\),所以生成的 \(n(\ce{O2}) : n(\ce{H2}) = 8:1\),所以 \(m(\ce{O2}) : m(\ce{H2}) = 1\times 32 : 2 \times 2 = 8:1\),B 正确。
- C 选项:由于阴极「放氢生碱」,所以 C 正确。
- D 选项:根据上述分析写出方程式调平电荷可知,D 正确。
例 6(2019 全国 II)环戊二烯(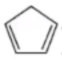 )是重要的有机化工材料,广泛用于农药、橡胶、塑料等生产。环戊二烯可用于制备二茂铁[\(\ce{Fe(C5H5)2}\),结构简式为
)是重要的有机化工材料,广泛用于农药、橡胶、塑料等生产。环戊二烯可用于制备二茂铁[\(\ce{Fe(C5H5)2}\),结构简式为  ],后者广泛应用于航天,化工等领域中。二茂铁的电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的 \(\ce{DMF}\) 溶液(\(\ce{DMF}\) 为惰性有机溶剂)。
],后者广泛应用于航天,化工等领域中。二茂铁的电化学制备原理如图所示,其中电解液为溶解有溴化钠(电解质)和环戊二烯的 \(\ce{DMF}\) 溶液(\(\ce{DMF}\) 为惰性有机溶剂)。
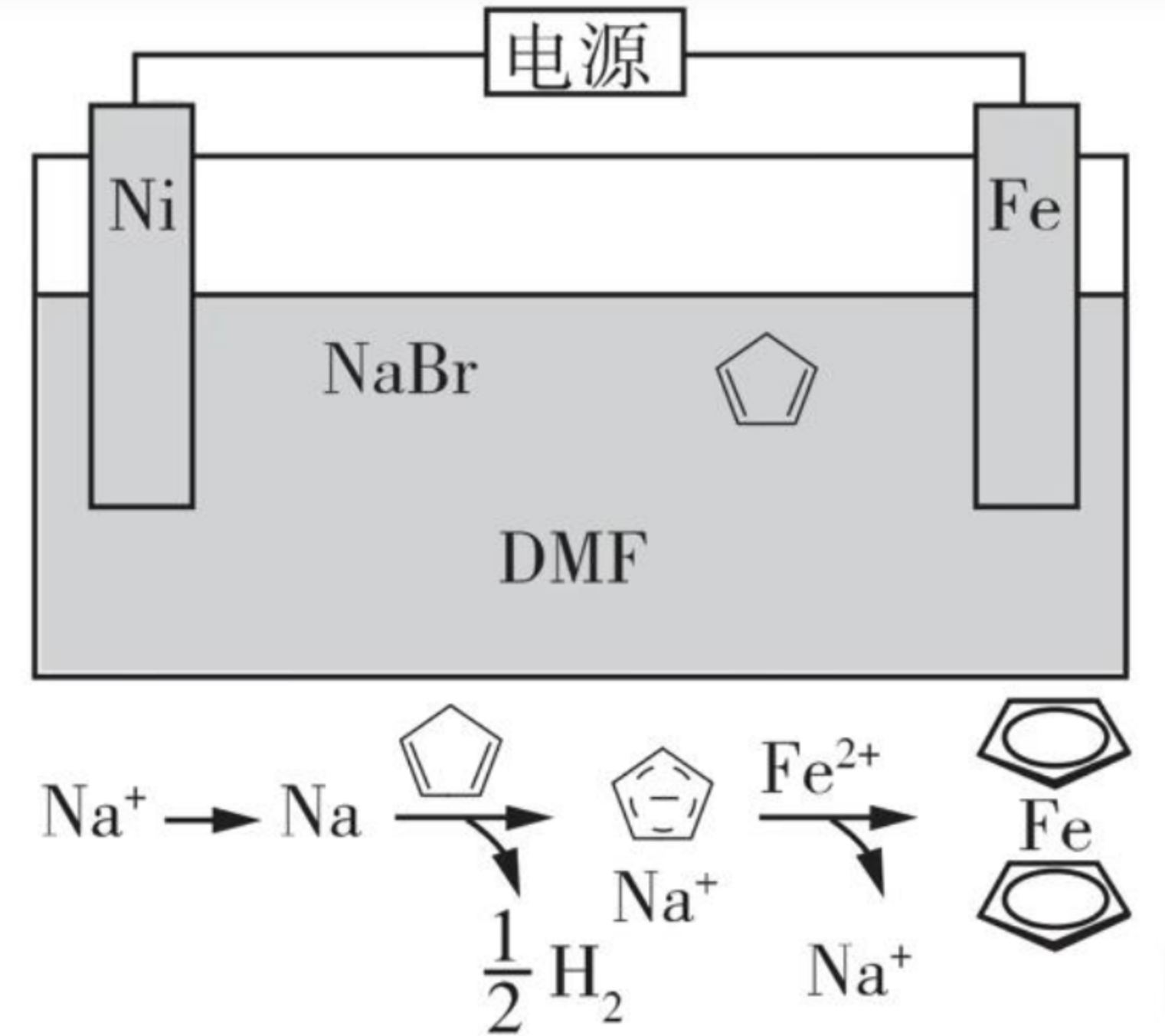
该电解池的阳极是什么,总反应是什么?
电解制备需要在无水条件下进行,原因是什么?
分析:
根据图示可知,\(\ce{Ni}\) 电极溶液的 \(\ce{Na+}\) 会得电子变成 \(\ce{Na}\),然后进入环戊二烯的 \(\ce{DMF}\) 溶液中,间接氧化为 \(\ce{Na+}\),使得环戊二烯还原为负一价离子。同时 \(\ce{Fe}\) 在阳极氧化成 \(\ce{Fe^2+}\) 与环戊二烯形成的负一价离子反应生成二茂铁。
整体上相当于 \(\ce{Fe^2+}\) 失去电子,将电子移向 \(\ce{Ni}\) 使得 \(\ce{Na+}\) 得电子,再在溶液中氧化,间接还原环戊二烯。即铁丢电子最终给了环戊二烯。
根据分析可知,阳极为 \(\ce{Fe}\),总反应为:
\(\ce{Fe + 2}\) 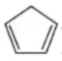 \(\ce{\xlongequal{电解}}\)
\(\ce{\xlongequal{电解}}\)  \(\ce{+ H2 ^}\)
\(\ce{+ H2 ^}\)
如果在有水条件下进行反应,间接转移电子的 \(\ce{Na+}\) 就会与水反应,从而阻碍中间产物 \(\ce{Na}\) 的生成。同时在水中 \(\ce{Fe^2+}\) 会水解产生 \(\ce{Fe(OH)2}\),消耗 \(\ce{Fe^2+}\),导致二茂铁的产量大幅降低。
所以原因有两点:
- 有水会使得 \(\ce{Na+}\) 直接与水反应,阻碍中间产物 \(\ce{Na}\) 的产生;
- \(\ce{Fe^2+}\) 会与水反应被消耗,使得二茂铁的产量降低。

