化学必修一
第一章 物质及其变化
第一节 物质的分类及转化
一、物质的分类
分散质粒子的直径小于 \(1 \operatorname{nm}\) 的是溶液
分散质粒子的直径大于 \(100 \operatorname{nm}\) 的是乳浊液或悬浊液
分散质粒子的直径为 \(1 \sim 100 \operatorname{nm}\) 的分散系是胶体
第二节 离子反应
一、电解质的电离
电解质:在水溶液里或熔融状态下能导电的化合物
-
强电解质
六大强酸:\(H Cl\)、\(H_2 S O_4\)、\(H N O_3\)、\(H Br\)、\(H I\)、\(H Cl O_4\)
四大强碱:\(Na O H\)、\(K O H\)、\(Ca (O H)_2\)、\(Ba (O H)_2\)
-
弱电解质
\((C O H_3 C O O)_2 Pb\)、\(Hg Cl_2\)、\(Hg Br\)
二、离子反应
\(Fe^{2+}\)浅绿色,\(Fe^{3+}\)黄色,\(Fe O_4^{2-}\)紫红色
\(Cu^{2+}\)蓝色
\(Mn^{2+}\)近无色,\(Mn O_4^{2-}\)墨绿色,\(Mn O_4^-\)紫红色
\(Cr^{3+}\)绿色,\(Cr O_4^{2-}\)黄色,\(Cr_2 O_7^{2-}\)橙色
第三节 氧化还原反应
一、氧化还原反应
双线桥

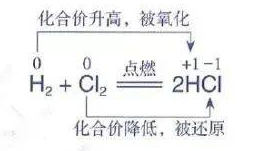
二、氧化剂和还原剂
单线桥

\(O_2\)、\(Cl_2\)、浓硫酸、\(H N O_3\)、\(K Mn O_4\)、\(Fe Cl_3\)等常用作氧化剂
活泼金属单质、\(C\)、\(H_2\)、\(C O\)、\(K I\)等常用作还原剂
氧化(还原)性:反应前\(>\)反应后,氧化(还原)剂\(>\)氧化(还原)产物
氧化性:\(Mn O_4^- > Cl_2 > Br_2 > Fe^{3+} > I_2 > S\)
还原性:\(Mn^{2+} < Cl^- < Br^- < Fe^{2+} < I^- < S^{2-}\)
金属活动性(左到右)\(\to\) 单质还原性强到弱、离子氧化性弱到强
升(化合价升高)失(失去电子)氧(被氧化,发生氧化反应)还(作还原剂,体现还原性)
降(化合价降低)得(得到电子)还(被还原,发生还原反应)氧(作氧化剂,体现氧化性)
第二章 海水中的重要元素——钠和氯
第一节 钠及其化合物
一、活泼的金属单质——钠
\(4 Na + O_2 \stackrel{}{\underset{}{=\!=\!=}} 2 Na_2 O\)(钠在空气中变暗,生成白色固体)
\(2 Na + O_2 \stackrel{\Delta}{\underset{}{=\!=\!=}} Na_2 O_2\)(发出黄色火焰,生成淡黄色固体)
\(2 Na + 2 H_2 O \stackrel{}{\underset{}{=\!=\!=}} 2 Na O H + H_2 \uparrow\)(浮、熔、游、响、红)
二、钠的几种化合物
-
氧化钠和过氧化钠
\(2 Na_2 O_2 + 2 H_2 O \stackrel{}{\underset{}{=\!=\!=}} 4 Na O H + O_2\)
\(2 Na_2 O_2 + 2 C O_2 \stackrel{}{\underset{}{=\!=\!=}} 2 Na_2 C O_3 + O_2\)
-
碳酸钠和碳酸氢钠
\(2 Na H C O_3 \stackrel{\Delta}{\underset{}{=\!=\!=}} Na_2 C O_3 + H_2 O + C O_2 \uparrow\) (鉴别碳酸钠和碳酸氢钠)
侯氏制碱法:
- \(Na Cl + N H_3 + H_2 O + C O_2 {=\!=\!=} N H_4 Cl + Na H C O_3 \downarrow\) (\(Na Cl\)饱和,先加\(N H_3\))
- \(2Na H C O_3 \stackrel{\Delta}{\underset{}{=\!=\!=}} Na_2 C O_3 + H_2 O + C O_2 \uparrow\)
三、焰色试验
蘸取碳酸钾做实验,要透过蓝色钴玻璃观察焰色,滤去黄色的光,避免碳酸钾中所含的微量钠盐造成干扰
| 金属元素 | 锂 \(Li\) | 钠 \(Na\) | 钾 \(K\) | 铷 \(Rb\) | 钙 \(Ca\) | 锶 \(Sr\) | 钡 \(Ba\) | 铜 \(Cu\) |
|---|---|---|---|---|---|---|---|---|
| 焰色 | 紫红色 | 黄色 | 紫色 | 紫色 | 砖红色 | 洋红色 | 黄绿色 | 绿色 |
第二节 氯及其化合物
一、氯气的性质
-
与金属、非金属单质的反应
\(2 Na + Cl_2 \stackrel{\Delta}{\underset{}{=\!=\!=}} 2 Na Cl\)(产生白烟)
\(2 Fe + 3 Cl_2 \stackrel{\Delta}{\underset{}{=\!=\!=}} 2 Fe Cl_3\)
\(Cu + Cl_2 \stackrel{\Delta}{\underset{}{=\!=\!=}} Cu Cl_2\)
\(H_2 + Cl_2 \stackrel{\text{点燃}}{\underset{}{=\!=\!=}} 2 H Cl\)(发出苍白色火焰,产生白雾)
-
与水的反应
\(Cl_2 + H_2 O \stackrel{}{\underset{}{=\!=\!=}} H Cl + H Cl O\)(\(H Cl O\)具有强氧化性,能起到杀菌消毒的作用,还能使某些燃料和邮寄色素褪色)
\(2 H Cl O \stackrel{\text{光照}}{\underset{}{=\!=\!=}} 2 H Cl + O_2 \uparrow\)(次氯酸是很弱的酸、不稳定)
-
与碱的反应
\(Cl_2 + 2 Na O H \stackrel{}{\underset{}{=\!=\!=}} Na Cl + Na Cl O + H_2 O\) (以 \(Na Cl O\) 为有效成分的漂白液)
\(2 Cl_2 + 2 Ca (O H)_2 \stackrel{}{\underset{}{=\!=\!=}} Ca (Cl O)_2 + Ca Cl_2 + 2 H_2 O\) (通入冷的石灰乳得到以 \(Ca (Cl O)_2\) 为有效成分的漂白粉;与 \(Ca (O H)_2\) 反应充分得到漂粉精)
\(Ca (Cl O)_2 + C O_2 + H_2 O \stackrel{}{\underset{}{=\!=\!=}} Ca C O_3 \downarrow + 2 H Cl O\)
二、氯气的实验室制法
\(Mn O_2 + 4 H Cl \text{(浓)} \stackrel{\Delta}{\underset{}{=\!=\!=}} Mn Cl_2 + Cl_2 \uparrow + 2 H_2 O\)
三、氯离子的检验
用稀硝酸(排除 \(C O_3 ^{2-}\) 等的干扰)酸化过的 \(Ag N O_3\) 检验 \(Cl^-\)
第三节 物质的量
一、物质的量的单位——摩尔
\(n\) :物质的量(表示含有一定数目粒子的集合体),单位 \(\operatorname{mol}\)
\(N\) :粒子数
\(N_A\) :阿伏加德罗常数,\(6.02\times 10^{23}\operatorname{mol}^{-1}\)
\(M\):摩尔质量(单位物质的量的物质所具有的质量),常用单位 \(g \cdot \operatorname{mol}^{-1}\),在数值上等于其相对质量
\(m\) :质量
二、气体摩尔体积
\(V_m\) :气体摩尔体积(单位物质的量的气体所占的体积),常用单位 \(L \cdot \operatorname{mol}^{-1}\)和\(m^3\cdot \operatorname{mol}^{-1}\)
\(V\) :体积
在标准状况(\(0\space^\circ C\) 、 \(101 \operatorname{kPa}\))下,气体摩尔体积约为 \(22.4 \operatorname{L/mol}\)
在常温常压(\(25\space^\circ C\)、\(101 \operatorname{kPa}\))下, 气体摩尔体积约为 \(24.5 \operatorname{L/mol}\)
三、物质的量浓度
-
物质的量浓度
\(c_B\) :物质的量浓度(单位体积的溶液里所含溶质 \(B\) 的物质的量),常用单位 \(\operatorname{mol/L}\)
\[c_B = \frac{n_B}{V} \] -
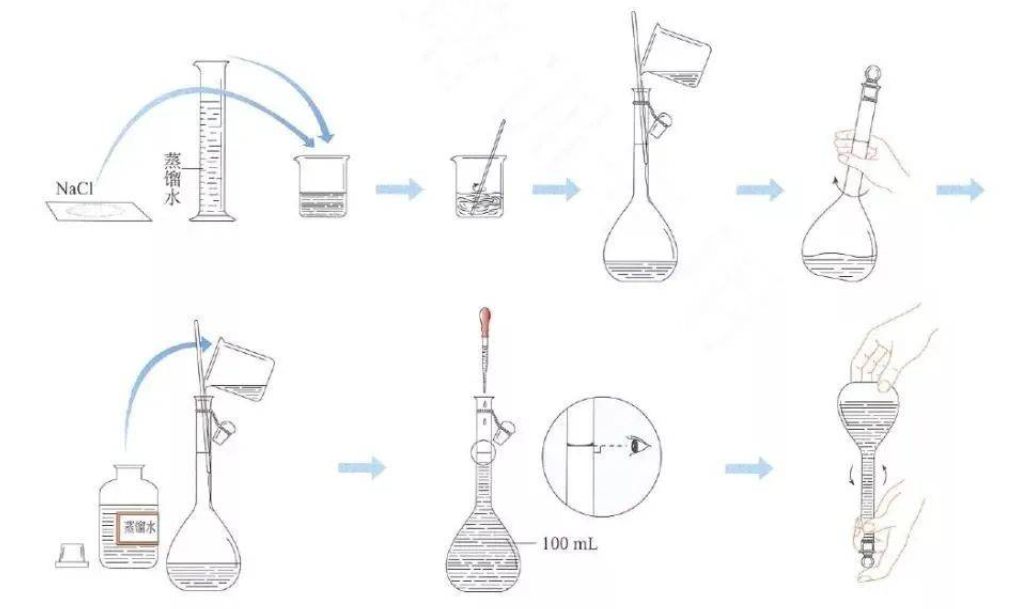
配制一定物质的量浓度的溶液
\(c\)(浓溶液)\(\cdot\space V\)(浓溶液)\(=c\)(稀溶液)\(\cdot\space V\)(稀溶液)
配制一定物质的量浓度的$Na Cl$溶液
第三章 铁 金属材料
第一节 铁及其化合物
\(Fe + 2 Fe^{3+} {=\!=\!=} 3 Fe^{2+}\)
\(2 Fe Cl_3 + Cu {=\!=\!=} Cu Cl_2 + 2 Fe Cl_2\)(用 \(Fe Cl_3\) 溶液作为“腐蚀液”,将覆铜板上不需要的铜腐蚀)
一、铁的单质
\(3 Fe + 4 H_2 O (g) \stackrel{\text{高温}}{\underset{}{=\!=\!=}} Fe_3 O_4 + 4 H_2\)(红热的铁与水蒸气反应)
二、铁的重要化合物
-
铁的氧化物
\(Fe O\)不稳定,在空气中受热,能迅速被氧化成 \(Fe_3 O_4\)
\(Fe_2 O_3\) 俗称铁红,常用作油漆、涂料、油墨和橡胶的红色颜料
\(Fe O + 2 H^+ \stackrel{}{\underset{}{=\!=\!=}} Fe^{2+} + H_2 O\)
\(Fe_2 O_3 + 6 H^+ \stackrel{}{\underset{}{=\!=\!=}} 2 Fe^{3+} + 3 H_2 O\)
\(2 Fe^{3+} + Cu {=\!=\!=} Cu^{2+} + 2 Fe^{2+}\)
-
铁的氢氧化物
\(Fe S O_4 + 2 Na O H \stackrel{}{\underset{}{=\!=\!=}} Fe (O H)_2 \downarrow + Na_2 S O_4\)(生成的白色絮状沉淀迅速变成灰绿色)
\(4 Fe (O H)_2 + O_2 + 2 H_2 O \stackrel{}{\underset{}{=\!=\!=}} 4 Fe (O H)_3\) (过一段时间有红褐色物质生成)
\(2 Fe^{3+} + Fe \stackrel{}{\underset{}{=\!=\!=}} 3 Fe^{2+}\)
\(2 Fe^{2+} + Cl_2 \stackrel{}{\underset{}{=\!=\!=}} 2 Fe^{3+} + 2 Cl^-\)
第二节 金属材料
一、铁合金
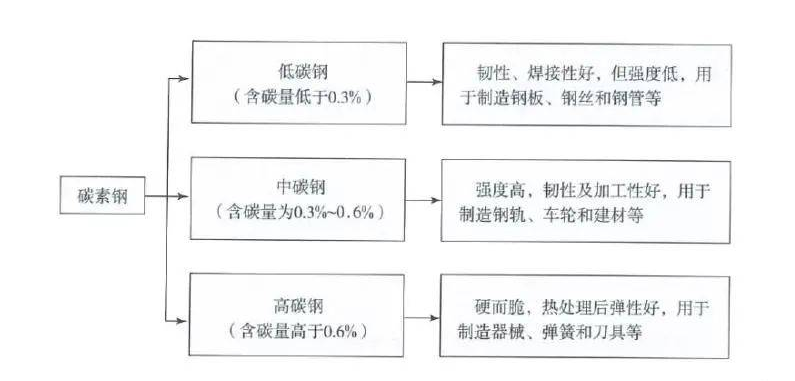
铁、钢等铁合金
生铁含碳量 \(2\% \sim 4.3\%\),硬度大、抗压,性脆、可以铸造成型,是制造机座、管道的重要材料
钢含碳量 \(0.03 \sim 2\%\),有良好的延展性,机械性能好,可以锻轧和铸造,广泛用于制造机械和交通工具等
不锈钢含 \(Cr 17\% \sim 19\%\)、\(Ni 8\% \sim 13\%\),在大气中比较稳定,有很强的抗腐蚀能力

二、铝和铝合金
铝和硬铝
铝是一种活泼金属,常温下能与氧气反应,生成一层致密的氧化铝薄膜,起保护内部金属的作用
纯铝的硬度和强度较小,加入\(Cu\)、\(Mg\)、\(Si\)、\(Mn\)、\(Zn\)、稀土元素等,可制成铝合金(用途广泛)
硬铝,含 \(Cu 4\%\)、\(Mg 0.5\%\)、\(Mn 0.5\%\)、\(Si 0.7\%\),密度小、强度高,具有较强的抗腐蚀能力,是制造飞机和宇宙飞船的理想材料
\(2 Al + 6 H Cl \stackrel{}{\underset{}{=\!=\!=}} 2 Al Cl_3 + 3 H_2 \uparrow\)
\(2 Al + 2 Na O H + 2 H_2 O \stackrel{}{\underset{}{=\!=\!=}} 2 Na Al O_2 + 3 H_2 \uparrow\)
\(Al_2 O_3 + 6 H Cl \stackrel{}{\underset{}{=\!=\!=}} 2 Al Cl_3 + 3 H_2 O\)
\(Al_2 O_3 + 2 Na O H \stackrel{}{\underset{}{=\!=\!=}} 2 Na Al O_2 + H_2 O\)
\(Al (O H)_3 + 3 H^+ \stackrel{}{\underset{}{=\!=\!=}} Al^{3+} + 3 H_2 O\)
\(Al (O H)_3 + O H^- \stackrel{}{\underset{}{=\!=\!=}} Al O_2^- + 2 H_2 O\)
第四章 物质结构 元素周期律
第一节 原子结构与元素周期表
一、原子结构
质量数(\(A\))\(=\) 质子数(\(Z\))\(+\) 中子数(\(N\))
分别用 \(n = 1, 2, 3, 4, 5, 6, 7\) 或 \(K\)、\(L\)、\(M\)、\(N\)、\(O\)、\(P\)、\(Q\)来表示从内到外的电子层
原子核外第 \(n\) 层最多能容纳的电子数为 \(2 n^2\),最外层的电子数最多 \(8\) 个
二、元素周期表
元素周期表有 \(7\) 个横行,\(18\)个纵列,\(16\)个族(\(VIII\)族、\(0\)族、\(7\)个主族、\(7\)个副族)
三、核素
\(^A_Z X\) 表示质量数为 \(A\),质子数为 \(Z\) 的 \(X\) 原子
四、原子结构与元素的性质
碱金属元素
-
碱金属单质主要物理性质
颜色和硬度:除铯略带金属光泽外,其余都呈现银白色;硬度较小
熔点与沸点:由上到下,熔沸点依次降低
密度:\(Li<K<Na<Rb<Cs\)
-
碱金属单质主要化学性质:能与氧气等非金属单质以及水反应,从锂到铯,金属性逐渐增强
\(4 Li + O_2 \stackrel{\Delta}{\underset{}{=\!=\!=}} 2 Li_2 O\)
\(2 Na + O_2 \stackrel{\Delta}{\underset{}{=\!=\!=}} Na_2 O_2\)
\(2 Na + 2 H_2 O \stackrel{}{\underset{}{=\!=\!=}} 2 Na O H + H_2 \uparrow\)
\(2 K + 2 H_2 O \stackrel{}{\underset{}{=\!=\!=}} 2 K O H + H_2 \uparrow\)
卤族元素
-
卤素单质与氢气反应
\(H_2 + F_2 \stackrel{}{\underset{}{=\!=\!=}} 2 H F\) (在暗处能剧烈化合并发生爆炸,生成的氟化氢很稳定)
\(H_2 + Cl_2 \stackrel{\text{光照或点燃 }}{\underset{}{=\!=\!=\!=\!=}} 2 H Cl\) (光照或点燃发生反应,生成的氯化氢较稳定)
\(H_2 + Br_2 \stackrel{\Delta}{\underset{}{=\!=\!=}} 2 H Br\) (加热至一定温度才能反应,生成的溴化氢不如氯化氢稳定)
\(H_2 + I_2 \stackrel{\Delta}\rightleftharpoons 2 H I\)(不断加热才能缓慢反应;碘化氢不稳定,在同一条件下同时分解为 \(H_2\) 和 \(I_2\),是可逆反应)
-
卤素单质间的置换反应
\(2Br^- + Cl_2 \stackrel{}{\underset{}{=\!=\!=}} 2Cl^- + Br_2\)
\(2I^- + Cl_2 \stackrel{}{\underset{}{=\!=\!=}} I_2 + 2Cl^-\)
\(Br_2 + 2I^- \stackrel{}{\underset{}{=\!=\!=}} 2 Br^- + I_2\)
从\(F_2\)到\(I_2\),氧化性逐渐减弱
同主族元素从上到下,原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱
第二节 元素周期律
元素周期律:元素的性质随着原子序数的递增而呈现周期性的变化
一、元素性质的周期性变化规律
同周期元素从左到右,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强
二、元素周期表和元素周期律的应用
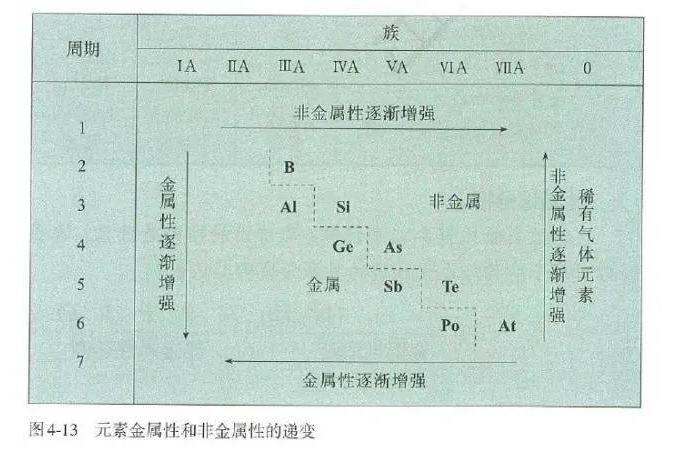
位于分界线附近的元素既能表现出一定的金属性,又能表现出一定的非金属性
第三节 化学键
一、离子键
通常,活泼金属与活泼非金属形成离子化合物
电子式:在元素符号周围用“·”或“\(\times\)”表示原子的价电子
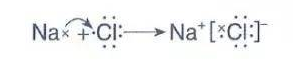
二、共价键
共价键:原子间通过公用电子对所形成的相互作用叫做共价键


化学键:相邻的原子之间强烈的相互作用叫做化学键
分子具有一定的空间结构,如 \(C O_2\)是直线形,\(H_2 O\)呈\(V\)形,\(C H_4\)呈正四面体形等
化学反应的过程,本质上就是旧化学键断裂和新化学键形成的过程

