离心技术杂项
本文使用署名-非商业性使用-禁止演绎 (CC BY-NC-ND) 协议来声明版权,是一个关于生物技术的小作品,如有错误之处欢迎指出。
离心技术作为一项分离技术具有悠久的历史。1878 年,瑞典工程师 Gustaf de Laval 发明了连续操作离心机(下图),从牛奶中分离出奶油。1896 年,这项设计被应用与发酵工业中提取酵母。如今,离心应用于生物物质(如 DNA 、大分子、哺乳动物细胞和细胞内组分等)的分离。例如,啤酒和果酒的澄清、酵母液的浓缩、谷氨酸结晶的分离,各种发酵液菌体和流感疫苗以及干扰素制备等,大量使用各种类型的离心机。离心技术已成为现代生化分离工程的重要组成,下面我将对离心技术原理、分离和离心机进行展开。

离心技术原理
概念:离心分离技术是借助于离心机旋转所产生的离心力,使不同沉降系数、不同密度的物质分离、浓缩或提炼的技术过程。
老生常谈:离心力与向心力
在说明有关离心技术的一切之前,我们必须要提一提关于离心力和向心力的故事。自高中以来,我们就被纠正:宇宙中只有向心力而离心力根本不存在,但是为什么离心力这种错误的概念还能经常出现在离心技术中?要解释这个问题,首先要知道什么是离心力。
举个简单的 例子 ,地球绕太阳转,把地球和太阳考虑成质点,且太阳视作 惯性系 (在惯性参考系内,系统内部的物理规律与系统外的因素无关,即:该系统不受外力)。
- 如果你(观测者)在与太阳相对静止的参考系中,这时地球所受的力只有太阳对它的万有引力,合力不为零,所以作加速度不为零的运动(加速度指向太阳)。对于这个圆周运动,我们说太阳对地球的万有引力提供了地球作圆周运动的向心力(作用)。
- 如果你在与地球相对静止的参考系中,这就不是一个惯性系了。这时地球受太阳的万有引力,但却是保持静止的,所以我们需要引入一个力来使得牛顿第二定律仍然能在形式上保持不变,这个力跟太阳对地球的万有引力大小相等,方向相反,或许可以称之为“离心力”。
- 如果现在让万有引力消失,地球会沿着轨道切线方向飞出,而不是像受到离心力那样沿径向飞出(如下图)。
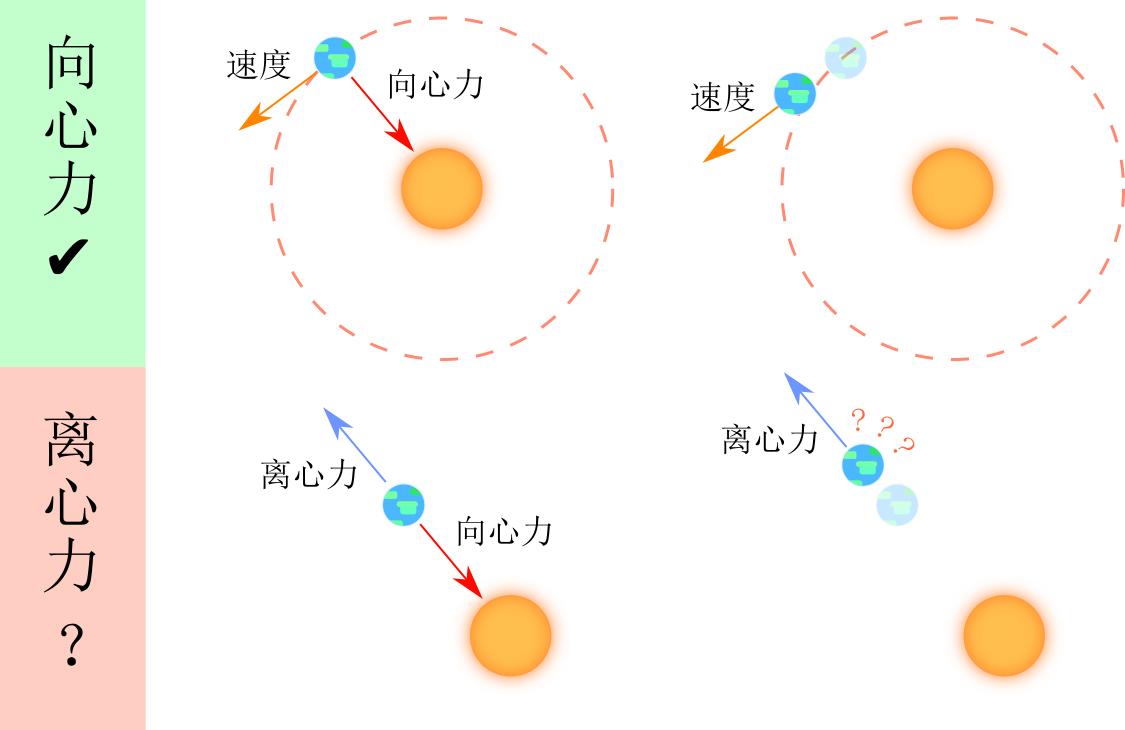
综上,离心力是我们直觉上的(这个直觉就是选择参考系的直觉)虚幻的力,就像”惯性力“一样。它之所以能在离心技术中出现,是因为我们把被离心的物体颗粒作为了参考系,同时为了解释和量化这个微粒在离心过程中的向外运动,我们就不得不引入”离心力“这个概念。事实上,在离心过程微粒向外运动的现象,是由于微粒在介质中运动所受到的阻力不足以提供足够的向心力而产生的。
铺垫到此为止,从现在开始,我们就要接受接受离心力的概念了,把向心力替换为离心力确实能简化一些问题。
离心力和相对离心力
在离心过程中,离心力 \(F\) 大小等于原来向心力,方向与向心力相反。\(\omega\) 为离心转子角速度,\(r\) 为颗粒旋转半径。其计算公式如下:
由于各种离心机转子的半径或者离心管至旋转轴中心的距离不同,所受离心力也会不同,因此文献中常用“相对离心力(RCF(Fr), relative centrifugal force )”或数字“数字×重力加速度 g”表示离心力。相对离心力是指在离心力场的作用下,颗粒所受的离心力相当于地球重力的倍数,单位是重力加速度( \(9.8m/s^2\))。其计算公式如下:
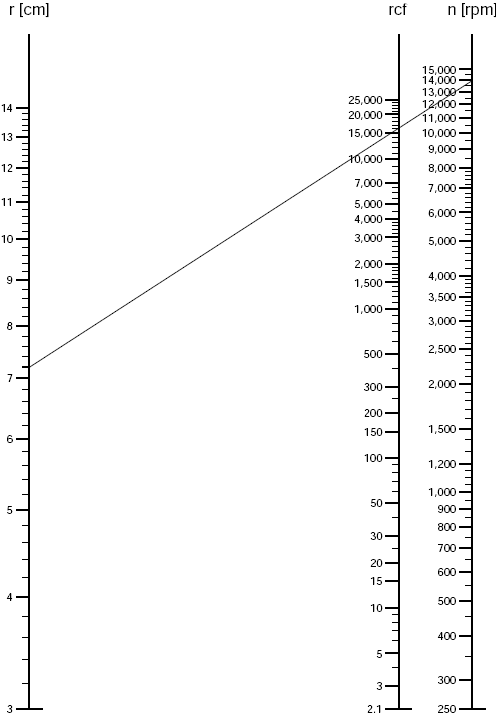
\((2)\) 式可由 \((1)\) 式推得,其中 \(rpm\) 为离心机转子每分钟转速( \(r/min\) ),所以 \((2)\) 式也是 \(rpm\) 和 \(RCF\) 的换算方法。对于低速离心,在已知 \(r\) 的情况下 \(rpm\) 和 \(RCF\) 还可以 用诺曼图直接读出 ,方法是在下图标尺上取已知的 \(r\) 半径值和在 \(RCF\) 标尺上取已知相对离心力值,这两点间线的沿长线在 \(rpm\) 标尺的交点即为所要换算的值。反之亦然。
前置问题
除了离心力,在多数教学资料以及文献中,还有一些概念是默认我们已知的,但这样可能会对某些新手造成困扰(比如笔者),为了说明后面的内容,还有几个问题我们需要明确。
有关半径那点事
最准确的半径当然是从离心机转轴到微粒的距离,但是在离心过程中,随着微粒距转轴距离增大,这个数字是变化的。为了方便计算,\(r\) 常取 三种定值 (如下图)。一般建议使用 R-max 最为旋转半径,计算相应的离心力。

谁的密度?
我们都知道,在围观角度下,无论是样品还算液体介质,都是由微粒构成,现某液体介质有一球形微粒(构成,微粒质量 \(m_0\) 和体积 \(V_0\) 已知,能否求出该介质密度?
答案是不能。为什么?物质密度的定义是质量与体积之比( \(\rho=m/V\) ),这没问题,问题在于这个液体介质是该微粒的集合(如下图),因此要求该介质的密度 \(\rho\) 必须要套用该介质的质量 \(m\) 和体积 \(V\),介质中粒子的质量 \(m_0\) 和体积 \(V_0\) 只能求出该粒子的密度 \(\rho_0\),而 \(\rho_0 \neq \rho\)。举一个极端例子,水与水蒸气都是由水分子构成( \(\rho_0\) 相同),然而由于分子之间的间距差异,其密度 \(\rho\) 相差甚大。

在离心技术中,所谓密度通常是指介质微粒集合的密度(警惕特殊情况),如果你错误地以为这里的密度是介质中粒子的密度,那你可能会觉得关于后面离心技术原理的描述自相矛盾,比如在 差速区带离心 中,微粒沉降的速度主要取决于它们的粒径和质量而非密度(关于详细离心技术的原理见下节)。
受力、密度与微粒运动状态
待离心的微粒处于液体介质中,必然受到介质对他的 浮力 ,而微粒在离心时的受力(浮力、阻力、离心力等)则决定了其运动状态是上浮还是下沉。这可能有点奇怪,离心时物质反而上浮?在一般情况,即微粒密度大于介质时微粒确实是下沉的,但是在 等密度区带离心 时,由于液体介质密度更大,密度小的微粒就会上浮,或者说,是密度更大的液体介质在离心过程中下沉了(把小密度微粒顶浮,直到到达于其密度一致的介质区带)。
浮密度
离心中密度还有一种表示,即浮密度。浮(力)密度亦称有效密度,是单位体积微粒质量减去单位体积介质质量(微粒受介质的浮力),可用下式表示:
\(m\) 是单位体积微粒质量,\(\rho_{ 介质 }\) 是介质密度,\(\rho_{ 微粒 }\) 是微粒密度。可见,浮密度是相对的量,可反映微粒与介质密度的关系。
在离心技术中,“密度”比“受力”更常见,因为密度的表述更为直观。下表为受力、密度、浮密度与微粒运动状态关系。
| 微粒状态 | 受力 | 介质与微粒密度 | 浮密度 |
|---|---|---|---|
| 悬浮 | $F_ 浮 =F_ 离 $ | \(\rho_{ 微粒 }=\rho_{ 介质 }\) | \(\rho_ 浮 = 0\) |
| 下沉 | $F_ 浮 <F_ 离 $ | \(\rho_{ 微粒 }>\rho_{ 介质 }\) | \(\rho_ 浮 > 0\) |
| 上浮 | $F_ 浮 >F_ 离 $ | \(\rho_{ 微粒 }<\rho_{ 介质 }\) | \(\rho_ 浮 < 0\) |
什么是沉降?
概念 :依靠地球引力场的作用,利用微粒与流体的密度差异,使之发生相对运动而沉降,即重力沉降。相对的,依靠离心机产生的强大离心力使微粒沉降,就是离心沉降。可以说,离心沉降相当于给重力沉降按下了快进键。
关于沉降,有几个重要参数。
沉降速度
沉降速度\(v_t\)(\(m/s\)) 是物质微粒在单位时间内沿受力力方向移动的距离。
终端速度
在加速度恒定且介质粘度与密度不变的条件下,因为微粒受力平衡(重力或离心力与介质作用于该粒子的运动的粘性阻力相互抵消),故作匀速直线运动,沉降速度是一个恒定值,即达到了 终端速度 。数学上,无视浮力的终端速度可用下式表示:
\(V_t\) 为终端速度,\(m\) 为物体重量,
\(a\) 为物体受到的加速度,\(C_d\) 为阻力系数,\(\rho\) 为物体落下时所处的流体密度,\(A\) 为物体的投影面积。所施加的加速度 \(a\) (\(m/s^2\)) 可以是重力加速度 \(g\), 更常见的是离心加速度 \(\omega^2r\) 。此时,\(\omega\) 是转子的角速度 ,\(r\) 是粒子和转轴( 半径 )的距离。
密度变化介质中的沉降速度
某些离心技术(区带离心)的介质密度不是均一的,这时微粒沉降速度也会随着介质密度变化而变化,这个规律可以用 斯托克斯定律 表示:
\(V\) 为微粒沉降速度,\(d\) 为微粒直径(球体微粒),\(\rho_p\) 和 \(\rho_l\) 为微粒密度和液体介质密度,\(\eta\) 为液体介质的黏度,\(g\) 为相对离心力。
从这个式子中可以观察到几个规律:微粒沉降速度 \(V\) 与粒子直径 \(d\) 的平方、微粒密度 \(\rho_p\) 与液体介质密度 \(\rho_l\) 差成正比;当 \(\rho_p\) 等于 \(\rho_p\) 时,\(V=0\);当液体介质的黏度 \(\eta\) 增加时,\(V\) 下降;当相对离心力 \(g\) 增加时,\(V\) 增加。
沉降系数
沉降系数( sedimentation coefficient, s;单位:Svedbery, S;1S=10-13 秒)是指用离心法时,分子沉降速度的量度,被定义为一个微粒的沉降速度与致其沉降的加速度的比率。
终端速度与加速度和介质提供的阻力有关,由 斯托克斯定律 可得:对于球形颗粒,其在流体中受到的阻力为 \(6 πη r_0 v\),其中 $ η $ 是介质的粘度,\(r_0\) 是颗粒的半径,\(v\) 是粒子的速度。离心力由以下公式给出:\(mr\omega^2\),\(m\) 是微粒的质量。当达到终端速度时,阻力等于离心力,则有下式:
将 \((2)\) 式代入 \((1)\) 式,整理得到最终公式:
现在我们可以看出,沉降系数不再依赖于加速度大小,而仅由颗粒的性质( \(m\), \(r_0\) )和它悬浮介质性质( \(\eta\) )决定。在文献引用中,沉降系数通常是在水中的20 ℃时的值,这时它是一种微粒的特征常数。当微粒在某介质中沉降速度为零时,则微粒在该介质的 \(s\) 为零。
沉降系数应用
已知微粒沉降系数,可以推断它的离心时间和相对分子量。
若是把 \(s\) 当作一个无量纲的常数,可以通过比较两个微粒的 \(s\) 粗略比较其分子量大小。本质上,\(s\) 等于每单位离心场的速度,这么说来可能有点别扭,但是把 \((1)\) 式变形,得到 \(v_t=sa\),我们发现在 \(s\) 已知的情况下,我们可以根据 \(a\) 求得终端速度。现在回过头,\(s\) 是每单位离心场的速度,加速度 \(100g\) 的终端速度肯定比 \(10g\) 快。
需要注意的是,沉降系数没有可加性。沉降系数并不仅仅取决于粒子的质量或体积,当两个颗粒结合在一起难免造成表面积减少。因此,当单独计量,他们的和将与两者结合时的粒子 \(s\) 值不符。核糖体就是一个例子。核糖体是最经常通过它们的沉降系数进行分辨。例如,来自细菌的 \(70S\) 核糖体实际上是沉降系数为 \(70S\) 的,虽然它是由一个 \(50S\) 亚基和一个 \(30S\) 亚基所构成。
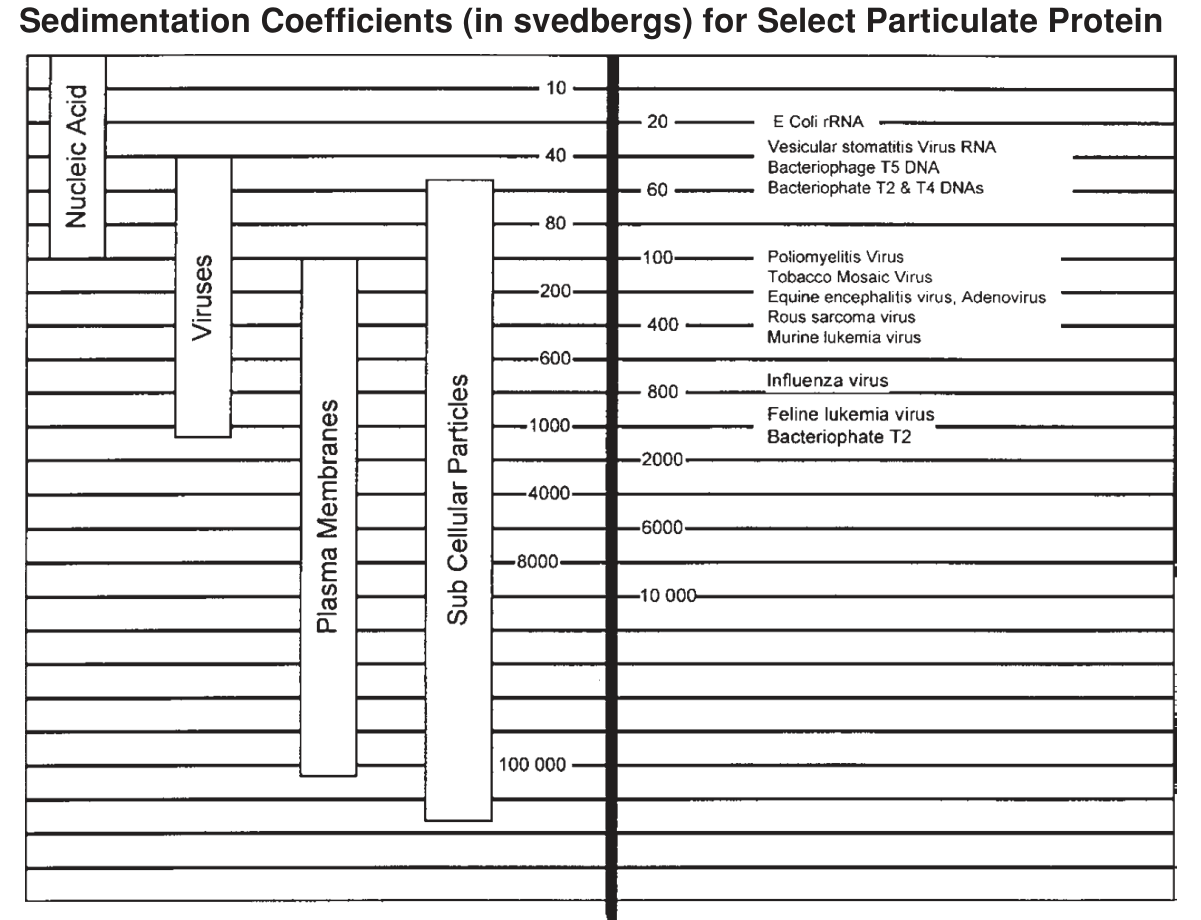
常见生物组分 \(s\) 如下图。
离心技术分类
离心技术可分为以下两种:
-
离心过滤:使悬浮液受离心力,而对过滤介质施加压力,液体通过过滤面,固体颗粒被截下,从而液 - 固分离。
-
离心沉降:利用悬浮液 ( 或乳浊液 ) 密度不同的各成份在离心力场中迅速沉降分层的原理,以达成固 - 液 ( 或液 - 液 / 区带 ) 分离。
离心沉降技术按照分离微粒大小和原理不同可分为(粒子)差速离心和区带离心,其中区带离心又可分为差速区带离心和等密度区带离心。
此外按照实验目的的不同,离心技术还可分为两种:
-
制备离心技术:以分离纯化生化物质,如细胞、亚细胞粒子、病毒等为目的离心技术。
-
分析离心技术:为测定微粒沉降系数、相对分子量等参数。
下面针对离心沉降技术进行展开。
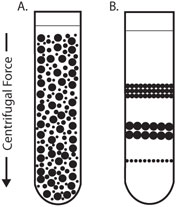
(粒子)差速离心
差速离心法,有时亦称为差速造粒法或粒子差速离心法,”粒子“在这里想强调的是,此法的目的是产生沉淀,固液分离。
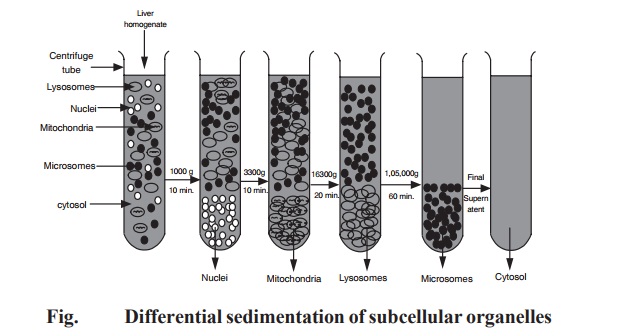
原理 :该方法是利用悬浮液中各组分的 \(s\)显著不同而进行分离的方法。悬浮液中不大小或密度的颗粒将以不同的速率沉降,粒径较大和较致密的颗粒沉淀得更快。沉降速率可用离心力来增加。悬浮液经过一系列离心周期(离心后把上清液与沉淀分开,上清液进入更高速的离心),随着离心力逐渐增加,微粒按大小或密度依次产生细胞沉淀团,从而达到分离目的(下图)。
注意:(粒子)差速离心中的“差速”有两个含义,一是体现在原理上,即不同 \(s\) 的微粒沉降速度有差异,二是体现在技术操作上,即使用不同的离心转速是不同微粒沉淀。
优点
-
操作简易,离心后用倾倒法即可将上清液与沉淀分开
-
可用容量较大的角式转子,故样品的处理量较大
缺点
-
分离效果差,不能一次性得到纯微粒
-
差速离心的分辨率不高,一般用于分离 \(s\) 相差一个数量级以上的颗粒如细胞器和病毒等,\(s\) 在同个数量级内的各种颗粒不易分开,常用于其他分离手段之前的粗制品提取。例如用差速离心法分离已破碎的细胞各组份。
-
差速离心法易产生共沉淀而受污染且回收率低。可通过重悬和再离心(例如洗涤沉淀团)来减缓不同颗粒类型的污染。
-
壁效应严重,在离心管一侧会出现沉淀,离心力过大、离心时间过长会使颗粒变形、聚集而失活。
区带离心前置
概念 :区带离心法( zonal centrifugation )是将样品加在惰性梯度介质中进行离心沉降(见差速区带离心)或沉降平衡(见等密度区带离心),在一定的离心力下把微粒分配到梯度中某些特定位置上,形成不同区带的分离方法(下图,某些情况下并不会产生如此清晰的区带,还需要通常照光、比较折射率等方法辅助判断)。
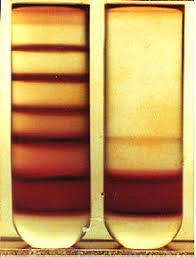
把微粒集中在区带而不是沉淀到离心管壁,是区带离心和(粒子)差速离心的主要区别。区带是相对粒子而言的,“粒子”通常是较大的微粒,它们在离心过程中容易沉淀,可以固 - 液分离,而“区带”则是难以沉淀或无法沉淀的微粒在离心过程中形成的,通常不同的区带有不同密度,属于液 - 液分离。
梯度密度介质(梯度介质)
梯度介质特点
区带离心可以使用均一密度介质(均一介质),但是更多时候还是使用梯度密度介质(梯度介质),梯度介质是指密度从离心管顶部到底部从小到大变化的介质。作为一种理想的梯度介质材料应具备以下几点:
- 与被分离的生物材料不发生反应即完全惰性,且易与所分离的生物粒子分开;对于分离细胞,要对细胞无毒、不渗入细胞、分级分离后容易从细胞中除去
- 可达到要求的密度范围,且在所要求的密度范围内,粘度低,渗透压低,离子强度和 pH 变化较小
- 不会对离心设备发生腐蚀作用
- 容易纯化,价格便宜或容易回收
- 浓度便于测定,如具有折光率
- 对于超速离心分析工作来说,它的物理性质、热力学性质应该是已知的
常用梯度介质
当然,上述条件是理想条件,完全符合每种性能的梯度材料几乎是没有的。下面介绍几种基本上符合上述原则的梯度材料:
- 糖类:蔗糖、甘油、聚蔗糖( Ficoll )、右旋糖酐、糖原
- 无机盐类:CsCl(氯化铯)、 RbCl (氯化铷)、 NaCl 、 KBr 等
- 有机碘化物:三碘苯甲酰葡萄糖胺( matrizamide )等
- 硅溶胶:如Percoll(一种经聚乙烯吡咯酮涂层 (PVP) 处理的硅胶颗粒)
- 蛋白质:如牛血清白蛋白
- 重水
- 非水溶性有机物:如氟代碳等
梯度介质作用于意义
-
区带离心技术通常使用很高的转速,属于超速离心,如果这时微粒沉淀到管壁,硬度不高的微粒很容易受挤压而变性失活,因此梯度介质起着承载与保护微粒的作用。前面的(粒子)差速离心使用较低的转速,一般微粒沉淀到管壁也不会变性。
-
微粒在均一介质(不能自动形成梯度)中离心,沉降时会产生对流,使得分离效果下降,而梯度介质可以防止对流搅拌,并使不同的微粒保持在自己的区带,在离心完成后用刺穿法取样时,梯度介质也能保持区带间的分离状态,起支持和稳定作用。
-
此外梯度介质提供了密度和粘度梯度,分离分辨率比均一介质高。
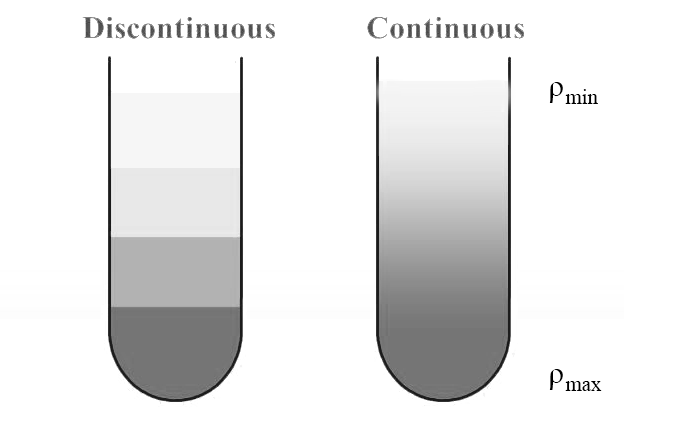
根据介质梯度是否连续可分为连续梯度介质和不连续(离散)梯度介质(如下图)。连续梯度介质可能更适合于分析目的,但制备技术通常使用不连续梯度介质,使得目的微粒区带处于密度梯度层之间。
梯度介质的制备
离散密度梯度可采用依次向离心管底部注射密度更大的介质来制备(如下图)。

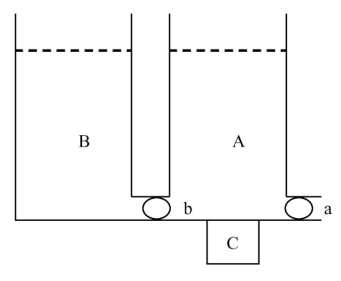
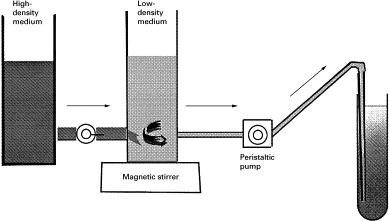
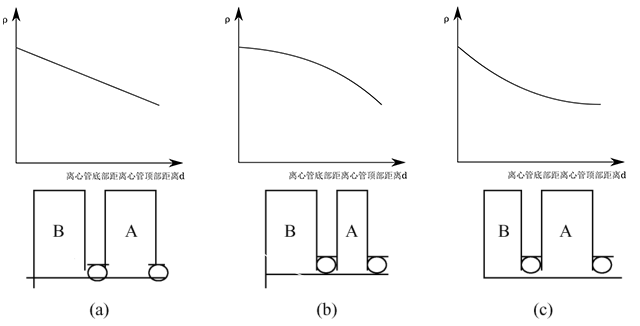
连续密度梯度一般采用密度梯度混合器进行制备。密度梯度混合器由贮液室( B )、混合室( A )、电磁搅拌器( C )和阀门( a, b )等组成(下图左)。配制时,将浓溶液置于 B 室,稀溶液置于 A 室,此时梯度液的导液管必须直插到离心管的管底,让后来流入的浓度较高的混合液将先流入的浓度较低的混合液顶浮起来,形成由管口到管底逐步升高的密度梯度(下图右)。
通过调整 A,B 两室的大小,可以制备不同变化趋势的梯度(下图),如线性梯度( a )、凹形梯度( b )和凸形梯度( c )。多使用线性梯度。
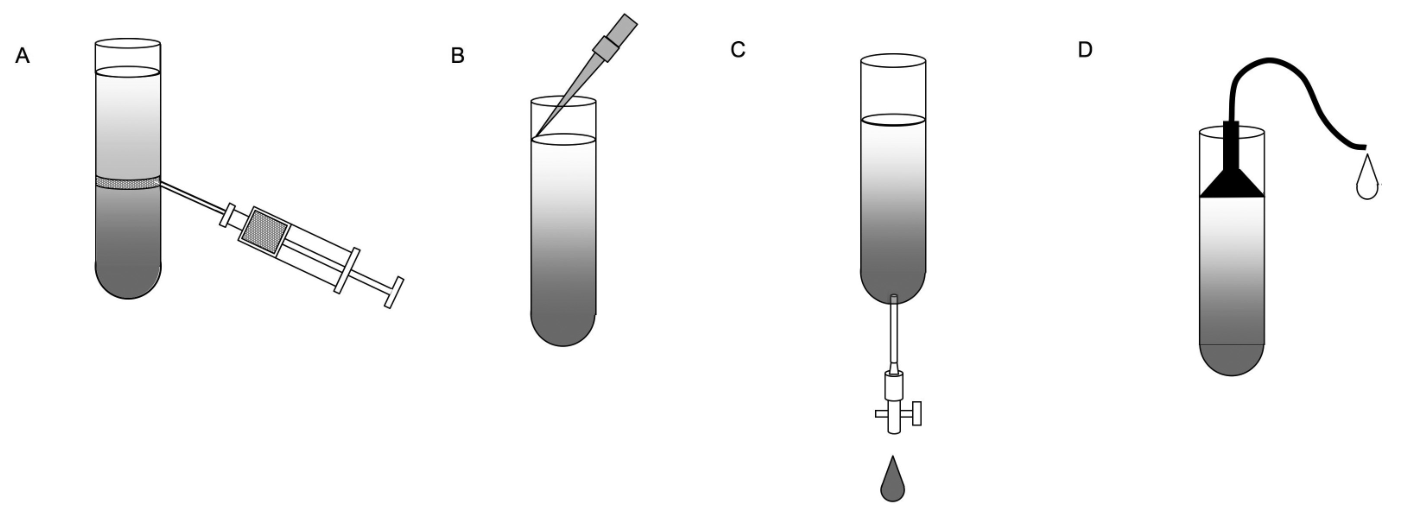
区带离心取样(梯度回收)
区带离心完成后会在离心管中形成区带,通过虹吸(下图 B 、 D,杂质较多)、穿刺(下图 A 、 C,离心管允许(透明,可刺穿))、切割离心管或从底部加入高密度介质顶浮的方法将不同区带中的微粒分开收集,得到所需的物质。
区带离心优缺点
优点
- 分离效果好,可一次获得较纯微粒
- 适应范围广,能象差速离心法一样分离具有沉降系数差的微粒,又能分离有一定浮力密度差的微粒
- 微粒不会挤压变形,能保持颗粒活性,并防止已形成的区带由于对流而引起混合
缺点
- 离心时间较长
- 需要制备惰性梯度介质溶液
- 操作严格,不易掌握。
差速区带离心
原理 :利用不同微粒间存在沉降速度差异(不需要像(粒子)差速沉降离心法所要求的那样大的沉降系数差),在一定的离心力作用下,使不同颗粒各自以不同的速度沉降,在密度梯度介质的不同区域上形成区带的方法称为差速区带离心法。差速区带离心法又称速率(度)区带离心、密度梯度离心等。
离心过程
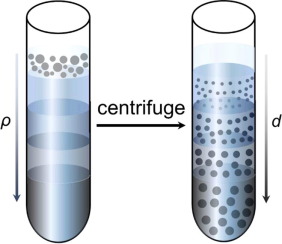
差速区带离心法是离心前在离心管内先装入密度梯度介质,待分离的样品铺在梯度液的顶部,同梯度液一起离心,最后按不同微粒沉降速度形成区带(下图)。
注意事项
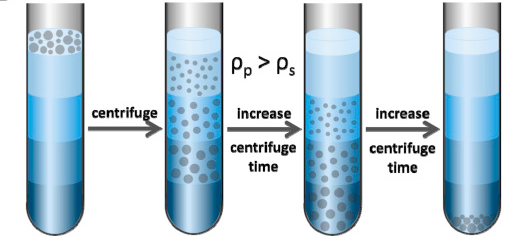
离心后在近旋转轴处的介质密度最小,离旋转轴最远处介质的密度最大,但最大介质密度( \(\rho_s\) )小于样品中微粒的最小密度( \(\rho_p\) )(使用最多的是蔗糖密度梯度系统,其适用范围是:蔗糖浓度 \(5\%\sim60\%\), 密度范围 \(1.02\sim1.30~g/cm^2\) ),也就是说只要时间足够,所有微粒都将沉淀(下图)。因此此离心法的关键是选择合适的离心转速和时间,即有足够的时间使各种粒子在介质梯度中形成区带,又要控制在任意一个粒子达到沉淀前。
也正是由于 \(\rho_s<\rho_p\) 或者说 \(\rho_s\neq\rho_p\),颗粒沉降的速度主要取决于它们的粒径而非密度(见 [斯托克斯定律](https://zh.wikipedia.org/wiki/ 斯托克斯定律),粒径是二次方对沉降速度的影响是二次方关系,只要密度差不等于零,粒径对沉降速度影响更大)。当区带中的颗粒向下移动通过密度介质时,移动速度较快的颗粒就会先于移动较慢的颗粒,从而形成含有类似大小颗粒的各个区带。个人认为,差速区带离心跟电泳有点像(从顶部开始,按大小分离,时间控制不好还可能跑到头 ... )。
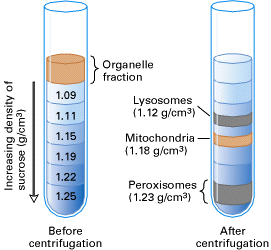
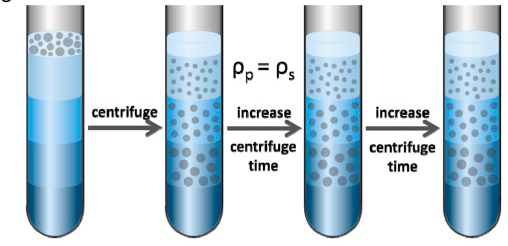
等密度区带离心
原理 :等密度区带离心亦称为浮力或平衡分离,在离心过程中,微粒仅基于它们的密度(或与介质的浮密度)分离,最终分配到与微粒密度相同的区带中。
离心过程
等密度区带离心按照是否自动形成梯度分为预形成梯度的等密度离心(下图左)和离心(自动)形成梯度的等密度离心(下图右)。预形成梯度的等密度离心在离心开始之前需要制备梯度密度液,并将样品加在顶部;离心形成梯度的等密度离心,样品微粒与密度梯度液均匀混合在一起,在离心力作用下,自动形成密度梯度,样品微粒在其中上浮或下沉,直到进入与其密度相同的周围介质(区带)中。离心形成梯度的等密度离心由于需要形成梯度密度,因此离心时间更长。
注意事项
等密度区带离心形成的区带,只与样品微粒的密度有关,而与粒子的大小和其他参数无关,因此只要转速、温度不变,则延长离心时间也不能改变这些粒子的成带位置(下图)。由于成带位置的稳定,等密度区带离心可用作分析用途。
等密度区带离心为了使所有微粒能够悬浮与介质的某一区带中,该介质必须能形成包含所有微粒密度的区带(介质的最高密度大于被分离组分的最大密度)。可以使用蔗糖溶液(用于纯化完整的细胞和细胞器)或溴化钠( NaBr )形成密度梯度。当需要更浓的梯度时(例如,在纯化 DNA 和 RNA 中),可以使用铯盐( CsCl 或 Cs2SO4 ( \(1.65g/cm^3 \sim 1.75g/cm^3\),\(\rho_{DNA} = 1.70g/cm^3\) ))。施加的离心力通常大于 15000 g。
差速区带离心与等密度区带离心的区别
差速区带离心与等密度区带离心容易混淆,需要注意区分。原理上,前者利用不同微粒大小和形状不同,因而沉降速度有不同来进行分离,可分离密度相近大小不同的微粒;后者利用前者利用不同微粒的密度不同,因而会集中在不同密度区带上来进行分离,可分离密度不同大小相近的微粒(下图)。
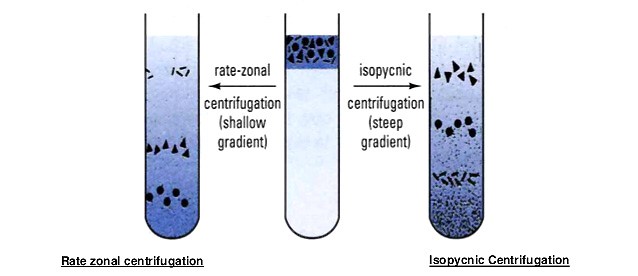
下表进行了更多总结。
| 差速区带离心 | 等密度区带离心 | |
|---|---|---|
| 应用 | 主要用于分离密度相近而大小不等的细胞或细胞器等 | 适用于分离大小相近,密度不等的核酸或细胞器等 |
| 介质密度 | 采用的介质密度较低,介质的最大密度应小于被分离生物微粒的最小密度,在十分平缓的密度梯度介质中按各自的沉降系数以不同的速度沉降而达到分离 | 采用的介质密度较高,介质的最大密度应高于被分离组分的最大密度,而且介质的梯度要求较高的陡度,不能太平缓 |
| 梯度形成 | 预先制备密度梯度 | 预先制备或离心形成密度梯度 |
| 离心条件 | 离心速度较低,离心必须在沉降最快的大颗粒到达管底前结束 | 所需离心力通常比差速一区带离心大10~100倍,离心时间也较长。各组分移动到与它们的密度恰好相等的位置上后结束 |
离心机及其配件
离心技术离不开 离心机 。 概念 :离心机是一种机械,可借由电动机或其他机械的带动而高速转动,产生数千倍于重力的离心力,以加快液体中颗粒的沉降速度,把样品中不同沉降系数和密度质量的物质分离。
离心机分类
按转速分类
-
低速离心机
低速离心机又称为常速离心机,其最大转速在 \(8000rpm\) 以内,相对离心力( RCF )在 \(15000g\) 以下,在酶的分离纯化过程中,主要用于细胞、细胞碎片和培养基残渣等固形物的分离,也用于酶的结晶等较大颗粒的分离。
-
高速离心机
高速离心机的最大转速为 \(1 \sim 2.5 \times 10^4 rpm\),相对离心力达到 \(1 \times 10^4 \sim 1 \times 10^5 g\),在酶的分离中主要用于沉淀、细胞碎片和细胞器等的分离。为了防止高速离心过程中温度升高造成酶的变性失活,有些高速离心机装设有冷冻装置,谓之高速冷冻离心机。
-
超速离心机
超速离心机的最大转速达 \(2.5 \sim 12 \times 10^4 rpm\),相对离心力可以高达 \(5 \times 10^5 g\) 甚至更高。超速离心主要用于 DNA 、 RNA 、蛋白质等生物大分子以及细
胞器、病毒等的分离纯化;样品纯度的检测;沉降系数和相对分子质量的测定等。为防温度过高,超速离心机均有冷冻温控系统;为减小空气阻力和摩擦,超速离心机均有真空系统,此外超速离心机还有一系列安全系统。
按其他分类
-
按温度控制:常温和冷冻离心机
冷冻离心机十分常见, “为什么一些离心机需要温控系统” 这个问题可以从两方面回答:
-
一是离心机高转速运行时的转子体与空气摩擦生热导致机身温度不易控制,过高温度影响离心机内部元件的使用寿命。这也就是冷冻离心机和普通离心机的区别,冷冻离心机使用制冷系统,能够控制温度保护机器元件,普通离心机不带制冷系统。
-
二是根据用户实验要求,必须配有低温控制系统,比如分离一些有机活性物质:酶,有机易挥发的物质等需要恒温或是温差不超过 \(\pm\) 10 ℃。来保证实验条件满足实验设计需要,确保实验顺利进行。正是如此,有关生化的离心中最常使用(高速)冷冻离心机。
-
-
按摆放方式:落地式离心机(立式离心机)和台式离心机(桌面式离心机)
-
按容量有分为:超大容量离心机、大容量离心机、小容量离心机、微量离心机
-
按用途:分析型离心机、制备型离心机、细胞涂片离心机、血液洗涤离心机、连续离心机……
离心机结构
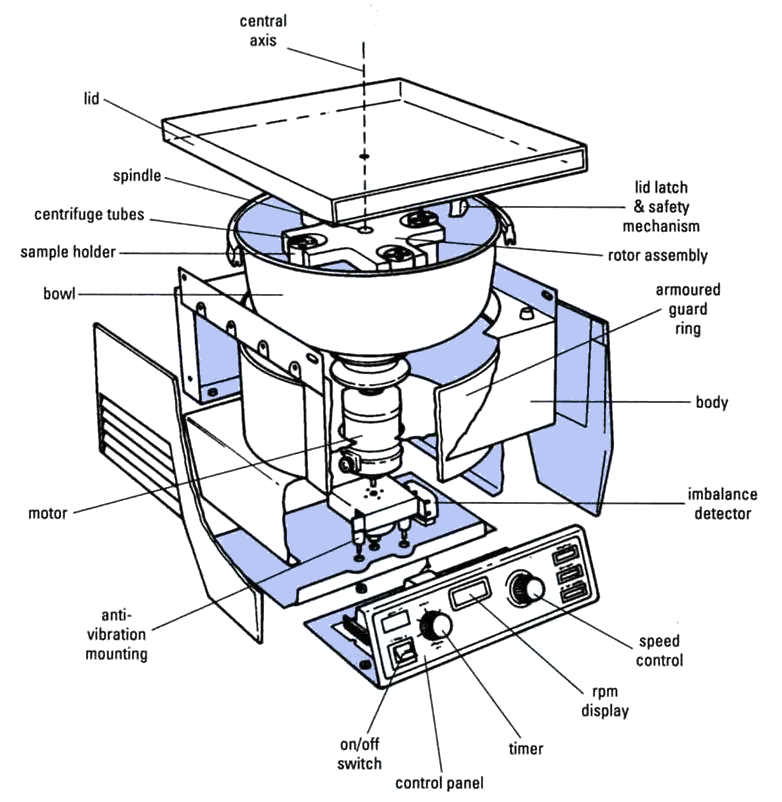
上图是一个简单的离心机结构图,包括了转子、驱动系统( motor )、控制系统( speed control, timer )和防护装置( anti-vibration mounting ),离心机根据其功能用途还可以增加温控系统、真空系统、安全系统、光学检测系统等。
离心机转子
转子(转头)是离心机的主要配件。简单的说,可以将离心机分为主机和可拆卸的转子两部分,一个多功能主机通常可以配多个转子,靠不同型号的转子来满足不同的需要来实现其“多功能”的。离心机转子按照功能和工作方式主要分为角转子、水平转子、垂直转子、区带转子和连续流动转子。此外按照材质可分为铝合金转子、钛合金转子、塑料转子、碳纤维转子等。
角转子

角式转子是指离心管腔与转轴成一定倾角的转子(上图),主要用于分离沉降速度有明显差异的颗粒样品(固液分离)。它是由一块完整的金属制成的,其上有 4 ~ 12 (或更多)个装离心管用的机制孔穴,即离心管腔,孔穴的中心轴与旋转轴之间的角度在20 ~ 40度之间,角度越大沉降越结实,分离效果越好。这种转子的优点是具有较大的容量,且重心低,运转平衡,寿命较长,可以使用较高的转速。
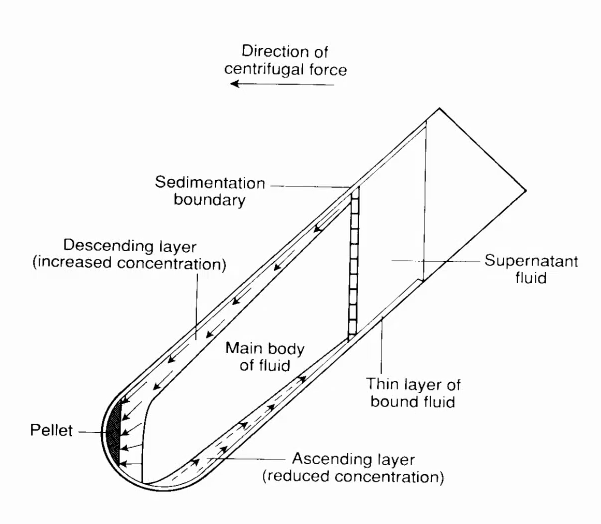
离心过程
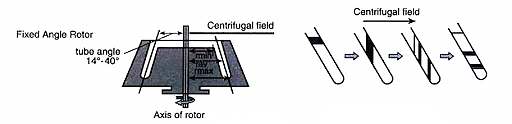
颗粒在沉降时先沿离心力方向撞向离心管,然后再沿管壁滑向管底,因此管的一侧就会出现颗粒沉积,此现象称为“壁效应”。壁效应因此这种转子能很快地收集沉淀物,但是壁效应施加的力可能会是某些容易生物大分子变性,还容易使沉降颗粒受突然变速所产生的对流扰乱(如下图),对具有相同沉降速率的颗粒会产生不良影响。同时当介质选择不当时,待分离微粒与管壁接触就被吸附,黏附作用有时很强,难以清洗(如 BSA 引起的细胞黏附)。
转子的盖子
用于高速及以上的离心转子通常配有盖子,盖子有助于减少摩擦、降低噪音、保持气密性和防止意外,因此离心时转子一定要盖盖,如未盖,不仅会产生安全隐患,同时离心腔内会产生很大的涡流阻力和摩擦升温,这等于给离心机的电机和制冷机增加了额外负担,影响离心机的使用寿命。
水平转子(甩平转子)

这种转子是由吊着的 4 或 6 个自由活动的吊篮(离心套管)构成(上图)。这种转子常用做差速和密度梯度区带离心,其优点是梯度物质可放在保持垂直的离心管中,离心时被分离的样品带垂直于离心管纵轴,而不像角式转子中样品沉淀物的界面与离心管成一定角度(即壁效应小),因而分辨能力高,分离后组分的区带较宽,便于回收。其缺点是颗粒沉降距离长,离心所需时间也长,且因为不如固定角转子稳固,水平吊篮最高转速相比固定角转子要低很多,限于低速离心的范围。
吊篮有不同的适配器,可以放置各种类型的离心管,甚至满足平板离心的需要。
离心过程
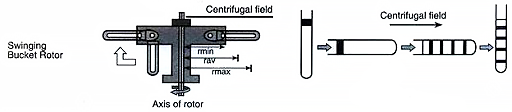
当转子转速超过 600rpm 后离心管达到水平位置,样品沉降方向是沿离心管轴向移动,最后沉降在管底,便于收集(上图)。
垂直转子

其离心管是垂直放置(上图),样品颗粒的沉降距离最短,离心所需时间也短,适合用于短时间作密度梯度离心。其缺点是离心后样品组分的区带较宽,但因离心时间短,粒子得不到充分分离,将会失去一些组分,又因区带与梯度介质的接触面大,易于扩散,停机后密度重新定向,易于混合,所以作区带离心的效果,垂直转子不于甩平转子。
离心过程
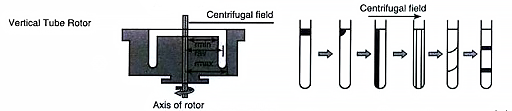
垂直转子分离的粒子位移距离等于离心管直径。转子转动前,管内密度梯度溶液的密度是沿重力方向变化,转动后,溶液的密度逐渐改变为离心力方向(水平方向)变化(对离心管密封性要求高),离心结束后,溶液的密度变化方向因重力作用又沿重力方向变化,因而降速要慢,最后形成重力方向的密度梯度(上图)。
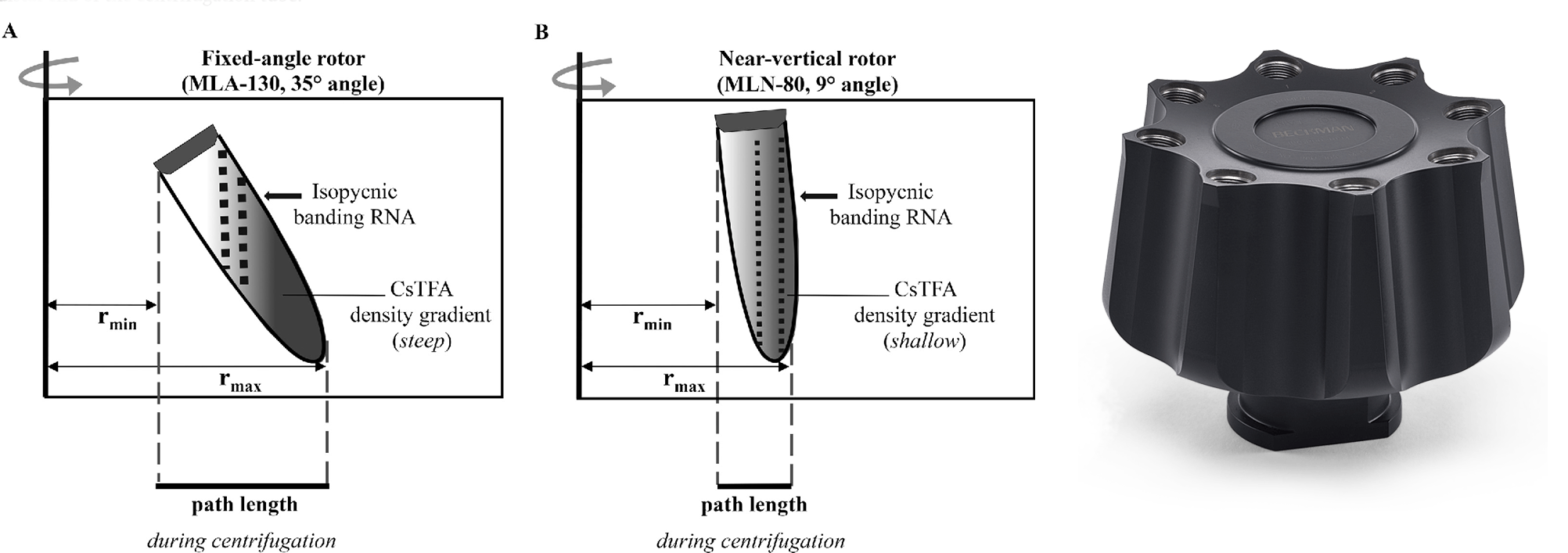
近垂直转子
此外还有一种介于角转子与垂直转子的转子——近垂直转子,其离心管与旋转轴成 7 ~ 10 度,也可用于梯度离心。
区带转子

区带转子无离心管,主要由一个转子桶和可旋开的顶盖组成,转子桶中装有十字型隔板装置,把桶内分隔成四个或多个扇形小室(上图),隔板内有导管,梯度液或样品液从转子中央的进液管泵入,通过这些导管分布到转子四周,转子内的隔板可保持样品带和梯度介质的稳定。
区带转子按照结构和工作特点分为重定向区带转子和动态卸载(旋转密封)区带转子。
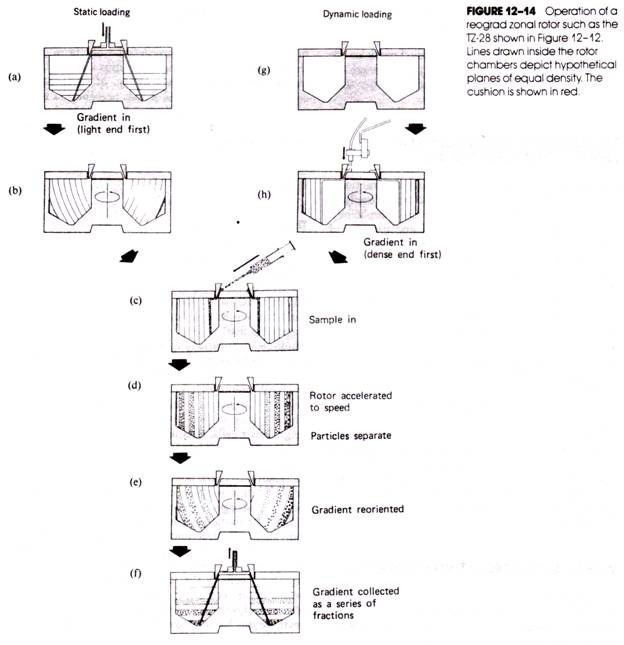
重定向区带转子
离心过程
重定向区带转子离心过程如下图所示。( a-b )和( g-h )表示制备梯度过程,前者是在转子静止下制备梯度(从下到上,密度由高到低),之后转子旋转使梯度方向垂直转轴;后者是在转子旋转时制备梯度(从外到内,密度由高到低)。( c )为上样,之后的( d )转子开始加速,区带离心开始。( e )表示了转子减速时区带的重定向,类似垂直转子。( f )表示取样,重定向区带转子离心的取样只能在转子静止时进行。
动态卸载(旋转密封)区带转子
连续流动转子与区带转子类似,但是有特殊的管道(中心和边缘管道)和连接部件(下图),保证可以在转子旋转时进行所有离心操作。
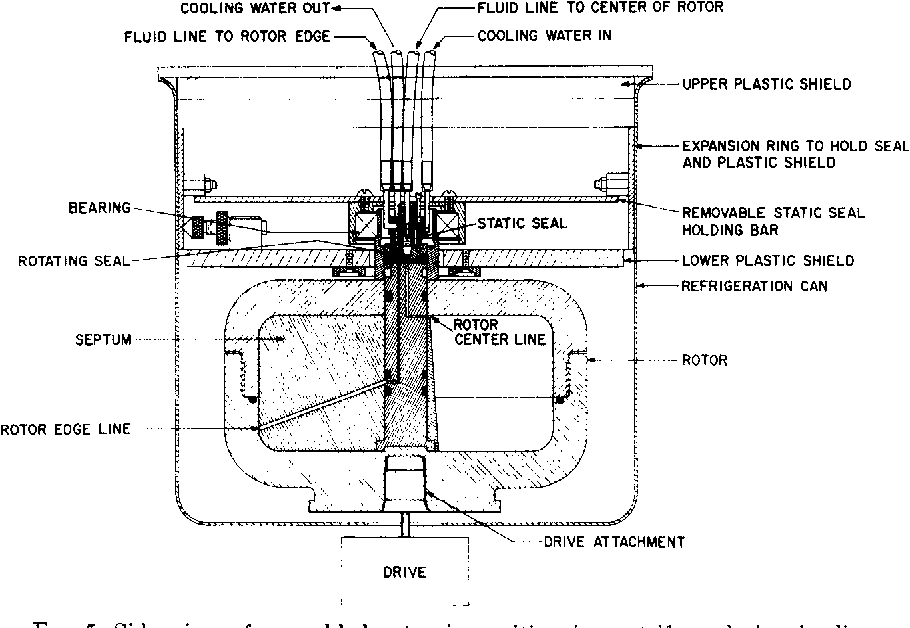
离心过程
动态卸载(旋转密封)区带转子离心过程如下图所示。( a )表示制备密度梯度,梯度液从边缘(远端)管道进入,在密度梯度完成后,加入高密度的介质(垫层)( b ),可以把一些轻的梯度液排出。样品从中心(近端)管道加入( c ),之后再加入密度较小的介质(覆盖层),以将样品推离中轴。现在将加样的密封组件和输液管移开,盖上转子盖,加快转速( e ),离心结束后,从边缘管道加入高密度介质,从中心管道依次收集分离组分( f )。
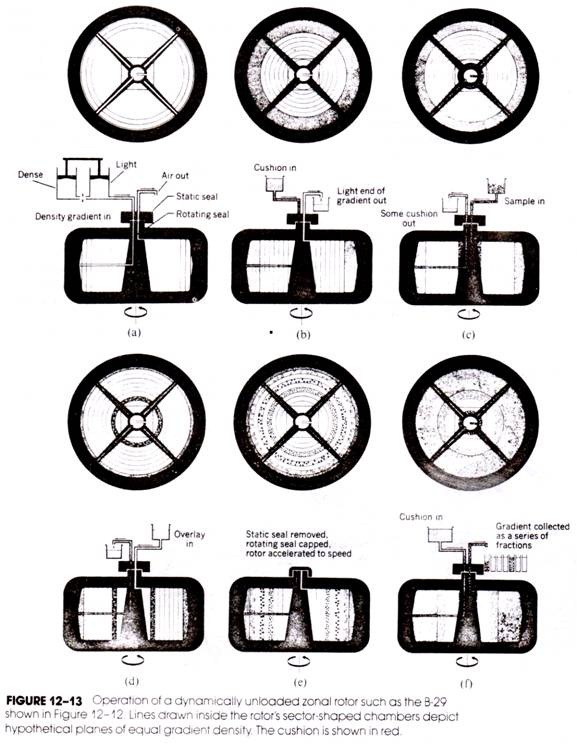
区带转子优缺点
其优点是在径向的散射离心力作用下,颗粒的沉降距离不变,因此区带转子的“壁效应”极小,可以避免区带和沉降颗粒的紊乱,分离效果好,而且还有转速高,容量大,回收梯度容易和不影响分辨率的优点,使超离心用于制备和工业生产成为可能。区带转子的缺点是样品和介质直接接触转子,耐腐蚀要求高(因此有钛合金材质),操作复杂。
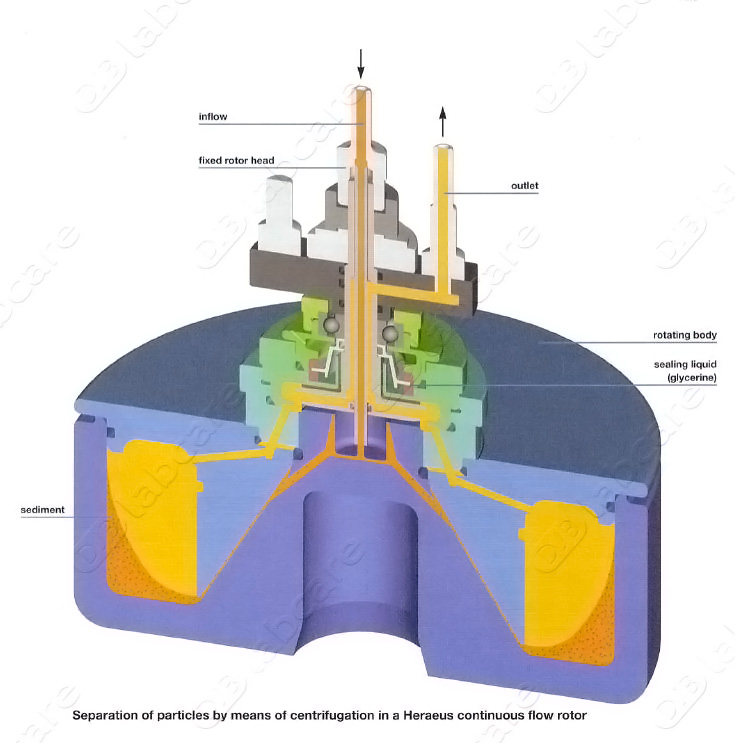
连续流动转子
由转子桶和有入口和出口的转子盖及附属装置组成,离心时样品液由入口连续流入转子,在离心力作用下,悬浮颗粒沉降于转子桶壁,上清液由出口流出(下图)。

离心过程
利用连续流动转子进行分离作业又叫离心淘析技术。
连续流动转子主要用于悬浮介质中高速分离较小的颗粒物质,如在培养基中分离细胞,在运转过程中,悬浮样品以一定速度从转子体中心流入离心池,由于溶液中的组分轻重不同,在离心力场作用下,重粒子具有较大的惯性离心力、沉降快,当流速增大(降低)到一定值时,重粒子将留在离心池外缘底部,而介质将从出口流出并带走较轻的粒子,收集组分的方法是把组分冲洗出离心池或者留在转子体内(下图)。
连续流动转子特点
连续流动转子能在无菌和低温条件下,使被分离的组分保持活性,还有回收率高、能连续作业等优点。如果液流方向与离心力方向相反,即降低了粒子运行速度,相当于增长了运行距离,从而提高了分辨能力。
离心管
离心管也是离心机的配件,除了区带转子和连续流动转子,其他转子都需要离心管。离心管作为承载样品和介质的容器,不仅材质多样化,容量大小更是覆盖广泛,以供不同的转子和离心机来使用。离心管主要分为以下几类:
- 按材质可分:塑料离心管、玻璃离心管和不锈钢离心管等(下图)

-
塑料离心管:其常用材料有聚乙烯( PE )、聚碳酸酯( PC )、聚丙烯( PP )等,其中 PP 管性能较好
- 优点:可一次性,透明(或半透明),硬度小,可用穿刺法取出梯度
- 缺点:易变形,抗有机溶剂腐蚀性差,使用寿命短
- 离心管盖作用:防止样品外泄挥发和支持离心管,防止离心管变形
-
玻璃离心管:耐腐蚀,它们可以像其他实验室玻璃器皿一样进行清洁,并可通过高压灭菌进行灭菌。使用时离心力不宜过大,要垫橡胶垫或套软橡胶套管,防止管子破碎,高速和超高速离心时一般不选用玻璃管
-
不锈钢离心管: 管强度大,不变形,能抗热,抗冻,抗化学腐蚀。
注意:避免接触强腐蚀性的化学药品,如强酸、强碱等
-
按速度可分:低速离心管和高速离心管
-
按容量可分:微量离心管、小容量离心管和大容量离心管。一般称容量大于 100mL 的离心管为离心瓶(下图)

- 按离心管口部形状可分:缩口离心管和直口离心管(下图)

-
按离心管底部形状可分:圆底离心管、尖底离心管和平底离心管
-
按离心管与盖接合形式可分:摁盖离心管和螺口离心管(下图)

- 按用途可分:制备型离心管和分析型离心管
参考资料:
Centrifuge: Introduction, Types, Uses and Other Details (With Diagram)
Density Gradient Centrifugation
Density gradient centrifugation
Separation of colloidal two dimensional materials by density gradient ultracentrifugation
Overview of Continuous Flow Centrifugation
Zonal Centrifugation: Dynamically Unloaded, Zonal Rotors and Reograd Zonal Rotors
本文使用署名-非商业性使用-禁止演绎 (CC BY-NC-ND) 协议来声明版权,是一个关于生物技术的小作品,如有错误之处欢迎指出。


 浙公网安备 33010602011771号
浙公网安备 33010602011771号