CTM | 大连医科大学附属第二医院王琪团队报道肺癌脑转移化疗耐药新机制
肺癌是全球最常见的恶性肿瘤之一,转移是肺癌患者死亡的最主要原因,其中脑是肺癌最常见的远处转移部位,约40%-50%的肺癌患者会发生脑转移,由于治疗手段的限制,肺癌脑转移患者的预后极差。以铂类为主的化学治疗是临床可有效控制原发性肺癌病变的治疗手段,然而它对肺癌脑转移瘤的治疗效果却十分有限,其背后原因尚不明晰。肺癌细胞在历经一系列复杂的脑转移级联过程后自身会发生蛋白、代谢水平的重编程以适应转移新微环境,基于组学手段全面揭示这些内源性改变有助于寻找肺癌脑转移对化疗反应差的原因。
近日,大连医科大学附属第二医院呼吸内科王琪教授团队在学术期刊Clinical and translational Medicine(IF:11.492)上发表论文题为 “Glutathione peroxidase 4-dependent glutathione high-consumption drives acquired platinum chemoresistance in lung cancer-derived brain metastasis” ,该研究首次揭露肺癌脑转移细胞对化疗耐受的内在原因,有望为临床肺癌脑转移患者提供新的治疗策略。

该研究利用肺腺癌细胞PC9构建临床前肺癌脑转移模型,发现脑转移细胞亚群 (PC9-BrMs) 相比亲本PC9细胞对铂类的药物敏感性显著下降,提示脑转移细胞的内在变化是引起脑转移获得性化疗耐药的主要原因。研究进一步运用代谢组学和蛋白质组学技术对脑转移亚群细胞的蛋白表达谱和代谢谱进行了全面描绘。研究发现肺癌脑转移呈现以谷胱甘肽(GSH)高消耗为特点的独特代谢状态,蛋白组学分析证实这种代谢状态是由肺癌脑转移细胞中显著上调的GPX4和GSTM1蛋白引起,GPX4和GSTM1通过消耗谷胱甘肽抑制细胞铁死亡从而导致脑转移细胞对化疗药物敏感性降低(图1)。景杰生物为该研究的蛋白质组学定量分析提供技术支持。
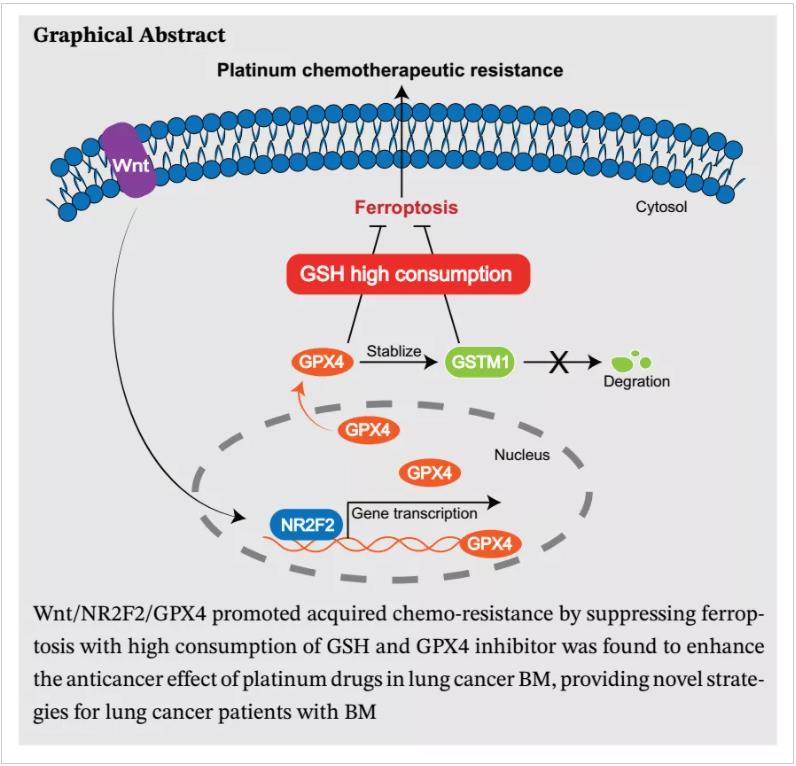
图1. 肺癌脑转移细胞铂类化疗耐药机制示意图
1 肺癌脑转移细胞对铂类的药物敏感性下降
研究人员通过将肺腺癌细胞PC9对免疫缺陷小鼠进行心内注射构建肺癌脑转移动物模型,然后通过三次“心内注射-离取脑转移瘤-肺癌脑转移细胞原代培养-心内注射”循环不断富集肺癌脑转移特性,获得具有不同程度脑转移能力及富集特性的脑转移亚群细胞(图2)。体内外药物敏感性实验发现脑转移细胞亚群 (PC9-BrMs) 相比亲本PC9细胞对铂类的药物敏感性显著下降,提示脑转移细胞的内源性变化是引起脑转移获得性铂类化疗耐药的主要原因。
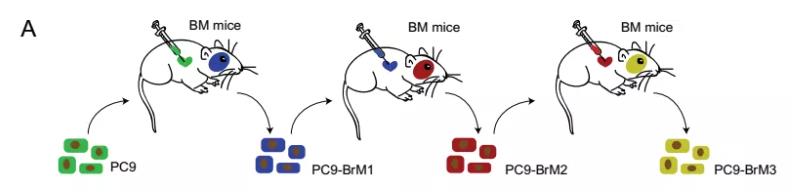
图2. 临床前肺癌脑转移模型构建示意
2 代谢组学揭示肺癌脑转移细胞内源性代谢重编程
研究者对亲本细胞PC9及肺癌脑转移细胞亚群 (PC9-BrM1,PC9-BrM2,PC9-BrM3)开展了基于气相色谱质谱 (GC-MS) 的代谢组学分析,对肺癌脑转移细胞的代谢特征进行全面描述。结果发现肺癌脑转移细胞亚群的代谢轮廓与亲本细胞相比发生了显著的改变,进一步分析发现肺癌脑转移细胞呈现以谷胱甘肽(GSH)高消耗为特点的独特代谢状态(图3),这一状态与其获得性铂类化疗耐药息息相关。
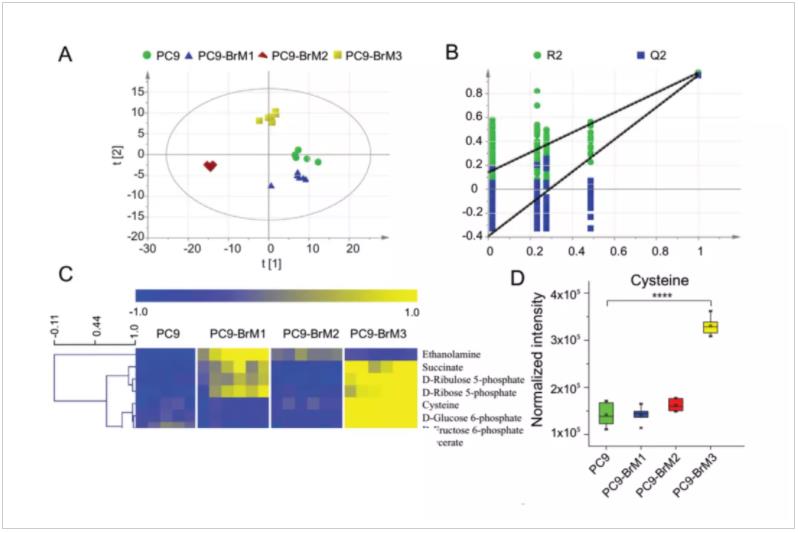
图3. 肺癌脑转移细胞代谢组学特征
3 蛋白质组学锁定内在机制
为了追溯肺癌脑转移谷胱甘肽(GSH)高消耗的内在机制,作者应用TMT标记蛋白质组学定量技术(质谱策略)对亲本细胞PC9及肺癌脑转移细胞亚群 (PC9-BrM1,PC9-BrM2,PC9-BrM3) (样本策略)进行蛋白组定量分析,并将蛋白组学与代谢组学数据进行联合分析(图4),锁定肺癌脑转移谷胱甘肽(GSH)高消耗状态是由肺癌脑转移细胞中显著表达上调的GPX4和GSTM1蛋白导致。体内外验证最终证实GPX4和GSTM1通过消耗谷胱甘肽抑制细胞铁死亡从而导致脑转移细胞对化疗药物敏感性降低的内在机制。
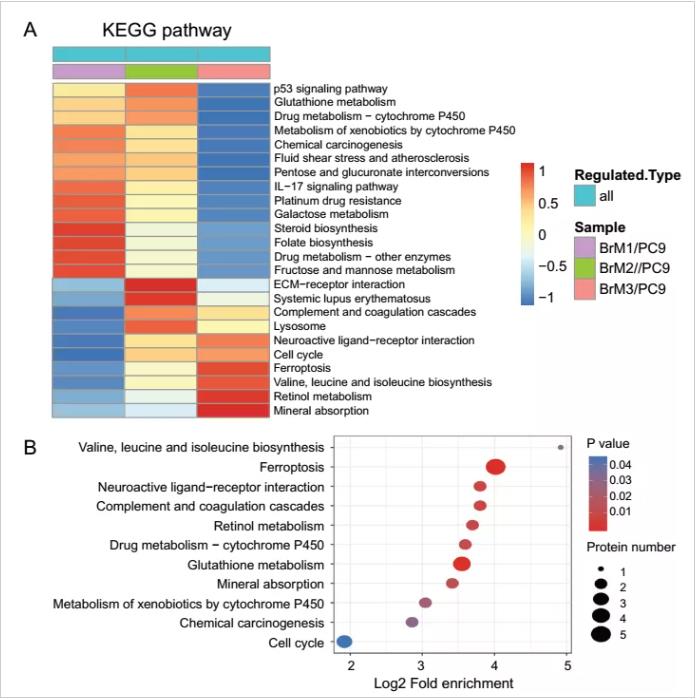
图4. 肺癌脑转移细胞蛋白组学特征
随着越来越多研究证实表观遗传学在肿瘤进展中的重要作用,蛋白组学和代谢组学已成为揭示肿瘤细胞转录后调控的有力手段,更深入的探索肿瘤生物学行为机制。一方面,代谢组学可以为蛋白质组学数据的功能解释提供信息,另一方面,蛋白质组学则通过突出显示参与的酶或酶促途径揭示代谢组学的内在原因。本文首先利用代谢组学对肺癌脑转移细胞的代谢特点进行特征分析,发现肺癌脑转移中谷胱甘肽高消耗的代谢状态,进一步蛋白质组学研究对该代谢状态背后的内在机制进行探索,这为组学技术应用于肿瘤生物学行为分子机制的阐明提供了成功的示例。
作者介绍
王琪教授:大连医科大学附属第二医院副院长,呼吸内科二级教授,博士生生导师,国务院特殊津贴专家、辽宁省呼吸内科重点学科带头人、辽宁省特聘教授、辽宁省教学名师、辽宁省优秀专家、大连市首批领军人才,大连市第六批优秀专家。中华医学会呼吸分会肺癌学组委员,中国医师协会呼吸病学分会委员,中国肺癌防治联盟肺癌早期诊断副主任委员,辽宁省医学会呼吸分会副主任委员,辽宁省肺癌转化医学研究中心主任、辽宁省肺癌重点实验室主任,辽宁省肺癌研究工程实验室主任。长期从事肺癌基础和临床方面的研究,在国内外率先将微流控芯片技术——这一具有高通量、集成化、微型化优势的技术平台应用于肺癌的基础与临床研究,开创了该技术与肺癌诊疗结合的先河,并应用于肺癌临床诊断和治疗领域。近年来以课题组长的身份主持并承担国家重大科研仪器研制项目、国家863计划项目、国家自然科学基金重点项目、国家自然科学基金重大研究计划项目及面上项目等国家级项目多项,获中华医学科技奖、教育部科技进步奖、辽宁省科技进步奖及大连市科技进步奖等多项,取得发明专利5项,实用新型专利1项,以第一作者或责任作者发表学术论文100多篇,50多篇发表于国际杂志(被SCI收录),包括J Thorac Oncol, Biomaterials,ACS Applied Materials &Interfaces,Lab chip 等国际著名期刊。
参考文献
Liu W, et al., 2021, Glutathione peroxidase 4-dependent glutathione high-consumption drives acquired platinum chemoresistance in lung cancer-derived brain metastasis. Clin Transl Med.


 浙公网安备 33010602011771号
浙公网安备 33010602011771号