哈医大:蛋白质组学二连发,揭示胃癌发展新机制及潜在治疗靶点

景杰生物 | 报道
胃癌(Gastric cancer, GC)是世界上死亡率第三高的癌症,关于抗肿瘤治疗策略,不仅只针对肿瘤细胞本身,还可放眼于整个肿瘤微环境。中性粒细胞外捕网(Neutrophil extracellular traps, NETs)是中性粒细胞发挥作用的一种特殊方式,在促进胃癌进展中发挥重要作用,但其是否能诱导胃癌血管形成尚不完全清楚。
近日,来自哈尔滨医科大学附属第二医院杨士凤医师团队在国际专业学术期刊Cell communication and signaling(JCR Q1区)、Frontiers in immunology(JCR Q1区)接连发表研究成果,运用蛋白质组学技术阐明了NETs对胃癌血管生成的作用及机制,进一步探索NETs促进癌症进展的方式,为实现更好的临床诊治提供理论基础。景杰生物为该研究提供了蛋白质组学技术支持。
Cell Commun Signal | 蛋白质组学揭示胃癌血管形成机制
胃癌是一种常见的恶性肿瘤,目前已经使用了抗血管生成治疗,但由于药物抗性的存在,疾病的发生仍然很常见。中性粒细胞通过NETs在癌症中发挥着重要作用。然而,其对血管生成的调节机制还知之甚少。
研究团队使用蛋白质组学技术,筛选了NETs刺激原代人脐静脉内皮细胞(HUVECs)时的差异表达的蛋白质,最终揭示了NETs可促进胃癌血管的生成,相关研究成果以“Neutrophil extracellular traps promote angiogenesis in gastric cancer”为题发表在Cell Communication and Signaling杂志上。

研究者使用多重荧光免疫组化技术分析了患者组织样本中NETs和微血管的空间分布。通过建立小鼠皮下肿瘤模型,确定了NETs对肿瘤生长的影响:研究发现阻断NETs,与微血管密度的减少相关,与对照组相比,抑制组的小鼠肿瘤体积和质量分别减少了61.3%和77.9%,说明其可以显著抑制小鼠皮下肿瘤模型。通过免疫组织化学染色观察到了微血管密度的变化。
为了探究NETs对HUVECs的具体影响,研究者对未刺激的HUVECs和经NETs刺激的HUVECs进行了基于质谱的蛋白质组学分析,在NETs刺激组中观察到123个上调蛋白质和73个下调蛋白质。
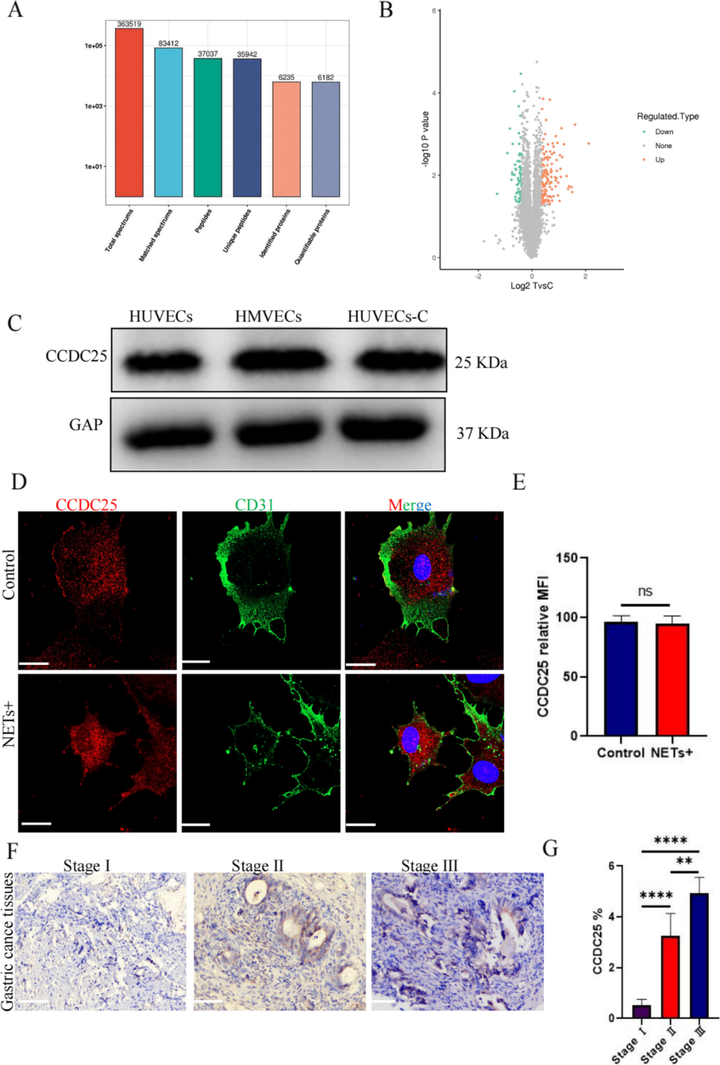
图1 NETs刺激诱导的差异蛋白表达的蛋白质组学分析
此外,研究者发现NET-DNA受体CCDC25在HUVECs中表达,促进HUVECs增殖、迁移和管状形成。在体外大鼠主动脉外植模型中,发现NETs诱导了HUVECs的增殖、存活和趋化作用,与VEGF刺激组观察到的效果没有显著差异。以上研究结果证实了NETs在胃癌中促进血管生成的作用,为寻找新的抗血管治疗靶点提供了理论依据。
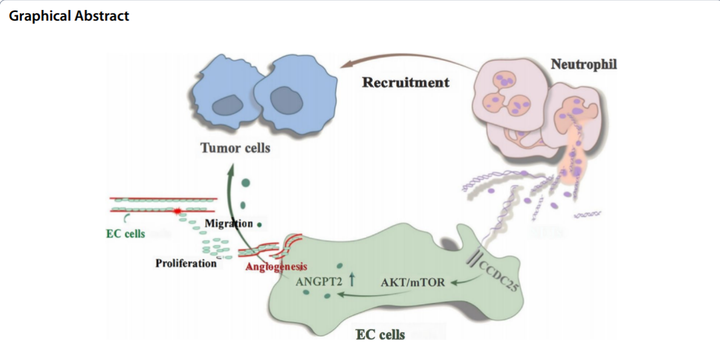
图2 本文研究模式图
Front Immunol | 蛋白质组学揭示胃癌潜在治疗靶点
尽管胃癌(GC)的研究取得了诸多进展,但临床上仍缺乏可靠的胃癌诊断蛋白质标志物。NETs是由由活化的中性粒细胞分泌,由DNA纤维、组蛋白和抗菌蛋白组成的网状结构。之前有研究报道,GC组织中存在大量的NETs沉积,会破坏HUVECs并刺激释放组织因子,最终导致GC的高凝状态。然而,NETs对HUVECs的具体影响尚不清楚。
研究者使用蛋白质组学技术,检测了NETs刺激的HUVECs中的差异表达蛋白。后续,研究者使用平行反应监测(PRM)分析对其所选定的17个蛋白进行表达验证,并最终确定ANGPT2作为靶蛋白,并揭示了其参与免疫肿瘤应答响应的机制,并暗示其可能是抗肿瘤治疗的新靶点。上述研究结果以“Immunoregulation and clinical significance of neutrophils/NETs-ANGPT2 in tumor microenvironment of gastric cancer”为题发表在Frontiers in Immunology杂志上。

研究者首先通过免疫荧光染色发现GC组织比相邻组织有更多的NETs沉积,且NETs可以增强HUVECs的血管生成能力和损伤因子vWF的表达。研究者对GC组织以及相邻组织进行了基于质谱的蛋白质组学分析,并结合后续机器学习及相关文献,最终锁定了包括ANGPT2在内的17个差异蛋白,并使用PRM技术对蛋白表达进行验证。上述研究结果显示,这些蛋白在NETs刺激组中表达显著上调。
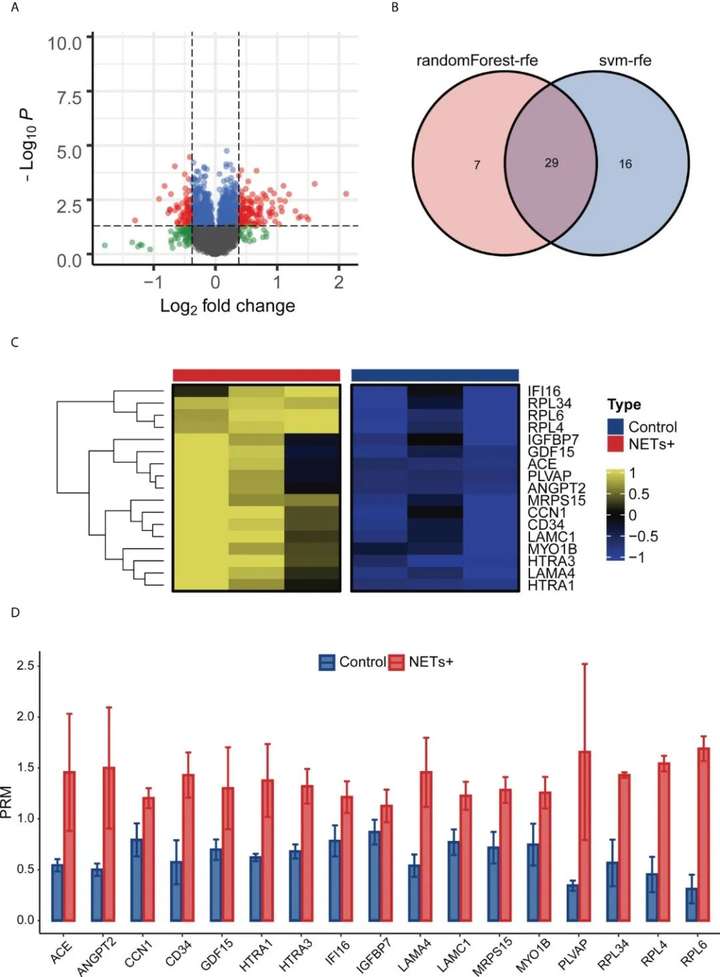
图3 基于质谱分析数据和PRM分析筛选ANGPT2
研究者基于TCGA数据库进行了分析,发现ANGPT2在GC组织中的表达明显高于癌旁组织和正常组织,且ANGPT2可以作为GC的独立预测因素。GSVA分析进一步发现ANGPT2与许多重要的肿瘤相关通路相关,如p53信号通路、DNA损伤反应信号转导调控、JAK-STAT信号通路、参与血管生成的细胞迁移等。此外,研究者还发现ANGPT2参与免疫应答相关过程,如T细胞受体信号通路和白细胞跨内皮迁移。因此,ANGPT2的高表达可以激活多种肿瘤相关通路和免疫反应,表明ANGPT2在胃癌的发生发展中起重要作用。
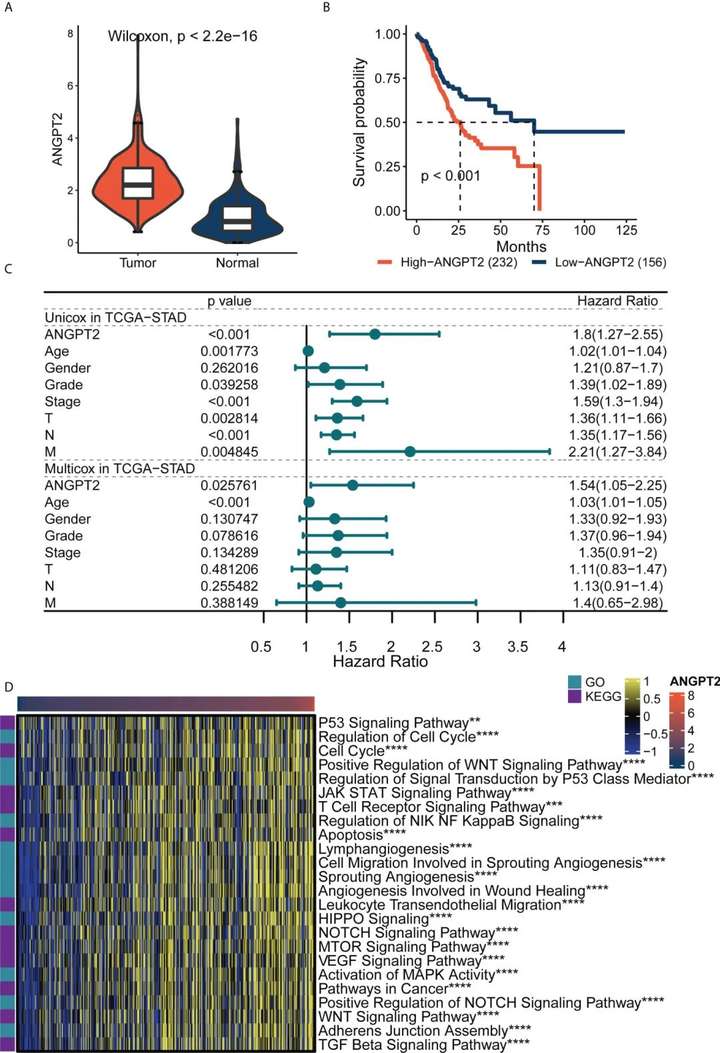
图4 ANGPT2基因在TCGA-STAD中的作用
研究者通过ESTIMATE分析发现,ANGPT2高表达组的免疫和间质评分显著升高,这意味着患者预后效果较差。通过分析ANGPT2表达与中性粒细胞浸润的相关性,研究者发现ANGPT2的高表达与巨噬细胞M0、NK细胞静息和肥大细胞活化存在显著的相关性,表明ANGPT2参与了胃癌免疫微环境的调控。
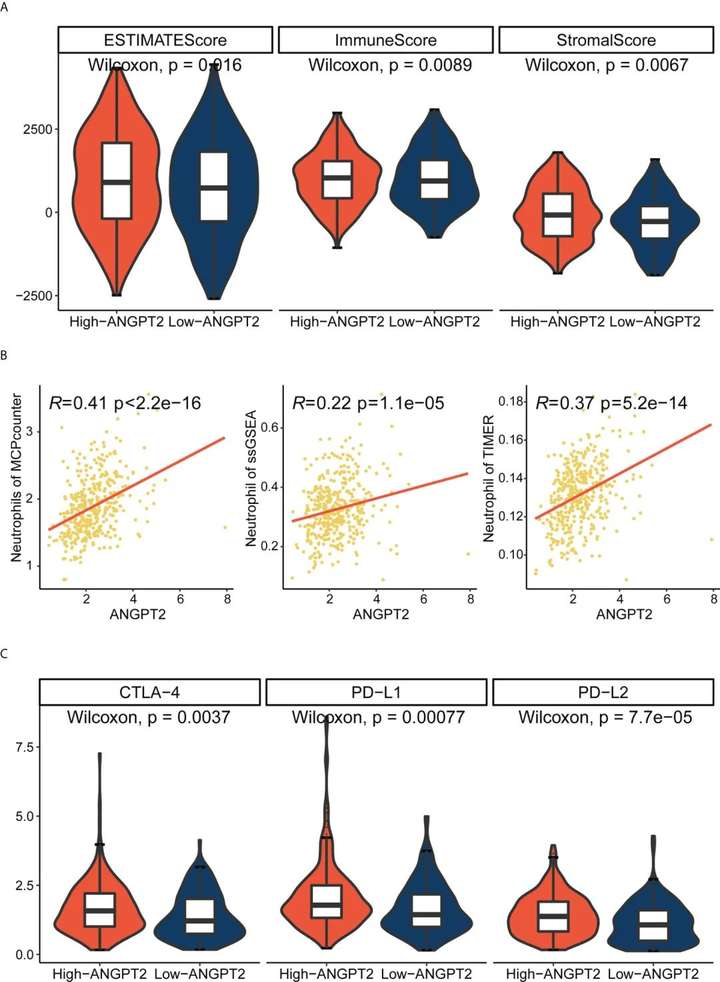
图5 ANGPT2与免疫特征的相关性
为进一步确定ANGPT2的免疫治疗效应,研究者使用GDSC数据库评估了高ANGPT2组和低ANGPT2组的化疗药物反应。结果发现ANGPT2高表达组对雷帕霉素等化疗药物的敏感性较低,说明ANGPT2低表达的患者可能会有更好的化疗效果。此外,研究者发现ANGPT2在胃癌患者癌组织中的表达高于癌旁组织。ANGPT2在II/III期患者中的过表达高于I期患者。同时,用NETs刺激HUVECs后,研究者发现ANGPT2表达明显升高。
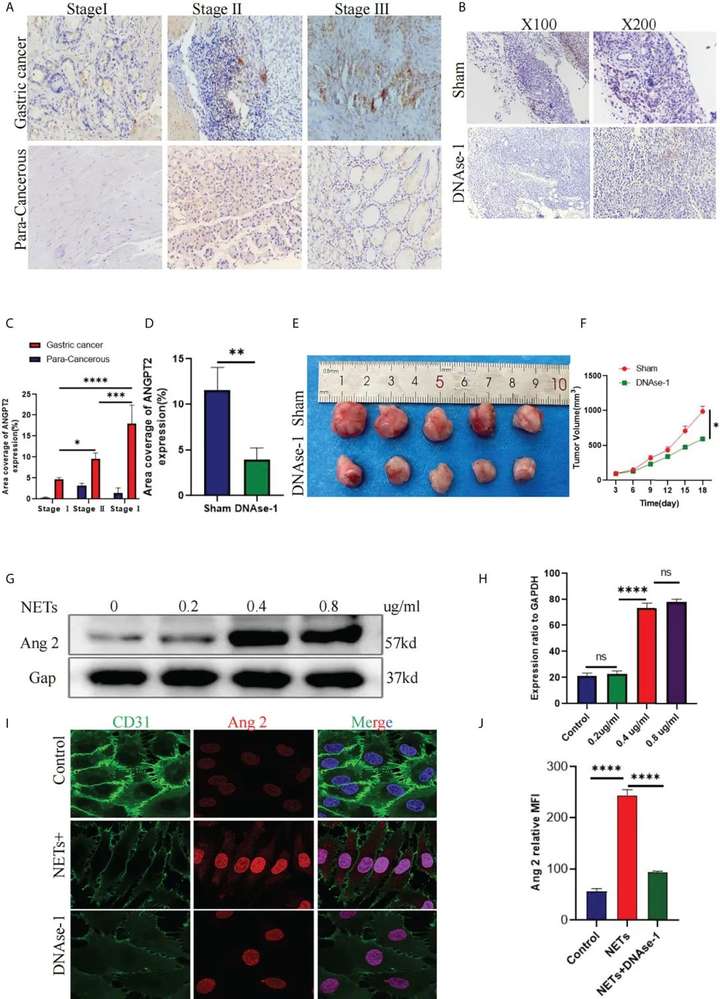
图6 NETs刺激HUVECs中ANGPT2的表达
综上所述,研究者通过蛋白质组学技术、生物信息学方法、PRM验证以及后续的相关分子实验鉴定并验证了NETs可促进胃癌血管的形成。此外,研究者发现NETs可以上调HUVECs中ANGPT2的表达,且ANGPT2可参与肿瘤免疫应答,与胃癌不良预后相关,还能预测胃癌的化疗反应。该研究揭示了靶向中性粒细胞/NETs-ANGPT2可能是未来抗胃癌治疗的新靶点。
景杰生物作为蛋白质组学的行业领跑者,拥有最齐全、最领先、最高质量的4D蛋白组学产品线,包括高通量4D-SmartDIA蛋白组、高深度4D-FastDIA蛋白组、血液蛋白质组、微量蛋白组、空间蛋白组学、单细胞蛋白组学等。4D蛋白组学平台在4年间累计完成数万个项目超十万例样品的检测,项目成果接连见刊于Nature, Cell Research,Cancer Cell, Molecular Plant等国际著名期刊,涵盖医学、动植物学等各领域,助力客户产出高水平科研成果,值得您信赖!
参考文献
1. Yang S, et al. 2023. Neutrophil extracellular traps promote angiogenesis in gastric cancer. Cell Commun Signal. 2. Yang S, et al. 2022. Immunoregulation and clinical significance of neutrophils/NETs-ANGPT2 in tumor microenvironment of gastric cancer. Front Immunol.
景杰生物作为修饰组学领域的领跑者,拥有多种修饰抗体和修饰组学质谱检测服务。如果您想了解相关产品和服务的更多信息,请扫描下方二维码填写合作咨询表单、或咨询景杰生物销售工程师、或拨打科服热线400-100-1145。如有转载、投稿等其他合作需求,请在文章下方留言,或添加微信ptm-market咨询



 浙公网安备 33010602011771号
浙公网安备 33010602011771号