修饰家族大揭秘 | 第一期:够强!够新颖!氧化还原修饰
蛋白质氧化还原修饰是指通过改变蛋白质分子内部的氧化还原状态来调节蛋白质的结构和功能的一种修饰方式。在生物体内,氧化还原修饰是一种十分常见且重要的蛋白质修饰方式,在许多生物化学反应中发挥着重要作用,包括信号转导、细胞凋亡等。今天我们来简要介绍蛋白质氧化还原修饰的发生、特点、功能以及在生命科学领域的应用。
蛋白质氧化还原修饰的发生
半胱氨酸(Cys)由于其固有的亲核性和氧化还原敏感性,可发生广泛的氧化还原修饰。半胱氨酸具有较高的亲电性,可以与其他半胱氨酸或者其他氨基酸中的巯基(-SH)发生氧化还原反应。在还原条件下,两个半胱氨酸之间形成了一种强烈的二硫键(S-S键),从而促进蛋白质的折叠和稳定。而在氧化条件下,S-S键会被断裂,半胱氨酸则被氧化为半胱氨酸二氧化物,这种氧化还原反应能够影响蛋白质分子的结构和功能。
氧化还原修饰特点
蛋白质氧化还原修饰的特点是高度选择性、可逆性和灵活性。与传统的蛋白质化学修饰相比,蛋白质氧化还原修饰可以更加精确地控制蛋白质分子的结构和性质,并且可以在特定的环境下实现快速的还原或氧化过程。此外,蛋白质氧化还原修饰还可以通过多种方法实现,如生物酶催化、自发氧化等,因此具有很高的灵活性。
氧化还原修饰种类
蛋白质氧化还原修饰的种类较多,根据氧化还原反应的不同,常见的氧化还原包括可逆修饰 (S-亚硝基化、S-次磺酸化、S-谷胱甘肽化、S-硫巯基化、分子间和分子内二硫键、S-酰基化) 以及不可逆修饰 (S-亚砜或亚磺酸化) 两类。不同种类的修饰方式会对蛋白质的结构和功能产生不同的影响。在研究蛋白质氧化还原修饰的过程中,需要对不同的修饰方式进行综合分析。
基于质谱的蛋白质修饰组学技术为观测半胱氨酸氧化还原转换提供了全面的“广角镜”。景杰生物提供多种氧化还原修饰组学服务,助力研究人员解密氧化还原修饰对于机体生理和病理的调控机制。
|
修饰类型 |
概述 |
|
整体氧化还原修饰 |
对细胞或组织样本中发生氧化还原修饰的所有半胱氨酸Cys进行定性与定量分析 (整体表征,无法实现某一具体修饰的位点鉴定与定量分析) |
|
S-亚硝基化修饰 |
又称为S-亚硝化,硝基离子NO+与半胱氨酸巯基-SH共价连接形成S-亚硝基 (-SNO),过程可逆 |
|
S-谷胱甘肽化修饰 |
谷胱甘肽GSH作为氧化态的电子供体与半胱氨酸巯基-SH形成稳定但可逆的混合二硫键 (-SSG) |
|
S-次磺酸化修饰 |
半胱氨酸巯基-SH被ROS氧化后生成次磺酸基团-SOH,其既可被还原为-SH,也可继续发生亚磺酸化修饰和磺酸化修饰 |
|
S-硫巯基化修饰 |
硫化氢H2S与半胱氨酸巯基-SH共价结合形成过硫酸基团-SSH |
功能及应用
氧化还原修饰通过可逆地调节蛋白质活性、互作与定位,在诸多生命活动调控中扮演至关重要的角色。
-
生理状态下,半胱氨酸氧化还原维持着动态平衡,作为关键的细胞信号机制调控多种重要的生物学过程,包括线粒体能量代谢、昼夜节律、蛋白质稳态、氧化应激、基因调控和表观遗传调控等。通过研究蛋白质氧化还原修饰的机制和影响,可为深入理解生命活动调控提供更多的信息。
-
氧化还原失衡是多种疾病产生的早期病因和核心推动力,例如炎症性疾病、神经系统疾病、心血管疾病等。对蛋白质氧化还原修饰的研究有助于深入理解疾病的发生机制,并为疾病的预防和治疗提供新思路和方法。
-
许多药物的作用机制涉及蛋白质氧化还原修饰,例如,抗氧化剂、抗肿瘤药物等。对蛋白质氧化还原修饰的研究可为药物研发提供新靶点和新思路。
01 Cell:整体氧化还原修饰图谱研究提供衰老研究新思路
ROS和氧化还原信号的失调是组织随年龄增长而生理衰退的潜在原因之一,但ROS修饰的靶蛋白在体内介导的组织特异性生理机制尚不清楚。2020年3月5日,国际顶级学术期刊Cell在线发表了美国哈佛医学院Edward T. Chouchani团队题为“A Quantitative Tissue-Specific Landscape of Protein Redox Regulation during Aging”最新研究成果。在该研究中,研究人员通过绘制全面的小鼠半胱氨酸氧化还原蛋白质修饰组学图谱,揭示组织内的半胱氨酸氧化还原网络具有组织选择性。此外,研究人员还全面鉴定了氧化还原修饰的疾病网络,为氧化还原失调和组织衰老之间长期存在的联系建立了系统的分子基础。

作者从16周龄和80周龄的雄性C57BL/6J小鼠中各取10个器官测定组织中蛋白质半胱氨酸氧化综合图谱。实验结果揭示组织中的半胱氨酸氧化还原网络具有组织选择性的群体特征,不同的氧化还原信号网络在每个组织中被选择性地改变。研究进一步探讨了年龄对小鼠组织半胱氨酸氧化网络的影响,并且通过将氧化还原修饰信号网络映射到相应组织中已建立的疾病相关蛋白,全面鉴定氧化还原修饰的疾病网络,为氧化还原失调和组织衰老之间长期存在的联系建立了系统的分子基础。
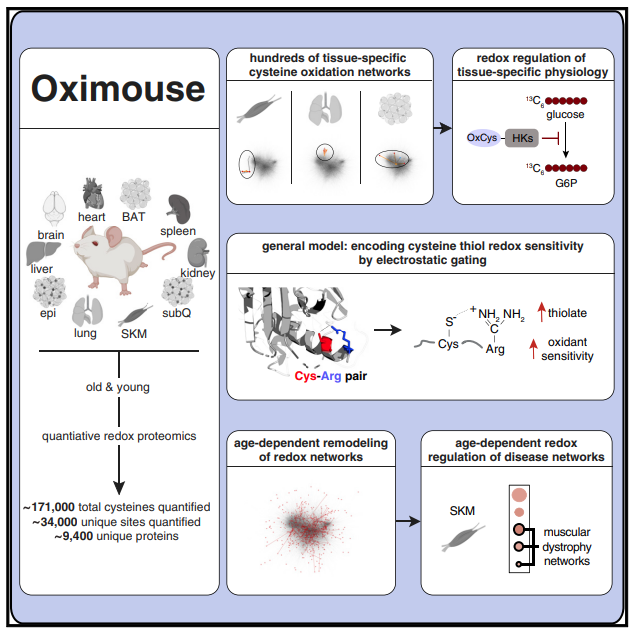
图1 研究示意图
02 Cell:亚硝基化修饰介导肠道微生物对宿主的影响
肠道微生物不但能够帮助宿主完成消化功能,而且同包括癌症、免疫等众多的生理病理过程密切相关。但是,位于肠道内部的微生物,是如何跨越肠道屏障的界限,来调控宿主本身的功能呢?2019年2月21日,Cell发表了题为“Regulation of MicroRNA Machinery and Development by Interspecies S-Nitrosylation”的研究论文,揭示了肠道微生物可通过释放NO介导宿主蛋白的亚硝基化修饰,从而对宿主蛋白功能产生影响。

在该研究中,作者用WT和一氧化氮合酶缺陷型的枯草芽孢杆菌来饲喂线虫,待线虫长到幼虫第四阶段时提取线虫的总蛋白进行亚硝基化修饰组学分析。研究共检测到约1000种亚硝基化蛋白,并通过KEGG分析发现这些蛋白主要参与了能量等细胞代谢途径。作者选择了功能较为保守和研究充分的蛋白ALG-1上的Cys691位点为进一步的研究对象。研究发现,ALG-1的Cys691位点亚硝基化能够抑制其与GW182的结合。ALG-1通过GW182来募集其他蛋白质形成一个复合体,结合microRNA来降解相对应的mRNA并抑制蛋白质翻译。Cys691的亚硝基化能够破坏microRNA对靶基因的抑制效果,并影响宿主的发育。最终构筑了一个“肠道菌群-NO释放-宿主ALG-1亚硝基化-影响microRNA抑制靶基因-影响宿主发育”的完整story。
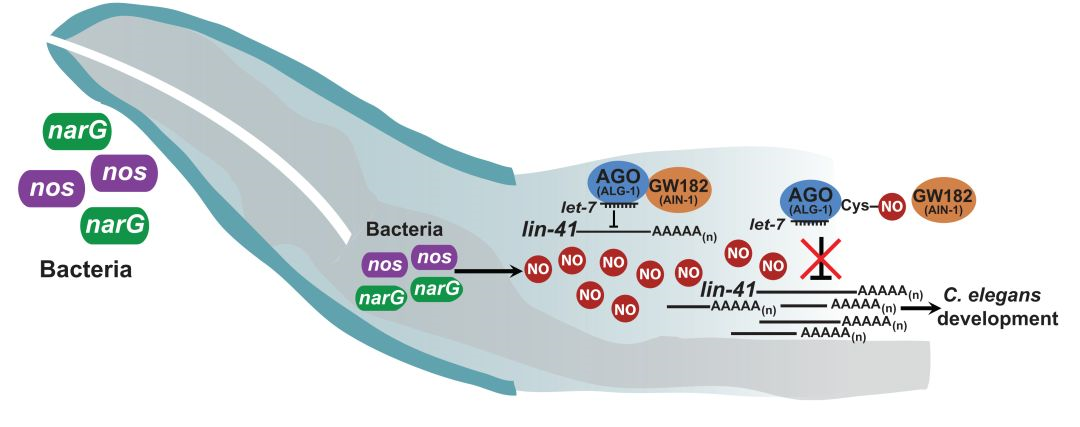
图2 肠道微生物释放NO影响宿主发育的机制模型
03 Nat Comm:谷胱甘肽化修饰揭示急性肺损伤新机制
氧化应激是ROS与机体抗氧化防御系统失衡而导致细胞损伤的结果。有研究表明,蛋白质S-谷胱甘肽化和谷氧还蛋白 (Grx1) 与急性肺损伤 (ALI) 密切相关,但Grx1驱动的调节急性肺损伤的机制仍不清楚。近日,浙江大学基础医学院附属邵逸夫医院研究团队在Nature Communications杂志在线发表了题为“Oxidative stress-induced FABP5 S-glutathionylation protects against acute lung injury by suppressing inflammation in macrophages”最新研究成果。通过对S-谷胱甘肽化蛋白进行定位和定量分析,阐明了脂肪酸结合蛋白FABP5的谷胱甘肽化通过抑制巨噬细胞炎症缓解急性肺损伤的新机制。景杰生物为该研究提供了基于IodoTMT的氧化还原修饰组学分析。

研究发现巨噬细胞中蛋白质的谷胱甘肽化在急性肺损伤的疾病进程中发挥了重要功能,运用基于质谱的谷胱甘肽化修饰组学定量技术,筛选在氧化应激下通过谷胱甘肽化修饰调控巨噬细胞功能的关键蛋白,并从分子水平、细胞水平进行了验证。结果显示,氧化应激压力下巨噬细胞中脂肪酸结合蛋白5 (FABP5) 的谷胱甘肽化修饰显著增强。FABP5 Cys127位点的谷胱甘肽化促进了其与脂肪酸的结合,进而促进其核转位,FABP5携带配体进入细胞核后可结合PPARβ/δ并激活其下游基因的转录,从而抑制巨噬细胞炎症,缓解急性肺损伤。

图3 FABP5的S-谷胱甘肽化抑制LPS诱导的巨噬细胞炎症
04 PNAS:次磺酸化修饰组学揭示氧化还原敏感位点
半胱氨酸氧化可逆地调节蛋白质的结构和功能蛋白的变化,被视为调节植物中细胞信号的氧化还原开关。半胱氨酸的初始氧化模式为S-次磺酸化,但是目前植物中S-次磺酸化的研究主要局限于修饰蛋白的鉴定,氧化还原开关的机制尚不明确。近日,PNAS杂志发表了题为“Mining for protein S-sulfenylation in Arabidopsis uncovers redox-sensitive sites”的研究论文,通过对拟南芥蛋白质的S-次磺酸化位点鉴定以及数据挖掘,揭示了拟南芥细胞中氧化还原的敏感位点。

该研究对H2O2处理和对照组的拟南芥细胞培养物开展了次磺酸化修饰组学检测,共检测到1537个次磺酸化修饰位点,多数富集于参与RNA稳态和代谢的蛋白质中。此外,次磺酸化经常发生在位于酶催化位点的半胱氨酸或参与金属结合的半胱氨酸上,这进一步暗示了氧化还原调节的作用模式。通过比较拟南芥和人类已报道的发生次磺酸化修饰的半胱氨酸位点数据,发现155个拟南芥修饰位点是保守的,其中包括拟南芥AtMAPK4蛋白,它在植物的信号传递中具有重要作用,能够被H2O2激活。AtMAPK4的Cys181对应于人类HsMAPK1的Cys161位点。当将AtMAPK4的181位半胱氨酸残基突变为丝氨酸后,其激酶活性显著下降,因此该位点的次磺酸化修饰在激酶活性调节中发挥了重要作用。
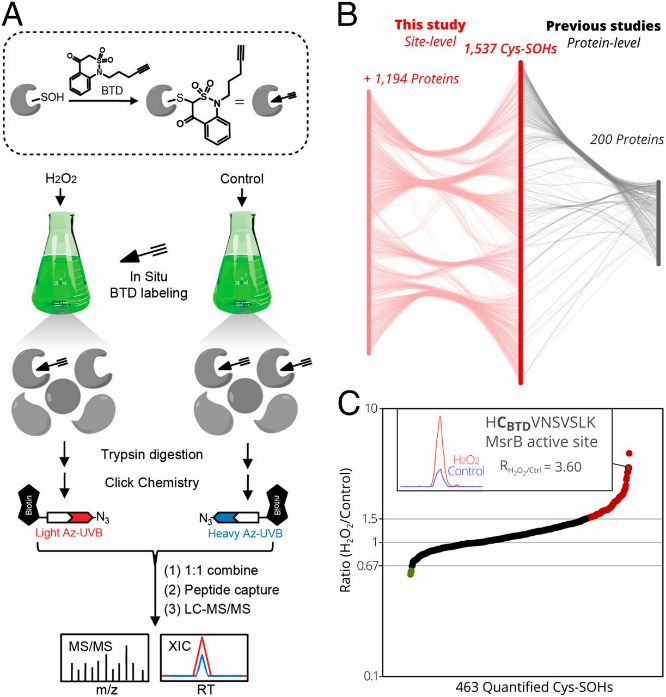
图4 拟南芥次磺酸化修饰位点的鉴定
05 Circulation:硫巯基化修饰揭示主动脉瘤和夹层中调控新机制
内皮细胞功能紊乱是泛血管疾病发生发展的中心环节。在内皮细胞中,胱硫醚-γ-裂解酶 (CSE) 是硫化氢(H2S)生成的主要酶,CSE/H2S系统对内皮细胞的稳态至关重要。硫化氢可催化发生蛋白质S-硫巯基化修饰,但蛋白质S-硫巯基化(SSH)在内皮功能稳态及相关疾病中的作用尚不明确。2023年3月23日,心血管领域权威期刊Circulation上在线发表了题为“Endothelial HDAC1-ZEB2-NuRD Complex Drives Aortic Aneurysm and Dissection Through Regulation of Protein S-Sulfhydration”最新研究成果。首次发现了HDAC1-ZEB2-NuRD复合体介导CSE表达的表观调控新机制:ZEB2-HDAC1-NuRD复合体通过抑制CTH (CSE编码基因) 的转录,下调二硫异构酶 (PDI) 的S-硫巯基化修饰,进而驱动主动脉瘤和主动脉夹层 (AAD) 的进展。

为了探索蛋白质S-硫巯基化修饰在AAD过程中的调控作用,研究人员利用Tag-switch、质谱分析等多种技术发现,内皮细胞中H2S通过促进PDI在Cys 343和Cys400的硫巯基化修饰,提高其还原酶活性和底物结合活性,从而发挥其主要调控作用。蛋白质组学分析发现HDAC1是抑制CTH(CSE编码基因)转录的关键调控因子,导致CTH mRNA水平下降。接着,作者利用CoIP联合质谱检测分析及蛋白互作网络分析鉴定与HDAC1相互作用的蛋白质,最终发现NuRD复合物及转录抑制因子ZEB2与HDAC1共同调控CTH的表达,HDAC1-ZEB2-NuRD复合物与CTH启动子上游的AGGTG元件结合,从而介导了其转录抑制作用。另外,H2S缓释供体GYY4137和HDAC1抑制剂恩替诺特可显著降低AAD发生率、改善内皮依赖的血管舒张同时提高内皮细胞中cGMP水平。
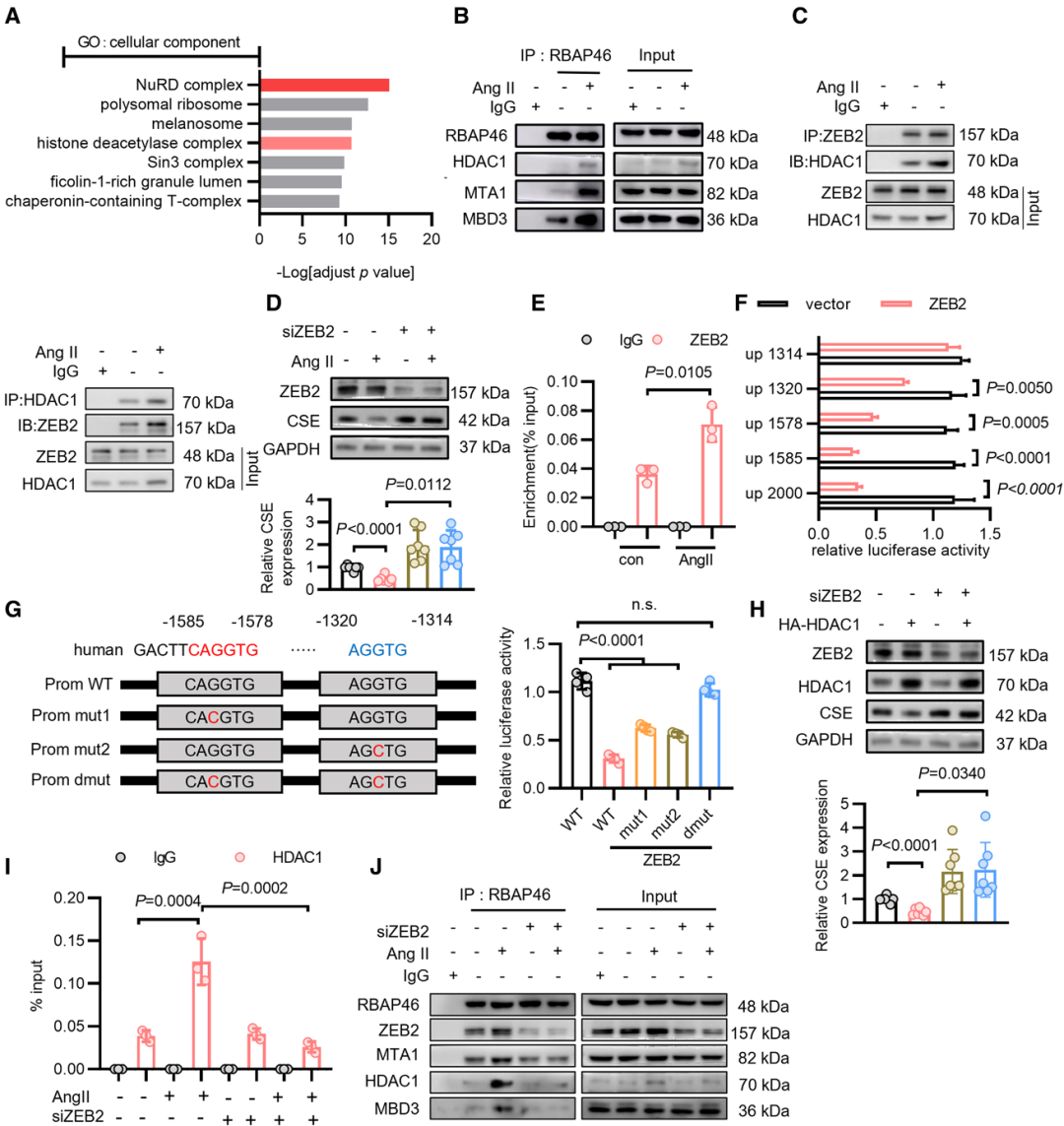
图5 ZEB2招募HDAC1-NuRD复合物抑制CSE的表达
综上所述,蛋白质氧化还原修饰是一种非常重要的蛋白质修饰方式,它能够通过改变蛋白质的氧化还原状态,调节蛋白质的结构和功能,从而参与细胞的正常生理过程和疾病。分析蛋白质半胱氨酸对氧化还原扰动的反应,对于理解潜在机制至关重要。半胱氨酸氧化修饰组学可以对修饰蛋白和位点进行定性、定量和功能分析,具有高通量、更精确、更全面、更新颖等优势。如果您对半胱氨酸氧化修饰组学感兴趣,可联系景杰生物当地销售工程师或科服热线 (400-100-1145) 咨询~参考文献:1. Haopeng Xiao, et al. 2020. A Quantitative Tissue-Specific Landscape of Protein Redox Regulation during Aging. Cell.2. Puneet Seth, et al. 2019. Regulation of MicroRNA Machinery and Development by Interspecies S-Nitrosylation. Cell.3. Yuxian Guo, et al. 2021. Oxidative stress-induced FABP5 S-glutathionylation protects against acute lung injury by suppressing inflammation in macrophages. Nature Communications.4. Jingjing Huang, et al. 2019. Mining for protein S-sulfenylation in Arabidopsis uncovers redox-sensitive sites. Proc Natl Acad Sci U S A.5. Shanshan Luo, et al. 2023. Endothelial HDAC1-ZEB2-NuRD Complex Drives Aortic Aneurysm and Dissection Through Regulation of Protein S-Sulfhydration, Circulation.6. Claudia Lennicke, et al. 2021. Redox metabolism: ROS as specific molecular regulators of cell signaling and function. Molecular Cell.
景杰生物作为修饰组学领域的领跑者,拥有多种修饰抗体和修饰组学质谱检测服务。如果您想了解相关产品和服务的更多信息,请扫描下方二维码填写合作咨询表单、或咨询景杰生物销售工程师、或拨打科服热线400-100-1145。




 浙公网安备 33010602011771号
浙公网安备 33010602011771号