甜蜜来袭!完整O-GalNAc糖肽组学新品测评
蛋白质糖基化(glycosylation)是生物体内最重要的蛋白质翻译后修饰(Post-translational modification,PTM)形式之一,可发生在细胞中50%-70%的蛋白质上[1]。糖基化修饰广泛参与了多种生理病理过程,与抗体药物、肿瘤生物标志物检测等临床应用密切相关[2]。蛋白质糖基化的主要形式为N-糖基化和O-糖基化,其中氧连接的N-乙酰半乳糖胺(O-GalNAc)修饰是膜蛋白和分泌蛋白上最丰富的O-糖基化类型。O-GalNAc修饰影响蛋白的折叠、稳定、运输以及蛋白相互作用,参与炎症反应,病原微生物免疫逃逸,细胞黏附、转移、凋亡等生理过程。目前已有大量研究表明,蛋白质O-GalNAc修饰异常与病原微生物感染、肿瘤、自身免疫性疾病、代谢性疾病、心血管疾病及神经退行性疾病等的发生发展密切相关[3]。

图1 O-GalNAc糖基化修饰的生物学功能
诚然,O-GalNAc修饰的众多生物学功能及其与多种疾病的紧密联系使其逐渐成为糖组学研究的前沿热点之一,但由于O-GalNAc修饰位点及其糖链结构的复杂性,以及缺乏这一修饰肽段的有效纯化策略等,使得基于质谱的O-GalNAc检测分析一直都存在巨大挑战,这也极大限制了O-GalNAc功能的相关研究。因此大规模鉴定O-GalNAc蛋白和位点亟需解决,其重要生物学意义及调控功能也亟待进一步探索。
近年来,景杰生物陆续推出N糖基化组学、O-GlcNAc修饰组学、完整N糖肽组学这三款糖基化检测服务,完成了数以千计的样本检测,同时积累了丰富的技术开发和项目经验。在此基础上,我们不断克服技术难题并优化实验方法,现重磅推出完整O-GalNAc糖肽组学。无需切糖操作,即可进行位点与糖型的同时定性定量分析,并通过生信分析预测单糖的链接方式。目前,完整O-GalNAc糖肽组学与之前的糖基化服务共同组成景杰生物特有的“糖蛋白质组学4.0“,实现糖基化研究的N-/O-完整糖肽组学的全方位覆盖,助力科研工作者轻松应对各类应用场景,探索糖基化的生物学奥秘。同时,“甜蜜探索行动”限时优惠活动火热上线,如果您想了解糖基化修饰产品和服务的更多信息,可直接填写文末的二维码留下您的信息、或咨询景杰生物销售工程师、或拨打科服热线400-100-1145。

图2 糖蛋白质组学4.0“甜蜜探索行动”活动海报
01 完整O-GalNAc糖肽组学产品特色
结合Orbitrap Exploris 480高分辨率质谱仪,完整O-GalNAc糖肽组学鉴定深度更有保障。对5种组织(小鼠脑、小鼠心、人肺癌组织、人胃癌组织及人结直肠癌组织)、4种细胞(HeLa、人巨噬细胞、人结直肠癌细胞及人食管癌细胞)和人血清开展完整O-GalNAc糖肽组学分析,通过严格的数据标准筛选(FDR <0.01;Score得分≥40;位点 Localization probability≥0.75),在小鼠脑组织中鉴定到926个O-GalNAc糖肽,人肺癌组织中鉴定到1209个O-GalNAc糖肽,HeLa细胞中鉴定到888个O-GalNAc糖肽,人血清中鉴定到657个O-GalNAc糖肽。同时,与文献报道中采用不同方法所鉴定到的O-GalNAc糖肽相比,我司采用技术路线鉴定的糖肽深度有明显的提升。
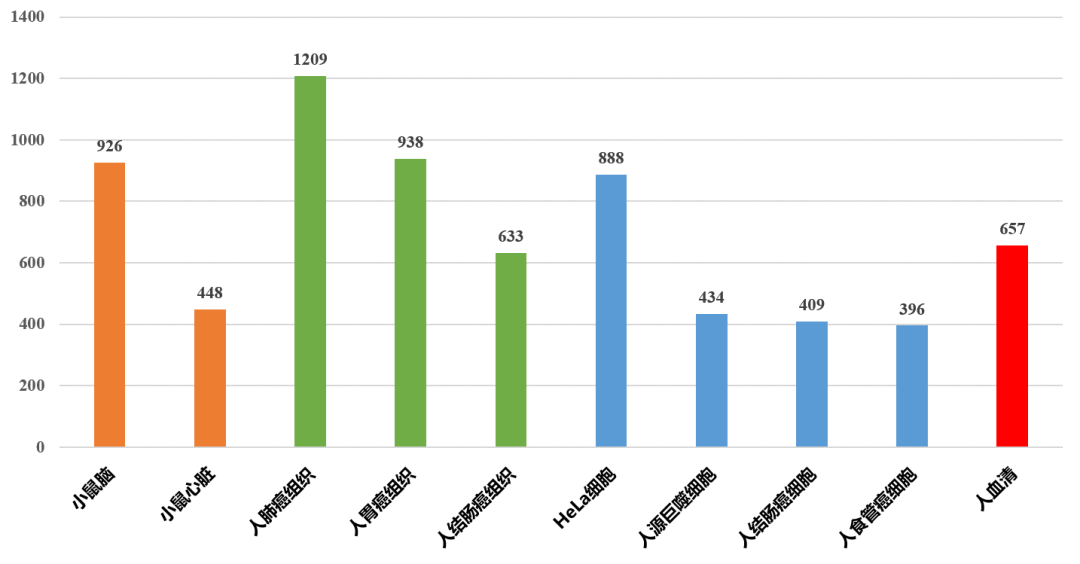
图3 内部测试鉴定到各样本的O-GalNAc糖肽数目
完整O-GalNAc糖肽组学表现出卓越的数据重复性和稳定性。在鼠脑的两次生物学重复测试结果表明绝大部分O-GalNAc糖肽在两个样本中都能被检测。相关性分析显示两个样本间的相关性系数pearson可达0.958。高置信度的的组学数据,有助于我们挖掘出关键的O-GalNAc修饰蛋白进行后续的验证和功能研究,也为大规模样本(如癌症临床组织、血液大队列样本等)的O-GalNAc修饰研究提供坚实的保障。

图4 生物学重复测试结果
除了常规的生信标准分析结果外,完整O-GalNAc糖肽组学还提供Uniport验证O糖基化修饰位点、糖型分类、糖基化异质性等特有生信分析,实现O-GalNAc修饰更多维度的数据挖掘与呈现。通过与UniPort数据库对比,完整O-GalNAc糖肽组学能够发现大多数之前未鉴定到的O-GalNAc位点,并揭示新靶点及其生物学功能。此外,由于相同蛋白在生物体内可能存在多个拷贝,而糖基化受到包括:多肽翻译、蛋白折叠、糖基转移酶的位置和竞争关系、糖苷酶的位置和浓度、跨膜转运等多种因素调控,因此蛋白的同一修饰位点上可能存在不同糖链。因此将鉴定到的糖链去冗余后,基于糖链的特征,可将其划分为4类糖型(HexNAc, Hex, Fuc, Sia),从而统计各糖型在样本中的整体丰度情况。另外,基于糖型的4类划分及修饰位点,还能统计糖型间的共发生频率,揭示不同糖型间的微观异质性。

图5 两次鼠脑的生信分析
02 应用方向推荐
应用方向一: 血液生物标志物研究众所周知,血液中的蛋白多为分泌蛋白,而分泌蛋白一般走经典的分泌途径,需要在内质网与高尔基体中进行一系列修饰与加工,其中就包括糖基化修饰,因此血液中的蛋白大多数为糖蛋白。此外,许多临床相关的血清学肿瘤生物标志物都是糖蛋白,包括CA125(卵巢癌)、前列腺特异性抗原PSA(前列腺癌)、癌胚抗原CEA(结直肠癌)等 [4]。然而,当前癌症标志物的一个关键应用难点是它们不够特异或敏感,可能导致诊断出癌症时已太晚。考虑到与癌症相关的O糖基化通常是唾液酸化结构的改变,且有时是支链结构的改变,有些研究人员就建议利用在特定蛋白质上同时检测O糖基化来增加个体肿瘤标志物的特异性。例如,通过检测CA15和CA15.3的O-GalNAc糖型有助于区分浆液性卵巢癌的恶性和良性病变[5]。此外,相较于健康人群,结直肠癌患者血清中FBLN2、CSF1、MRC1、FGA及C7的O-GalNAc丰度升高,有望成为结直肠癌早期诊断的生物标志物。以上这些研究表明癌症相关糖蛋白的糖基化状态可以提高现有诊断方法的特异性。因此,希望许多新鉴定的O糖基化位点也适合于诊断领域的应用,这既包括癌症的检测,同时也包括其他疾病的检测,另外越来越多的先天性糖基化障碍疾病也是由于影响O糖基化生物合成所导致。

图6 FDA认定的肿瘤生物标志物都是糖蛋白
应用方向二: 疾病发病机制研究
在O-GalNAc的形成中,葡萄糖通过己糖胺生物合成途径合成UDP-GlcNAc(尿苷 5'-二磷酸-N-乙酰葡糖胺),然后在O-GalNAc转移酶的作用下连接到丝氨酸或苏氨酸上。当细胞获取的营养物质改变或代谢出现异常时,就有可能导致蛋白的O-GalNAc修饰水平发生变化。此外,在生物体中,催化蛋白质O-GalNAc修饰发生的起始反应是由一类糖基转移酶ppGalNAc-Ts负责,这类转移酶的表达异常也会导致蛋白O-GalNAc修饰异常。拿癌症举例,在乳腺癌中上调O-GalNAc转移酶GALNT8的表达,可促进细胞表面受体BMPR1A的O-GalNAc修饰,从而进一步通过调控BMP/SMAD/RUNX2信号通路来增加ESR1的表达,最终抑制乳腺癌的细胞增殖 [6];在其它疾病,如动脉粥样硬化发生发展中,单核细胞中GALNT4的表达上调可促进PSGL-1的O-GalNAc修饰,进一步增强单核细胞粘附在血管壁上,造成血管狭窄,加速动脉粥样硬化性心血管疾病发生[7];此外,一些自身免疫疾病发生也与O-GalNAc有关,如IgA肾病是一种以免疫球蛋白A(IgA)为主的免疫复合物在肾小球系膜区沉积为特征的肾小球疾病,也是全球范围内最为常见的原发性肾小球肾炎。IgA肾病的致病因素多且相互交错、发病机制复杂,目前病理学层面最受认可的是“四重打击”假说,即遗传或环境因素导致Gd-IgA1的O-GalNAc修饰过早唾液化以及半乳糖基化的减少→免疫系统识别异常Gd-IgA1后产生特异性抗体→致病性肾炎免疫复合物的形成→肾炎免疫复合物沉积在肾小球系膜区,造成肾脏损伤,最终导致IgA肾病[8]。因此,Gd-IgA1的O-GalNAc修饰可能作为IgA肾病的潜在治疗靶点,为IgA肾病新药研发提供新思路。综上所述,O-GalNAc影响了代谢相关的多种重大疾病,参与肿瘤、心血管等疾病的病理进程,其在其它疾病中的具体的作用机制也有待进一步探索,研究潜力巨大。
03 应用案例展示
1. Nat Chem Biol | O-GlcNAc修饰调控肿瘤细胞核苷酸从头合成的新机制[9]

2. J Mol Cell Cardiol | GALNT4通过调节单核细胞受体PSGL-1的O-GalNAc糖基化促进动脉粥样硬化发生[7]

3. Biochim Biophys Acta Gen Subj | 淀粉样前体蛋白APP的O-GalNAc修饰造成的自身异常蛋白水解促进淀粉样β肽Aβ的产生,从而诱发阿尔兹海默症[10]

4. J Biol Chem | IgA1的GalNAc修饰过早唾液化以及半乳糖基化的减少,促进IgAN中关键自身抗原Gd-IgA1的形成,最终引发肾损伤[8]

综上所述,景杰生物结合糖基化修饰组学研究方面的领先优势,在N糖基化位点、O-GlcNAc和完整N糖肽的基础上,率先推出完整O-GalNAc糖肽组学服务,能够实现对动物组织、细胞及血液等多种生物样本的高深度、高重复性和高稳定性的全局式糖蛋白组学定性定量分析,同时配备完善的生物信息学分析助力机制分析和靶点挖掘,从而帮助研究人员解密糖基化修饰对于机体生理和病理的多维调控机制。
参考文献
1. Schjoldager KT, et al. 2020, Global view of human protein glycosylation pathways and functions. Nat Rev Mol Cell Biol.
2. Watanabe Y, et al. 2020, I Site-specific glycan analysis of the SARS-CoV-2 spike. Science.
3. Wandall HH, et al. 2021, Global functions of O-glycosylation: promises and challenges in O-glycobiology. FEBS J.
4. Colin R, et al. 2019, Glycosylation in health and disease. Nat Rev Nephrol.
5. Ricardo S, et al. 2015, Detection of glyco-mucin profiles improves specificity of MUC16 and MUC1 biomarkers in ovarian serous tumours. Mol Oncol.
6. Huang T, et al. 2022, Expression of GALNT8 and O-glycosylation of BMP receptor 1A suppress breast cancer cell proliferation by upregulating ERα levels. Biochim Biophys Acta Gen Subj.
7. Ye Z, et al. 2022, GALNT4 primes monocytes adhesion and transmigration by regulating O-Glycosylation of PSGL-1 in atherosclerosis. J Mol Cell Cardiol.
8. Suzuki H, et al. 2014, Cytokines alter IgA1 O-glycosylation by dysregulating C1GalT1 and ST6GalNAc-II enzymes. J Biol Chem.
9. Chen L, et al. 2023, Direct stimulation of de novo nucleotide synthesis by O-GlcNAcylation. Nat Chem Biol.10. Shi J, et al. 2021, Comprehensive analysis of O-glycosylation of amyloid precursor protein (APP) using targeted and multi-fragmentation MS strategy. Biochim Biophys Acta Gen Subj.景杰生物作为修饰组学领域的领跑者,拥有多种修饰抗体和修饰组学质谱检测服务。如果您想了解相关产品和服务的更多信息,请扫描下方二维码填写合作咨询表单、或咨询景杰生物销售工程师、或拨打科服热线400-100-1145。




 浙公网安备 33010602011771号
浙公网安备 33010602011771号