Int J Biol Sci | 瑞金医院章雄/刘琰团队首次报道PKM2乳酸化修饰代谢调控机制

长久以来,乳酸都被视作无氧条件下细胞呼吸代谢产生的“废物”,2019年芝加哥大学赵英明教授团队首次突破性地发现,乳酸是重要的表观遗传调控分子,它可以通过组蛋白乳酸化修饰作用,调控巨噬细胞极化相关基因的表达,相关研究结果发表在国际顶级学术期刊Nature杂志[1]。这一重磅研究结果拓宽了代谢调控的边界,引发了乳酸化研究的热潮。最新证据表明,代谢适应是巨噬细胞表型转变的重要标志和先决条件。
近期,上海交通大学医学院附属瑞金医院章雄和刘琰主任在International Journal of Biological Sciences (IF=10.75) 发表了题为“Lactylation of PKM2 Suppresses Inflammatory Metabolic Adaptation in Pro-inflammatory Macrophages” 的研究论文,他们发现乳酸介导的PKM2乳酸化修饰可增加PKM2的丙酮酸激酶活性以抑制Warburg效应,最终促进巨噬细胞从促炎表型向修复表型的转变。景杰生物为该研究提供了乳酸化修饰泛抗体 (PTM-1401RM)。
01. PKM2调节巨噬细胞糖酵解
PKM2是骨髓来源的巨噬细胞 (BMDM) 的主要丙酮酸激酶亚型,作者发现LPS可促进BMDM中PKM2四聚体到二聚体形式的转变。此外,在LPS诱导的BMDM细胞模型中,PKM2酶抑制剂增加了糖酵解过程,这表明降低PKM2丙酮酸激酶活性可以增强Warburg效应,进而促进促炎巨噬细胞的炎症代谢适应。
近期,上海交通大学医学院附属瑞金医院章雄和刘琰主任在International Journal of Biological Sciences (IF=10.75) 发表了题为“Lactylation of PKM2 Suppresses Inflammatory Metabolic Adaptation in Pro-inflammatory Macrophages” 的研究论文,他们发现乳酸介导的PKM2乳酸化修饰可增加PKM2的丙酮酸激酶活性以抑制Warburg效应,最终促进巨噬细胞从促炎表型向修复表型的转变。景杰生物为该研究提供了乳酸化修饰泛抗体 (PTM-1401RM)。

01. PKM2调节巨噬细胞糖酵解
PKM2是骨髓来源的巨噬细胞 (BMDM) 的主要丙酮酸激酶亚型,作者发现LPS可促进BMDM中PKM2四聚体到二聚体形式的转变。此外,在LPS诱导的BMDM细胞模型中,PKM2酶抑制剂增加了糖酵解过程,这表明降低PKM2丙酮酸激酶活性可以增强Warburg效应,进而促进促炎巨噬细胞的炎症代谢适应。
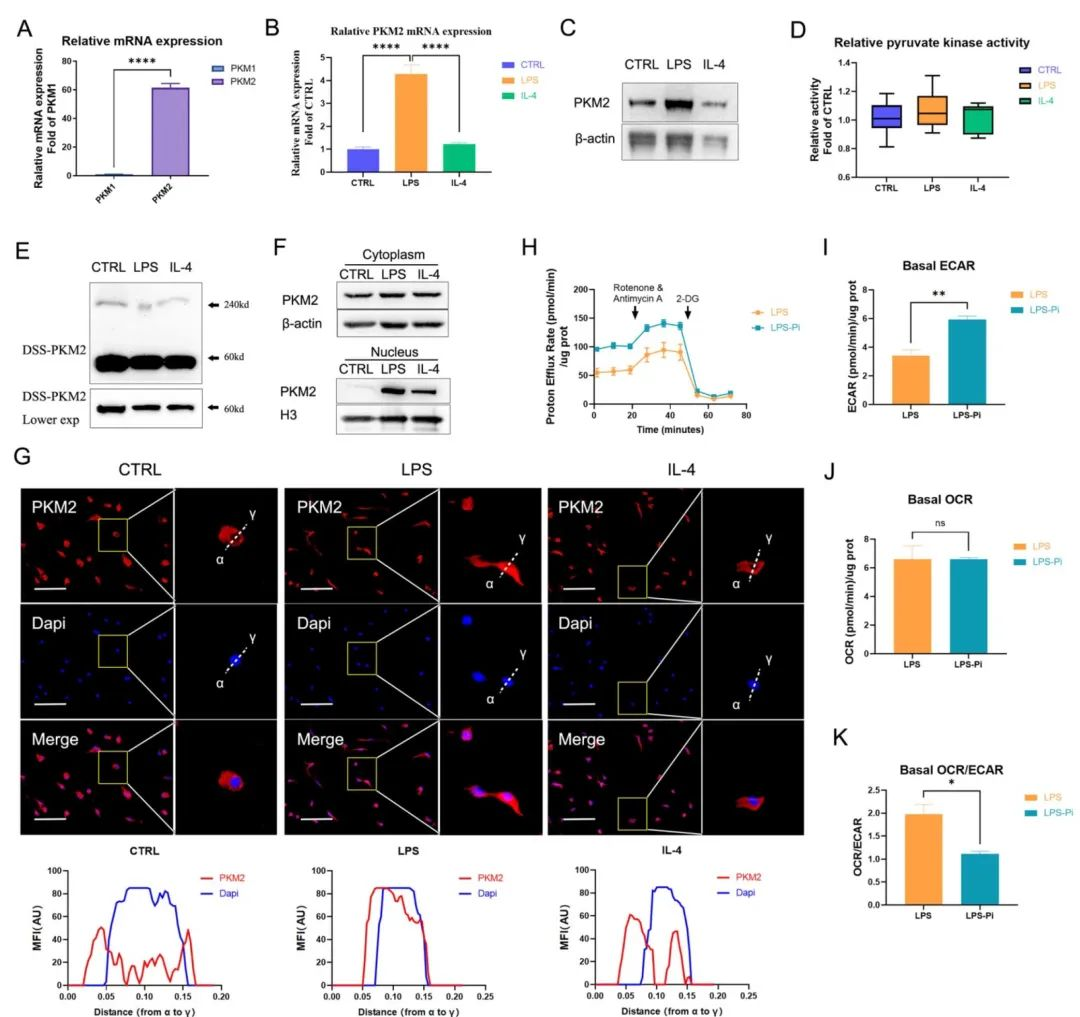
图1 PKM2调节LPS诱导的巨噬细胞中的糖酵解
02. 乳酸通过激活PKM2抑制糖酵解过程并调控巨噬细胞极化
PKM2调节糖酵解过程和乳酸产生,而乳酸是否调节PKM2仍不清楚,针对这一问题,作者添加了外源性乳酸,发现乳酸可激活LPS条件下巨噬细胞中的PKM2活性,显著降低糖酵解水平,而PKM2酶抑制剂逆转了乳酸的作用,因此乳酸可能通过激活PKM2抑制促炎巨噬细胞的炎症代谢适应。乳酸还增加了Arg1 (修复表型巨噬细胞标志物) 的表达,降低了iNOS (促炎表型巨噬细胞标志物) 的表达,表明乳酸通过激活PKM2促进巨噬细胞向修复表型的转变。随后作者构建了皮肤损伤模型,发现局部施用外源性乳酸可促进伤口巨噬细胞从促炎表型向修复表型的转变,并通过促进PKM2丙酮酸激酶活性来加速伤口愈合。
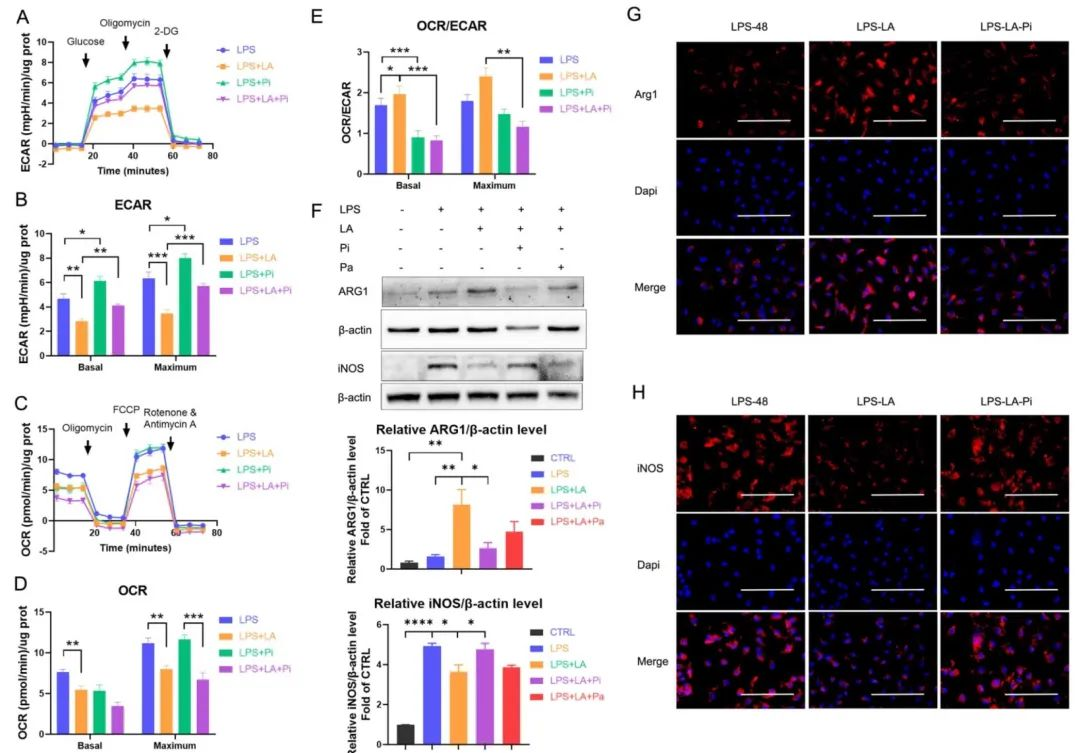
图2 乳酸通过激活PKM2抑制糖酵解并促进LPS诱导的巨噬细胞向修复表型的转变
03. 乳酸介导PKM2 K62残基的乳酸化修饰
为了进一步探究乳酸激活PKM2的机制,作者在LPS诱导的BMDM细胞模型中,用PKM2抗体进行IP实验,并使用乳酸化泛抗体检测PKM2的乳酸化水平,发现乳酸处理上调了PKM2的乳酸化水平,随后作者通过IP-质谱分析找到了四个PKM2的乳酸化修饰位点 (K62,K188,K224和K337),其中K62R位点突变显著降低了PKM2乳酸化水平,其余3个位点突变对乳酸化水平无显著改变,这表明K62位点是PKM2的主要乳酸化位点,且K62位点在斑马鱼和许多哺乳动物中进化保守。因此,乳酸通过介导PKM2 K62位点的乳酸化水平增加其丙酮酸激酶活性,进而促进巨噬细胞向修复表型的转变。
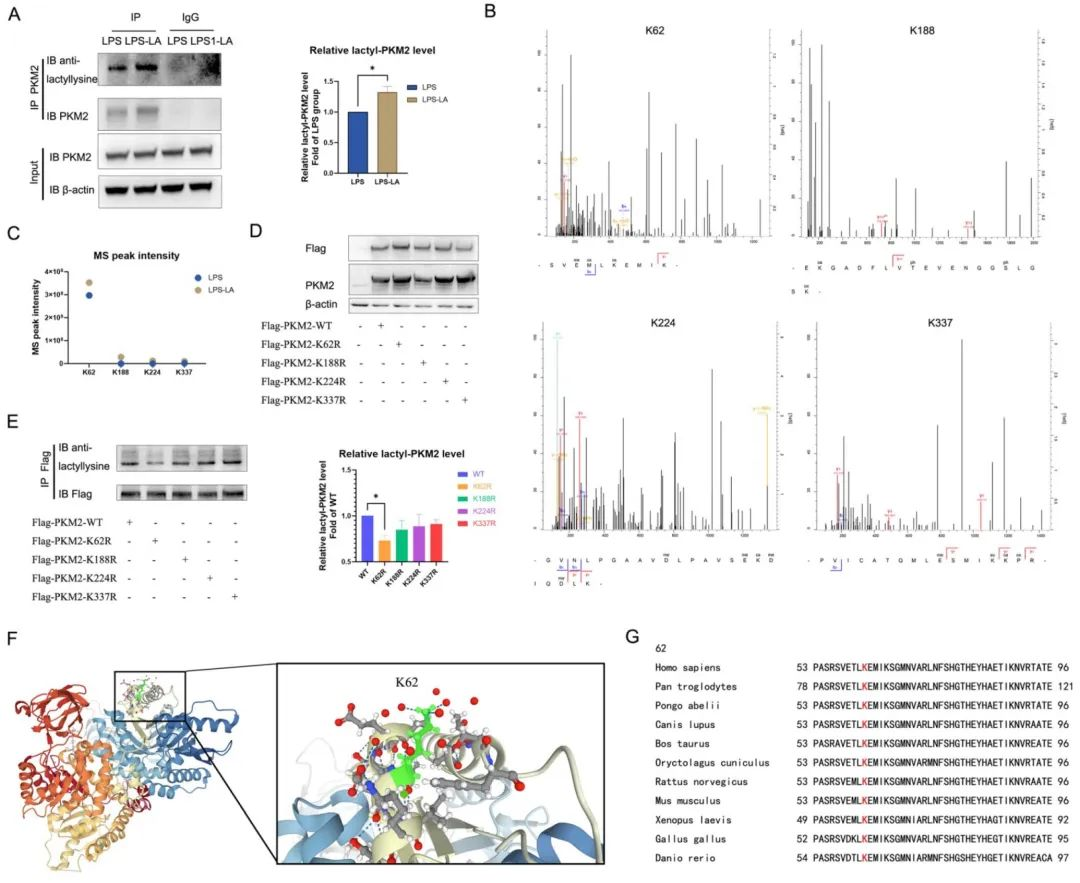
图3 乳酸促进PKM2的K62位点乳酸化
综上所述,该研究首次发现PKM2是乳酸化修饰的底物之一,PKM2的乳酸化修饰增加了其丙酮酸激酶活性,导致糖酵解减少,促进了促炎巨噬细胞向修复表型的转变。该研究阐明了PKM2的乳酸化修饰在调节促炎巨噬细胞炎症代谢适应中的潜在作用。
参考文献1. Di Zhang, et al. 2019. Metabolic regulation of gene expression by histone lactylation. Nature.
2. Jizhuang Wang, et al. 2022. Lactylation of PKM2 Suppresses Inflammatory Metabolic Adaptation in Pro-inflammatory Macrophages. International Journal of Biological Sciences.
本文由景杰学术团队报道,欢迎转发到朋友圈。如有转载、投稿等其他合作需求,请文章下方留言,或添加微信ptm-market咨询。



 浙公网安备 33010602011771号
浙公网安备 33010602011771号