原子结构:原子核、电子、质子和中子
物质由原子(Atom)构成,原子由带负电的电子(Electron)和带正电的原子核(Nucleus)构成,电子在各自的轨道上绕原子核旋转。电子很轻,所以原子的绝大多数质量都集中在原子核上。
原子核又由质子(Proton)和中子( Neutron)构成,质子带正电,中子不带电。有的原子核没有中子,只有质子,例如,氕()是氢(H)的一种同位素,它是最轻、最常见的一种氢的存在形式,它的原子核就只有一个质子,没有中子。
质子、中子、电子是构成原子的三种基本粒子,下图演示了碳原子的结构,它有 6 个质子、6 个中子和 6 个电子。
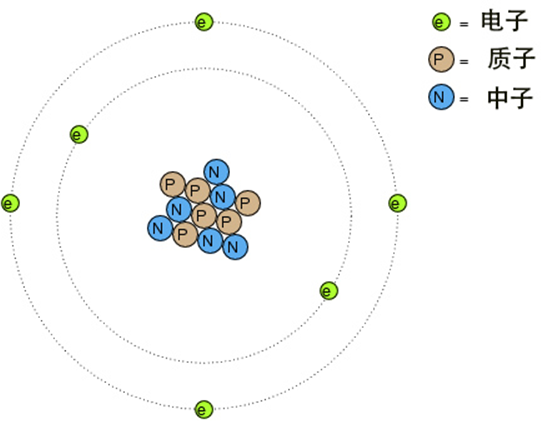
质子、中子和电子对原子的化学性质和物理性质有着不同的影响:
-
质子的数量决定了原子属于哪种化学元素,换句话说,如果改变质子的数量,就会改变原子所属的元素种类。例如,你可以从铅(Pb)原子中去掉三个质子,将铅元素变成了金(Au)元素,从而实现“炼金”的梦想。实际上,质子很难从原子核中加入或去除,因此原子所属的元素种类不会轻易发生变化。
-
中子对原子的影响比质子小得多,改变中子的数量,不会改变原子所属的元素种类。不过,改变中子数量后,原子的质量会发生轻微改变,并可能获得某些核属性,例如放射性。实际上,中子和质子一样,也很难从原子核中加入或去除。
-
与质子和中子相比,电子是非常自由的,它可以轻易地从一个轨道移动到另一个轨道(称为“跃迁”),甚至完全脱离原子(称为“电离”),这是因为,移动电子需要的能量远远小于移动质子或中子需要的能量。去除电子虽然不会改变元素的种类,但是会破坏原子的平衡。
粒子的带电情况
电子带有负电荷,质子带有正电荷;电子和质子带有异种电荷,所以会相互吸引。物体在摩擦过程中电子会发生转移,使得一种材料裸露出负电荷,另一种材料裸露出正电荷,这就是两种材料相互吸引的原因。
中子不带电荷,所以不会被质子或电子吸引或排斥。
一般情况下,原子中电子的数量和质子的数量相同,所带电荷恰好相互抵消,所以原子整体上不带电。例如,碳(C)原子包含 6 个电子和 6 个质子。
17 世纪 80 年代,法国物理学家查尔斯·库仑(Charles Coulomb)发明了扭秤装置,该装置可以测量两个带电物体之间的力,从而实现了对电荷的精确测量。后来,人们以库伦的名字命名了电荷量的单位——库伦(C)。研究发现,1单位的电荷量(1C)约等于 6.25×1018 个电子,反过来说,一个电子的电荷量约为 1.6×10-19C。
电子是目前已知的最小的带电载体,它的带电量被称为基本电荷(Elementary charge)或者元电荷, 用 e 来表示,e = 1.602176565(35)×10-19C,通常取 e = 1.6×10-19C。
质子也是已知的最小带电载体,它的的带电量等于电子,只不过符号是相反的。
核力
同种电荷相互排斥,电子会排斥其它电子,质子也会排斥其它质子。原子核之所以会牢固、稳定的结合在一起,是因为原子核中还存在第三种力量——核力(Nuclear force)。在原子核尺度内,核力比库仑力(质子之间的斥力)大得多,库仑力几乎可以忽略。
核力是一种短程力,作用范围在 1.5×10-15m 之内。核力在大于 0.8×10-15m 时表现为吸引力,且随距离增大而减小,超过 1.5×10-15m 时,核力急速下降几乎消失;而在距离小于 0.8×10-15m 时,核力表现为斥力,因此核子不会融合在一起。
总结
所有的材料都是由原子组成的。
除了氢的同位素氕()以外,所有自然产生的原子都包括电子、质子和中子。
电子带一单位的负(-)电荷。
质子带一单位的正(+)电荷。
中子不带电荷。
电子比质子和中子更容易从原子中分离出来。
原子的质子数决定了原子属于哪种元素。
本文来自博客园,作者:GPL-技术沉思录,转载请注明原文链接:https://www.cnblogs.com/polin/p/17207957.html




