氮族元素——磷
一、磷
元素名称:磷。
元素符号:P。
原子序数:15。
在周期表中的位置:第三周期ⅤA族。
电子排布式:[Ne]3s23p4。
1.磷单质
化学式:P(P2、P4)。
分类:非金属单质。
同素异形体:
红磷:
俗名:赤磷。
化学式:P。
物理性质:红棕色固体,难溶于水、氯仿、苯、二硫化碳。
白磷
俗名:黄磷。
化学式:P4(P:sp3杂化,6个σ键)。
结构式: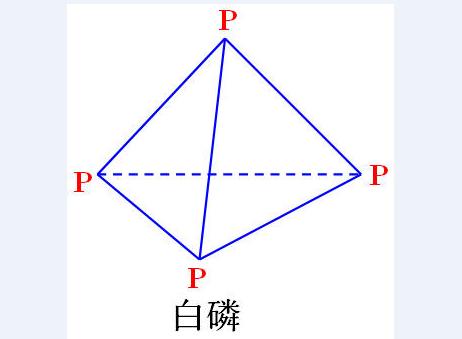 。
。
物理性质:白色具有蒜臭味固体,在暗处发出绿色磷光,难溶于水,微溶于氯仿、苯,易溶于二硫化碳。
黑磷
俗名:金属磷。
化学式:P。
物理性质:黑色固体,具有金属光泽,难溶于水、氯仿、苯、二硫化碳,半导体。
紫磷
化学式:P。
物理性质:钢蓝色固体,具有金属光泽,难溶于水、氯仿、苯、二硫化碳,半导体。
化学性质:
①非金属单质的通性:
与非金属单质反应:
与氧气反应:4P + 3O2(少量) =点燃/△= 2P2O3。4P + 5O2(足量) =点燃/△= 2P2O5。
与氯气反应:2P + 3Cl2(少量) =点燃/△= 2PCl3。2P + 5Cl2(足量) =点燃/△= 2PCl5。
与溴单质反应:2P + 3Br2(少量) =△= 2PBr3。2P + 5Br2(足量) =△= 2PBr5。
与碘单质反应:2P + 3I2(少量) =△= 2PI3。2P + 5I2(足量) =△= 2PI5。
与硫单质反应:4P + 3S =△= P4S3。
与氢气反应:2P + 3H2 =△= 2PH3↑。
与碱反应:4P + 3NaOH + 3H2O =△= PH3↑ + 3NaH2PO2。
②与酸反应:
与浓硝酸反应:P + 5HNO3(浓) =△= H3PO4 + 5NO2↑ + H2O。
③与盐反应:
与硫酸铜反应:2P + 5CuSO4 + 8H2O = 5Cu + 2H3PO4 + 5H2SO4。11P + 15CuSO4 + 24H2O =△= 5Cu3P + 6H3PO4 + 15H2SO4。
制备:2Ca3(PO4)2 + 6SiO2 + 10C =高温= 6CaSiO3 + P4 + 10CO↑。
用途:
①制磷酸。
②制烟雾弹。
③制有机磷杀虫剂。
2.三氧化二磷
化学式:P2O3(P4O10)(P:sp3杂化,12个σ键)。
分类:酸性氧化物。
物理性质:白色具有蒜臭味固体,易溶于水、氯仿、苯、二硫化碳。
化学性质:
①酸性氧化物的通性:
与水反应:P2O3 + 3H2O(冷) = 2H3PO3。2P2O3 + 6H2O(热) = PH3↑ + 3H3PO4。
②还原性:
与氧气反应:P2O3 + O2 = P2O5。
与氯气反应:P2O3 + Cl2 -> POCl3。
与溴单质反应:P2O3 + Br2 -> POBr3。
与碘单质反应:5P4O6 + 8I2 = 4P2I4 + 3P4O10。
与硫单质反应:P4O6 + 4S =△= P4O6S4。
③氧化性。
④与氯化氢反应:P4O6 + 6HCl = 2H3PO3 + 2PCl3。
⑤与乙硼烷反应:P4O6 + B2H6 = H3BP4O6BH3。
⑥配位性。
⑦不稳定性:
三氧化二磷受热分解:4P2O3 =△= 3P2O4 + 2P。
制备:4P + 3O2 =点燃/△= P4O6。4P + 3P2O5 =高温= 5P2O3。
3.五氧化二磷
化学式:P2O5(P:sp3杂化,12个σ键,4个σ配键)。
结构式: 。
。
分类:酸性氧化物。
物理性质:白色具有蒜臭味固体,易溶于水、氯仿、苯、二硫化碳。
化学性质:
①酸性氧化物的通性:
与水反应:P2O5 + H2O(冷) = 2HPO3。P2O5 + 3H2O(热) = 2H3PO4。
②氧化性。
③脱水性:
与硫酸反应:P2O5 + 3H2SO4 = 2H3PO4 + 3SO3。
与硝酸反应:P2O5 + 6HNO3 = 2H3PO4 + 3N2O5。
制备:4P + 5O2 =点燃/△= P4O10。
4.次磷酸
化学式:H3PO2(P:sp3杂化,4个σ键,1个σ配键,2个d←pπ配键)。
结构式: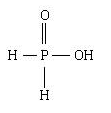 。
。
分类:一元中强酸。
物理性质:无色固体,易溶于水。
化学性质:
①酸性:
电离方程式:H3PO2 ⇌ H+ + H2PO2-。
与碱反应:H3PO2 + OH- = H2PO2- + H2O。
与氢氧化钠反应:NaOH + H3PO2 = NaH2PO2 + H2O。
②还原性:
与氧气反应:2H3PO2 + O2(少量) = 2H3PO3。H3PO2 + O2(足量) = H3PO4。
与氯气反应:H3PO2 + Cl2(少量) + H2O = H3PO3 + 2HCl。H3PO2 + 2Cl2(足量) + 2H2O = H3PO4 + 4HCl。
与溴单质反应:H3PO2 + Br2(少量) + H2O = H3PO3 + 2HBr。H3PO2 + 2Br2(足量) + 2H2O = H3PO4 + 4HBr。
与碘单质反应:H3PO2 + I2(少量) + H2O = H3PO3 + 2HI。H3PO2 + 2I2(足量) + 2H2O = H3PO4 + 4HI。
③氧化性:
与锌单质反应:2Zn + 5H3PO2 = 2Zn(H2PO2)2 + PH3↑ + 2H2O。
④热不稳定性:
次磷酸受热分解:3H3PO2 =△= PH3↑ + 2H3PO3。2H3PO2 =△= PH3↑ + H3PO4。
制备:Ba(H2PO2)2 + H2SO4 = BaSO4↓ + 2H3PO2。PH3 + 2I2 + 2H2O = H3PO2 + 4HI。
5.次磷酸盐
例:NaH2PO2·H2O。
化学性质:
①盐的通性:
与酸反应:H+ + H2PO2- = H3PO2。
与碱反应:H2PO2- + OH- = HPO32- + H2↑。
②还原性:
与铜离子反应:2Cu2+ + H2PO2- + 6OH- = 2Cu↓ + PO43- + 4H2O。
与镍离子反应:Ni2+ + H2PO2- + H2O = Ni↓ + HPO32- + 3H+。
③氧化性。
④热不稳定性:4NaH2PO2 =△= 2PH3↑ + Na4P2O7 + H2O。
6.亚磷酸
化学式:H3PO3(P:sp3杂化,5个σ键,1个σ配键,2个d←pπ配键)。
结构式: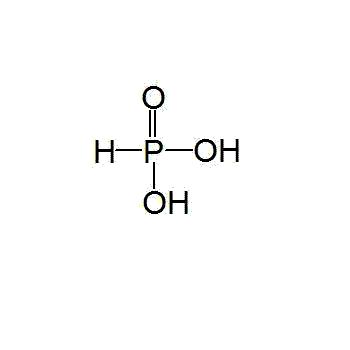 。
。
分类:二元中强酸
物理性质:无色固体,易溶于水。
化学性质:
①酸性:
电离方程式:H3PO3 ⇌ H+ + H2PO3-。H2PO3- ⇌ H+ + HPO32-。
与碱反应:H3PO3 + OH- = H2PO3- + H2O。H3PO3 + 2OH- = HPO32- + H2O。
与氢氧化钠反应:NaOH + H3PO3 = NaH2PO3 + H2O。2NaOH + H3PO3 = Na2HPO3 + 2H2O。
②还原性:
与银离子反应:2Ag+ + H3PO3 + H2O = 2Ag↓ + H3PO4 + 2H+。
与铜离子反应:Cu2+ + H3PO3 + H2O = Cu↓ + H3PO4 + 2H+。
与汞离子反应:Hg2+ + H3PO3 + H2O = Hg + H3PO4 + 2H+。
与浓硫酸反应:H3PO3 + H2SO4(浓) = H3PO4 + SO2↑ + H2O。
③氧化性。
④热不稳定性:
亚磷酸受热分解:4H3PO3 =△= PH3↑ + 3H3PO4。
制备:PCl3 + 3H2O = H3PO3 + 3HCl。
7.亚磷酸盐
例:Na2HPO3·5H2O。
化学性质:
①盐的通性:
与酸反应:H+ + HPO32- = H2PO3-。2H+ + HPO32- = H3PO3。
②还原性。
③氧化性。
8.亚磷酸氢盐
例:NaH2PO3·5H2O。
化学性质:
①盐的通性:
与酸反应:H+ + H2PO3- = H3PO3。
与碱反应:H2PO3- + OH- = HPO32- + H2O。
②还原性。
③氧化性。
9.磷酸
化学式:H3PO4(P:sp3杂化,6个σ键,1个σ配键,2个d←pπ配键,分子间氢键)。
结构式: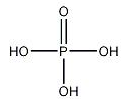 。
。
分类:三元中强酸。
物理性质:无色固体,易溶于水。
化学性质:
①酸性:
电离方程式:H3PO4 ⇌ H+ + H2PO4-。H2PO4- ⇌ H+ + HPO42-。HPO42- ⇌ H+ + PO43-。
与碱反应:H3PO4 + OH- = H2PO4- + H2O。H3PO4 + 2OH- = HPO42- + 2H2O。H3PO4 + 3OH- = PO43- + 3H2O。
与氢氧化钠反应:NaOH + H3PO4 = NaH2PO4 + H2O。2NaOH + H3PO4 = Na2HPO4 + 2H2O。3NaOH + H3PO4 = Na3PO4 + 3H2O。
②氧化性。
③热不稳定性:
磷酸受热分解:H3PO4 =△= H3PO3 + H2O。2H3PO4 =△= H4P2O7 + H2O。3H3PO4 =△= H5P3O10 + 2H2O。
④与氯化钠反应:NaCl + H3PO4(浓) =△= NaH2PO4 + HCl↑。
用途:实验室制氯化氢。
制备:
工业制磷酸:
湿法:Ca3(PO4)2 + 3H2SO4(浓) =△= 3CaSO4 +2H3PO4。P + 5HNO3(浓) =△= H3PO4 + 5NO2↑ + H2O。
热法:4P + 5O2(足量) =点燃/△= P4O10。P2O5 + 3H2O(热) = 2H3PO4。
实验室制磷酸:3H+ + PO43- = H3PO4。
用途:
①制化肥。
②金属防锈。
10.磷酸盐
物理性质:磷酸钾、磷酸钠、磷酸铵易溶于水。
化学性质:
①盐的通性:
与酸反应:PO43- + H+ = HPO42-。PO43- + 2H+ = H2PO4-。3H+ + PO43- = H3PO4。
与盐反应:3Ag+ + PO43- = Ag3PO4↓(黄色沉淀)。
②配位性:
与铁离子反应:Fe3+ + 2PO43- = [Fe(PO4)2]3-。
用途:掩蔽铁离子。
检验磷酸根:3Ag+ + PO43- = Ag3PO4↓(黄色沉淀)。3NH4+ + PO43- + 12MoO42- + 24H+ = (NH4)3PO4·12MoO3·6H2O↓(黄色沉淀) + 6H2O。
11.磷酸一氢盐
物理性质:磷酸一氢钾、磷酸一氢钠、磷酸一氢铵易溶于水。
化学性质:
①盐的通性:
与酸反应:H+ + HPO42- = H2PO4-。2H+ + HPO42- = H3PO4。
与碱反应:HPO42- + OH- = PO43- + H2O。
与盐反应:3Ag+ + 2HPO42- = Ag3PO4↓ + H2PO4-。
②配位性:
与铁离子反应:Fe3+ + 2HPO42- = [Fe(HPO4)2]-。
用途:掩蔽铁离子。
③热不稳定性:2Na2HPO4 =△= Na4P2O7 + H2O。
④磷酸一氢钠与磷酸二氢钠反应:2Na2HPO4 + NaH2PO4 = Na5P3O10 + 2H2O。
12.磷酸二氢盐
物理性质:易溶于水。
化学性质:
①盐的通性:
与酸反应:H+ + H2PO4- = H3PO4。
与碱反应:H2PO4- + OH- = HPO42- + H2O。H2PO4- + 2OH- = PO43- + 2H2O。
与盐反应:H2PO4- + PO43- = 2HPO42-。
②热不稳定性:
磷酸二氢钠受热分解:NaH2PO4 =△= NaPO3 + H2O。
③磷酸一氢钠与磷酸二氢钠反应:2Na2HPO4 + NaH2PO4 = Na5P3O10 + 2H2O。
13.偏磷酸
化学式:H3PO3。
分类:一元强酸。
物理性质:无色具有蒜臭味固体,易溶于水。
化学性质:
①酸性:
电离方程式:HPO3 = H+ + PO3-。
与碱反应:H+ + OH- = H2O。
与氢氧化钠反应:NaOH + HPO3 = NaPO3 + H2O。
②与水反应:HPO3 + H2O = H3PO4。
③与蛋白质反应:H3PO3 + 蛋白质 -> 沉淀。
④聚合反应:nHPO3 = (HPO3)n。
制备:P2O5 + H2O(冷) = 2HPO3。H3PO4 =△= HPO3 + H2O。
14.偏磷酸盐
物理性质:偏磷酸钾、偏磷酸钠、偏磷酸铵易溶于水。
化学性质:
①盐的通性:
与盐反应:
与银离子反应:Ag+ + PO3- = AgPO3↓(白色沉淀)。
制备:NaH2PO4 =△= NaPO3 + H2O。
15.多(聚)偏磷酸
通式:(HPO3)n。例:三(聚)偏磷酸:(HPO3)3。四(聚)偏磷酸:(HPO3)4。
分类:一元强酸。
16.环状多(聚)偏磷酸盐玻璃体
俗名:格氏盐。
通式:(MⅠPO3)n。例:三(聚)偏磷酸钠:(NaPO3)3。四(聚)偏磷酸钠:(NaPO3)4。
用途:硬水软化剂。
17.焦磷酸
化学式:H4P2O7。
分类:四元强酸。
物理性质:白色固体,易溶于水。
化学性质:
①酸性:
电离方程式:H4P2O7 = 4H+ + P2O74-。
与碱反应:H+ + OH- = H2O。
与氢氧化钠反应:4NaOH + H4P2O7 = Na4P2O7 + 4H2O。
②与水反应:H4P2O7 + H2O = 2H3PO4。
制备:2H3PO4 =△= H4P2O7 + H2O。Cu2P2O7 + 2H2S = 2CuS↓ + H4P2O7。
18.焦磷酸盐
例:焦磷酸钠:Na4P2O7。
化学性质:
①盐的通性:
与盐反应:
与银离子反应:4Ag+ + P2O74- = Ag4P2O7↓(白色沉淀)。
②配位性:
与锰离子反应:2Mn2+ + 2P2O74- = [Mn2(P2O7)2]4-。
与铜离子反应:Cu2+ + P2O74- = [Cu(P2O7)]2-。
制备:2Na2HPO4 =△= Na4P2O7 + H2O。
19.焦磷酸二氢盐
例:焦磷酸二氢钠:Na2H2P2O7。
20.多(聚)磷酸
通式:Hn+2PnO3n+1。例:三(聚)磷酸:H5P3O10。
分类:n+2元强酸。
21.直链状/支链状多(聚)磷酸盐
通式:MⅠn+2PnO3n+1。例:三(聚)磷酸钠:Na5P3O10。
22.三卤化磷
化学式:PX3(P:sp3杂化)(X = F、Cl、Br、I)。
分类:路易斯碱。
物理性质:
三氟化磷:无色无味气体,易溶于水。
三氯化磷:无色液体,易溶于水。
三溴化磷:无色液体,易溶于水。
三碘化磷:红色固体,易溶于水。
化学性质:
①碱性:PF3 < PCl3 < PBr3 < PI3。
②水解性:PX3 + 3H2O = H3PO3 + 3HX。
③还原性:
与氧气反应:2PX3 + O2 = 2POX3。
与卤素单质反应:PX3 + X2 = PX5。
与硫单质反应:PX3 + S = PSX3。
④氧化性。
⑤与三卤化磷反应:
三氯化磷与三溴化磷反应:PCl3 + PBr3 = PCl2Br + PClBr2。
23.五卤化磷
化学式:PX5(P:sp3d杂化)(X = F、Cl、Br、I)。
分类:路易斯碱。
物理性质:
五氟化磷:无色具有刺激性气味气体,易溶于水。
五氯化磷:淡黄色固体,易溶于水。
五溴化磷:黄色固体,易溶于水。
化学性质:
①碱性。
②水解性:PX5 + H2O(少量) = POX3 + 2HX。PX5 + 4H2O = H3PO4 + 5HX。
③氧化性。
④热不稳定性:
热稳定性:PF5 > PCl5 > PBr5 > PI5。
五卤化磷受热分解:PX5 =△= PX3 + X2↑。
24.磷化氢/膦
化学式:PH3。
分类:一元弱碱。
物理性质:无色具有蒜臭味气体,微溶于水。
化学性质:
①碱性:
电离方程式(与水反应):PH3 + H2O ⇌ PH3·H2O ⇌ PH4+ + OH-。
与酸反应:PH3 + H+ = PH4+。
②还原性:
与氧气反应:PH3 + 2O2 = H3PO4。
与氯气反应:PH3 + 3Cl2(少量) = PCl3 + 3HCl。PH3 + 4Cl2(足量) = PCl5 + 3HCl。
与溴单质反应:PH3 + 3Br2(少量) = PBr3 + 3HBr。PH3 + 4Br2(足量) = PBr5 + 3HBr。
与碘单质反应:PH3 + 3I2(少量) = PI3 + 3HI。PH3 + 4I2(足量) = PI5 + 3HI。PH3 + 2I2 + 2H2O = H3PO2 + 4HI。
与硫酸铜反应:PH3(少量) + 4CuSO4 + 4H2O = 4Cu↓ + H3PO4 + 4H2SO4。11PH3(足量) + 24CuSO4 + 12H2O = 8Cu3P↓ + 3H3PO4 + 24H2SO4。
与银离子反应:PH3 + 6Ag+ + 3H2O = 6Ag + H3PO3 + 6H+。
③氧化性:
与铁单质反应:2Fe + 2PH3 =△= 2FeP + 3H2↑。
④热不稳定性:
磷化氢/膦受热分解:2PH3 =△= 2P + 3H2↑。
制备:
磷化钙水解:Ca3P2 + 6H2O = 3Ca(OH)2 + 2PH3↑。
磷化铝水解:AlP + 3H2O = Al(OH)3 + PH3↑。
碘化鏻与氢氧化钠反应:PH4I + NaOH = NaI + PH3↑ + H2O。
25.联膦/双膦
化学式:P2H4。
分类:二元弱碱。
本文来自博客园,作者:临化银,转载请注明原文链接:https://www.cnblogs.com/luotei/p/15193597.html
——蘸以清墨,书我弦歌。

