硼族元素
一、硼
元素名称:硼。
元素符号:B。
原子序数:5。
在周期表中的位置:第二周期ⅢA族。
电子排布式:[He]2s22p1。
存在形式:化合态。四水硼砂(Na2B4O7·4H2O)、硼砂(Na2B4O7·10H2O)。
核反应方程式:105B + 10n -> 42He + 73Li。
1.硼单质
化学式:B。
分类:非金属单质。
同素异形体:晶体硼、无定形硼。
物理性质:灰黑色固体(晶体硼)/棕色固体(无定形硼),难溶于水,导电性(温度越高,导电率越高),硬度大,熔点高。
化学性质:
①非金属单质的通性:
与金属单质反应:
与钙单质反应:Ca + 6B =高温= CaB6。
金属硼化物:一硼化四金属(M4B)、一硼化二金属(M2B)、一硼化金属(MB)、二硼化金属(MB2)、四硼化三金属(M3B4)、六硼化金属(MB6)。
与非金属单质反应:
与氟气反应(类比Al):2B + 3F2 = 2BF3。
与氧气反应(类比Al):4B + 3O2 =高温= 2B2O3。
与氯气反应(类比Al):2B + 3Cl2 =高温= 2BCl3。
与溴单质反应(类比Al):2B + 3Br2 =高温= 2BBr3。
与碘单质反应(类比Al):2B + 3I2 =高温= 2BI3。
与硫单质反应(类比Al):2B + 3S =高温= B2S3。
与硒单质反应(类比Al):2B + 3Se =高温= B2Se3。
与碲单质反应(类比Al):2B + 3Te =高温= B2Te3。
与氮气反应(类比Al):2B + N2 =高温= 2BN。
与磷单质反应(类比Al):B + P =高温= BP。
与碱反应:
与氢氧化钠反应(类比Al):2B + 2NaOH + 2H2O = 2NaBO2 + 3H2↑。
②还原性:
与氧化铜反应:2B + 3CuO =△= B2O3 + 3Cu。
与二氧化硅反应:4B + 3SiO2 =高温= 2B2O3 + 3Si。
与水反应(类比Al):2B + 6H2O(g) =高温= 2H3BO3 + 3H2。
与浓硝酸反应:B + 3HNO3(浓) = H3BO3 + 3NO2↑。
与熔融氢氧化钠和熔融硝酸钠反应:2B + 2NaOH(熔融) + 3NaNO3(熔融) =高温= 2NaBO2 + 3NaNO2 + H2O。
制备:
第一步:浓氢氧化钠溶液溶解硼镁矿:
Mg2B2O5·5H2O + 2NaOH = 2NaBO2 + 2Mg(OH)2↓ + 4H2O。
第二步:通入二氧化碳调节pH,析出硼砂:
4NaBO2 + CO2 + 10H2O = Na2B4O7·10H2O + Na2CO3。
第三步:加入硫酸调节pH,析出硼酸:
Na2B4O7 + H2SO4 + 5H2O = 4H3BO3 + Na2SO4。
第四步:加热硼酸脱水:
2H3BO3 =△= B2O3 + 3H2O。
第五步:镁/铝还原三氧化二硼制粗硼:
3Mg + B2O3 =高温= 3MgO + 2B(粗)。
2Al + B2O3 =高温= Al2O3 + 2B(粗)。
第六步:粗硼精炼:
氢气还原三溴化硼:2B(粗) + 3Br2 =高温= 2BBr3。2BBr3 + 3H2 =高温=钨丝= 2B(精) + 6HBr。
三碘化硼受热分解:2B(粗) + 3I2 =高温= 2BI3。2BI3 =高温=钽丝= 2B(精) + 3I2。
2.氧化硼/三氧化硼
化学式:B2O3。
分类:酸性氧化物。
物理性质:无色固体,易溶于水。
化学性质:
①酸性氧化物的通性:
与水反应:B2O3 + 3H2O = 2H3BO3。B2O3 + H2O = 2HBO2。
与碱性氧化物反应(硼珠实验/硼砂珠实验):
与氧化亚钴反应:CoO + B2O3(熔融) =高温= Co(BO2)2(深蓝色)。
与氧化亚镍反应:NiO + B2O3(熔融) =高温= Ni(BO2)2(绿色)。
与氧化铜反应:CuO + B2O3(熔融) =高温= Cu(BO2)2(蓝色)。
②氧化性:
与镁反应:3Mg + B2O3 =高温= 3MgO + 2B。
与铝反应:2Al + B2O3 =高温= Al2O3 + 2B。
③与氨气反应:B2O3 + 2NH3 =高温=高压= 2BN + 3H2O。
用途:吸水剂。
3.硼酸
化学式:H3BO3。
分类:一元弱酸。
物理性质:白色固体,易溶于水。
化学性质:
①与水反应(类比Al(OH)3):H3BO3 + H2O = [B(OH)4]- + H+。
②与酸反应(类比Al(OH)3):
与稀磷酸反应:H3BO3 + H3PO4 =△= BPO4 + 3H2O。
③酸的通性:
与碱反应:
与氢氧化钠反应:4H3BO3 + 2NaOH = Na2B4O7 + 7H2O。
④与醇反应(酯化反应):
与甲醇反应:
H3BO3 + 3CH3OH -浓硫酸-△-> B(OCH3)3 + 3H2O。
燃烧反应:2B(OCH3)3 + 9O2 -点燃-> B2O3 + 6CO2 + 9H2O。
现象:发出绿色火焰。
与乙醇反应:
H3BO3 + 3CH3CH2OH -浓硫酸-△-> B(OCH2CH3)3↑ + 3H2O。
燃烧反应:2B(OCH2CH3)3 + 18O2 -点燃-> B2O3 + 12CO2 + 18H2O。
现象:发出绿色火焰。
⑤与多元醇[甘油(丙三醇)、甘露醇]反应:
与甘油(丙三醇)反应: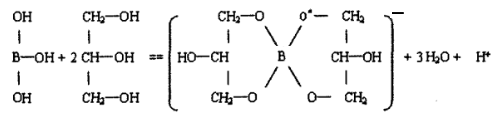
⑥热不稳定性:
硼酸受热分解:2H3BO3 =△= B2O3 + 3H2O。
4.硼砂
四硼酸钠(Na2B4O7)(2NaBO2·B2O3)
四水硼砂(Na2B4O7·4H2O)。
硼砂(Na2B4O7·10H2O)(Na2[B4O5(OH)4]·8H2O)。
化学性质:
①盐的通性:
与碱反应:
与氢氧化钠反应:Na2B4O7 + 2NaOH = 4NaBO2 + H2O。
②水解反应:[B4O5(OH)4]2- + 5H2O = 2H3BO3 + 2[B(OH)4]-。
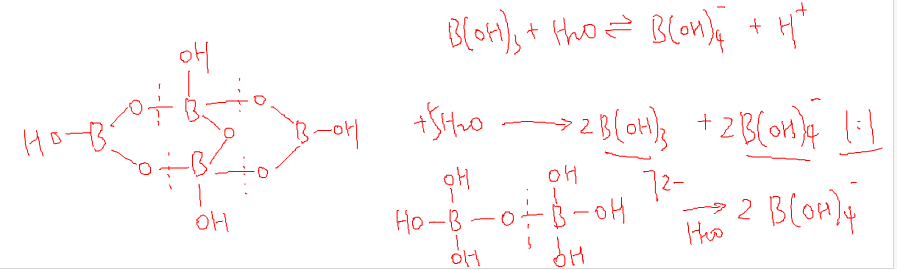
③与金属氧化物反应(硼珠实验/硼砂珠实验):
与氧化亚钴反应:Na2B4O7(熔融) + CoO =高温= 2NaBO2·Co(BO2)2(蓝色)。
与三氧化二铬反应:6Na2B4O7(熔融) + Cr2O3 =高温= 6NaBO2·2Cr(BO2)3(绿色)。
用途:焊接金属(助熔剂)。
5.卤化硼
三氟化硼:π46。
分类:路易斯酸。酸性:三氟化硼 > 三氯化硼 > 三溴化硼 > 三碘化硼。
化学性质:
①路易斯酸的通性:
与路易斯碱反应(酸碱加和反应):
与氨气反应:
BF3 + NH3 = BF3←NH3。
BCl3 + NH3 = BCl3←NH3。
BBr3 + NH3 = BBr3←NH3。
BI3 + NH3 = BI3←NH3。
②水解反应:
BF3 + 3H2O = H3BO3 + 3HF。
BCl3 + 3H2O = H3BO3 + 3HCl。
BBr3 + 3H2O = H3BO3 + 3HBr。
BI3 + 3H2O = H3BO3 + 3HI。
③与卤离子反应:BX3 + X- = [BX4]-。BX3:sp2杂化。[BX4]-:sp3杂化。
6.硼烷
化学式:BHn+4、BHn+6、BHn+8、BHn+10。
甲硼烷:不存在(2pz全空、3配位、无离域π键)。
乙硼烷:
结构:
2个B:sp3杂化。
4个B-H键(二中心二电子键/2c-2e键)、2个氢桥键(三中心二电子键/3c-2e键)。
2个BH2共面。
2个H位于平面上下两侧,关于平面对称。
物理性质:无色具有难闻臭味有毒气体,密度小于空气,难溶于水,易溶于有机溶剂。
化学性质:
①还原性:
与氧气反应:B2H6 + 3O2 =点燃= B2O3 + 3H2O。
与氯气反应:B2H6 + 6Cl2 = 2BCl3 + 6HCl。
②水解反应:B2H6 + 6H2O = 2H3BO3 + 6H2。
③与氢化物反应(加成反应):
与氨气反应:3B2H6 + 6NH3 = 2B3N3H6 + 12H2。
等电子体:苯(C6H6)、无机苯(环硼氮六烷)(B3N3H6)。
无机苯(环硼氮六烷)与氯化氢反应(加成反应): 
与氢化锂反应:2LiH + B2H6 = 2LiBH4。
与氢化钠反应:2NaH + B2H6 = 2NaBH4。
④热不稳定性:B2H6 =△= 2B + 3H2。
制备:
氢化法:2BX3 + 6H2 = B2H6 + 6HX。
质子置换法:6H+ + 2MnB = B2H6↑ + 2Mn3+。
氢负离子置换法:
3LiAlH4 + 4BX3 = 2B2H6↑ + 3LiX + 3AlX3。
3NaBH4 + 4BX3 = 2B2H6↑ + 3NaBX4。
检验钾离子:①取少量待测液于试管中,加入少量六硝基合钴酸钠(Na[Co(NO2)6])溶液,若产生亮黄色沉淀(六硝基合钴酸钾)(K[Co(NO2)6]),则证明有钾离子(弱酸性/中性)。②取少量待测液于试管中,加入少量四苯硼酸钠(C24H20BNa)溶液,若产生白色沉淀(四苯硼酸钾)(C24H20BK),则证明有钾离子。
二、铝
元素名称:铝。
元素符号:Al。
原子序数:13。
在周期表中的位置:第二周期ⅢA族。
电子排布式:[Ne]3s23p1。
1.铝单质
化学式:Al。
分类:两性金属单质。
物理性质:银白色固体,具有金属光泽,导电性,导热性,延展性,熔点高。
化学性质:
①两性金属单质的通性:
与非金属单质反应:
与氟气反应:2Al + 3F2 = 2AlF3。
与氧气反应:4Al + 3O2 = 2Al2O3。4Al(铝粉) + 3O2 =点燃= 2Al2O3。4Al + 3O2 =△= 2Al2O3。
与氯气反应:2Al + 3Cl2 =点燃/△= 2AlCl3。
与溴单质反应:2Al + 3Br2 =△= 2AlBr3。
与碘单质反应:2Al + 3I2 =△= 2AlI3。
与硫单质反应:2Al + 3S =△= Al2S3。
与硒单质反应:2Al + 3Se =△= Al2Se3。
与碲单质反应:2Al + 3Te =△= Al2Te3。
与氮气反应:2Al + N2 =△= 2AlN。
与磷单质反应:Al + P =△= AlP。
与水反应:
2Al(铝粉) + 6H2O =△= 2Al(OH)3 + 3H2↑。
与酸反应:
与稀盐酸反应:2Al + 6HCl = 2AlCl3 + 3H2↑。
与稀硫酸反应:2Al + 3H2SO4 = Al2(SO4)3 + 3H2↑。
与碱反应:
与氢氧化钠反应:2Al + 2NaOH + 6H2O = 2Na[Al(OH)4] + 3H2↑/2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑。
②还原性:
与稀硝酸反应:Al + 4HNO3(稀) = Al(NO3)3 + NO↑ + 2H2O。
与浓硝酸反应:Al + 6HNO3(浓) = Al(NO3)3 + 3NO2↑ + 3H2O。
铝热反应:2Al + Fe2O3 =高温= Al2O3 + 2Fe。10Al + 3V2O5 =高温= 5Al2O3 + 6V。2Al + WO3 =高温= Al2O3 + W。
③常温下,铝遇冷的浓硫酸、浓硝酸发生钝化。
铝单质的制备:
电解熔融的氧化铝:2Al2O3(熔融) =通电=冰晶石= 4Al + 3O2↑。
2.氧化铝
化学式:Al2O3。
分类:两性氧化物。
物理性质:白色固体,难溶于水,硬度大,熔点高。
化学性质:
①两性氧化物的通性:
与酸反应:
与稀盐酸反应:Al2O3 + 6HCl = 2AlCl3 + 3H2O。
与稀硫酸反应:Al2O3 + 3H2SO4 = Al2(SO4)3 + 3H2O。
与稀硝酸反应:Al2O3 + 6HNO3 = 2Al(NO3)3 + 3H2O。
与碱反应:
与氢氧化钠反应:Al2O3 + 2NaOH + 3H2O = 2Na[Al(OH)4]/Al2O3 + 2H2O = 2NaAlO2 + H2O。
3.氢氧化铝
化学式:Al(OH)3。
分类:两性氢氧化物。
物理性质:白色固体,难溶于水。
化学性质:
①两性氢氧化物的通性:
与酸反应:
与稀盐酸反应:Al(OH)3 + 3HCl + AlCl3 + 3H2O。
与稀硫酸反应:2Al(OH)3 + 3H2SO4 = Al2(SO4)3 + 6H2O。
与稀硝酸反应:Al(OH)3 + 3HNO3 = Al(NO3)3 + 3H2O。
与碱反应:
与氢氧化钠反应:Al(OH)3 + NaOH = Na[Al(OH)4]/Al(OH)3 + NaOH = NaAlO2 + 2H2O。
②热不稳定性:
氢氧化铝受热分解:2Al(OH)3 =△= Al2O3 + 3H2O。
4.铝盐
明矾(十二水合硫酸铝钾)(KAl(SO4)2·12H2O):无色固体,易溶于水。
化学性质:
①盐的通性:
与碱反应:
与氢氧化钠反应:Al3+ + 3OH-(少量) = Al(OH)3↓。Al3+ + 4OH- = [Al(OH)4]-/Al3+ + 4OH- = AlO2- + 2H2O。
与稀氨水反应:Al3+ + 3NH3·3H2O = Al(OH)3↓ + 3NH4+。
②水解反应:Al3+ + 3H2O = Al(OH)3(胶体) + 3H+。
③双水解反应:2Al3+ + 3CO32- + 3H2O = 2Al(OH)3↓ + 3CO2↑。Al3+ + 3HCO3- = Al(OH)3↓ + 3CO2↑。
5.四羟基合铝酸盐/偏铝酸盐
化学性质:
①盐的通性:
与酸反应:H+(少量) + [Al(OH)4]- = Al(OH)3↓ + H2O/H+(少量) + AlO2- + H2O = Al(OH)3↓。4H+(足量) + [Al(OH)4]- = Al3+ + 4H2O/4H+(足量)+ AlO2- = Al3+ + 2H2O。
②与二氧化碳反应:CO2(少量) + 2[Al(OH)4]- = 2Al(OH)3↓ + CO32- + H2O/CO2(少量) + 2AlO2- + 3H2O = 2Al(OH)3↓ + CO32-。CO2(足量) + [Al(OH)4]- = Al(OH)3↓ + HCO3-/CO2(足量) + AlO2- + 2H2O = Al(OH)3↓ + HCO3-。
③与铝盐反应:Al3+ + 3[Al(OH)4]- = 4Al(OH)3↓/Al3+ + 3AlO2- + 6H2O = 4Al(OH)3↓。
三、镓(镓分族)
元素名称:镓。
元素符号:Ga。
原子序数:31。
在周期表中的位置:第四周期ⅢA族。
电子排布式:[Ar]3d104s24p1。
1.镓单质
化学式:Ga。
分类:两性金属单质(两性偏酸)。
物理性质:蓝灰色固体,具有金属光泽,熔点低,沸点高(熔沸点温度区间最大的单质)。
化学性质:
①两性金属单质的通性:
与非金属单质反应:
与氟气反应(类比Al):2Ga + 3F2 =△= 2GaF3。
与氧气反应(类比Al):4Ga + 3O2 =△= 2Ga2O3。
与氯气反应(类比Al):2Ga + 3Cl2 =△= 2GaCl3。
与溴单质反应(类比Al):2Ga + 3Br2 =△= 2GaBr2。
与碘单质反应(类比Al):2Ga + 3I2 =△= 2GaI3。
与硫单质反应(类比Al):2Ga + 3S =△= Ga2S3。
与硒单质反应(类比Al):2Ga + 3Se =△= Ga2Se3。
与碲单质反应(类比Al):2Ga + 3Te =△= Ga2Te3。
与氮气反应(类比Al):2Ga + N2 =△= 2GaN。
与磷单质反应(类比Al):Ga + P =△= GaP。
与酸反应:
与稀盐酸反应(类比Al):2Ga + 6HCl = 2GaCl3 + 3H2↑。
与稀硫酸反应(类比Al):2Ga + 3H2SO4 = Ga2(SO4)3 + 3H2↑。
与碱反应:
与氢氧化钠反应(类比Al):2Ga + 2NaOH + 6H2O = 2Na[Ga(OH)4] + 3H2↑/2Ga + 2NaOH + 2H2O = 2NaGaO2 + 3H2↑。
与稀氨水反应:2Ga + 2NH3·H2O + 6H2O = 2NH4[Ga(OH)4] + 3H2↑/2Ga + 2NH3·H2O + 2H2O = 2NH4GaO2 + 3H2↑。
②还原性:
与稀硝酸反应(类比Al):Ga + 4HNO3(稀) = Ga(NO3)3 + NO↑ + 2H2O。
与浓硝酸反应(类比Al):Ga + 6HNO3(浓) = Ga(NO3)3 + 3NO2↑ + 3H2O。
用途:高温温度计。
2.氧化亚镓/一氧化二镓
化学式:Ga2O。
分类:两性氧化物(两性偏酸)。
物理性质:难溶于水。
3.氧化镓/三氧化二镓
化学式:Ga2O3。
分类:两性氧化物(两性偏酸)。
物理性质:白色固体,难溶于水。
化学性质:
①两性氧化物的通性:
与酸反应:
与稀盐酸反应(类比Al2O3):Ga2O3 + 6HCl = 2GaCl3 + 3H2O。
与稀硫酸反应(类比Al2O3):Ga2O3 + 3H2SO4 = Ga2(SO4)3 + 3H2O。
与稀硝酸反应(类比Al2O3):Ga2O3 + 6HNO3 = 2Ga(NO3)3 + 3H2O。
与碱反应:
与氢氧化钠反应(类比Al2O3):Ga2O3 + 2NaOH + 3H2O = 2Na[Ga(OH)4]/Ga2O3 + 2NaOH = 2NaGaO2 + H2O。
与稀氨水反应:Ga2O3 + 2NH3·H2O + 3H2O = 2NH4[Ga(OH)4]/Ga2O3 + 2NH3·H2O = 2NH4GaO2 + H2O。
4.氢氧化亚镓
化学式:GaOH。
分类:两性氢氧化物(两性偏酸)。
物理性质:难溶于水。
5.氢氧化镓
化学式:Ga(OH)3。
分类:两性氢氧化物(两性偏酸)。
物理性质:白色固体,难溶于水。
化学性质:
①两性氢氧化物的通性:
与酸反应:
与稀盐酸反应:Ga(OH)3 + 3HCl = GaCl3 + 3H2O。
与稀硫酸反应:2Ga(OH)3 + 3H2SO4 = Ga2(SO4)3 + 6H2O。
与稀硝酸反应:Ga(OH)3 + 3HNO3 = Ga(NO3)3 + 3H2O。
与碱反应:
与氢氧化钠反应:Ga(OH)3 + NaOH = Na[Ga(OH)4]/Ga(OH)3 + NaOH = NaGaO2 + 2H2O。
与稀氨水反应:Ga(OH)3 + NH3·H2O = NH4[Ga(OH)4]/Ga(OH)3 + NH3·H2O = NH4GaO2 + 2H2O。
②热不稳定性:
氢氧化镓受热分解:2Ga(OH)3 =△= Ga2O3 + 3H2O。
四、铟(镓分族)
元素名称:铟。
元素符号:In。
原子序数:49。
在周期表中的位置:第五周期ⅢA族。
电子排布式:[Kr]4d105s25p1。
1.铟单质
化学式:In。
分类:两性金属单质(酸性极弱)。
物理性质:银白色略带淡蓝色固体,具有金属光泽,延展性,质软,熔点低。
化学性质:
①两性金属单质的通性:
与非金属单质反应:
与氟气反应(类比Al):2In + 3F2 =△= 2InF3。
与氧气反应(类比Al):4In + 3O2 =△= 2In2O3。
与氯气反应(类比Al):2In + 3Cl2 =△= 2InCl3。
与溴单质反应(类比Al):2In + 3Br2 =△= 2InBr3。
与碘单质反应(类比Al):2In + 3I2 =△= 2InI3。
与硫单质反应(类比Al):2In + 3S =△= In2S3。
与硒单质反应(类比Al):2In + 3Se =△= In2Se3。
与碲单质反应(类比Al):2In + 3Te =△= In2Te3。
与氮气反应(类比Al):2In + N2 =△= 2InN。
与磷单质反应(类比Al):In + P =△= InP。
与水反应:2In(铟粉) + 6H2O =△= 2In(OH)3 + 3H2↑。
与酸反应:
与稀盐酸反应(类比Al):2In + 6HCl = 2InCl3 + 3H2↑。
与稀硫酸反应(类比Al):2In + 3H2SO4 = In2(SO4)3 + 3H2↑。
②还原性:
与浓硝酸反应(类比Al):In + 6HNO3(浓) = In(NO3)3 + 3NO2↑ + 3H2O。
与稀硝酸反应(类比Al):In + 4HNO3(稀) = In(NO3)3 + NO↑ + 2H2O。
2.氧化亚铟/一氧化二铟
化学式:In2O。
分类:两性氧化物(酸性极弱)。
物理性质:难溶于水。
3.氧化铟/三氧化二铟
化学式:In2O3。
分类:两性氧化物(酸性极弱)。
物理性质:黄色固体,难溶于水。
化学性质:
①两性氧化物的通性:
与酸反应:
与稀盐酸反应(类比Al2O3):In2O3 + 6HCl = 2InCl3 + 3H2O。
与稀硫酸反应(类比Al2O3):In2O3 + 3H2SO4 = In2(SO4)3 + 3H2O。
与稀硝酸反应(类比Al2O3):In2O3 + 6HNO3 = 2In(NO3)3 + 3H2O。
4.氢氧化亚铟
化学式:InOH。
分类:两性氢氧化物(酸性极弱)
物理性质:难溶于水。
5.氢氧化铟
化学式:In(OH)3。
分类:两性氢氧化物(酸性极弱)。
物理性质:白色固体,难溶于水。
化学性质:
①两性氢氧化物的通性:
与酸反应:
与稀盐酸反应(类比Al(OH)3):In(OH)3 + 3HCl = InCl3 + 3H2O。
与稀硫酸反应(类比Al(OH)3):2In(OH)3 + 3H2SO4 = In2(SO4)3 + 6H2O。
与稀硝酸反应(类比Al(OH)3):In(OH)3 + 3HNO3 = In(NO3)3 + 3H2O。
②不稳定性:
氢氧化铟受热分解(类比Al(OH)3):2In(OH)3 =△= In2O3 + 3H2O。
五、铊(镓分族)
元素名称:铊。
元素符号:Tl。
原子序数:81。
在周期表中的位置:第六周期ⅢA族。
电子排布式:[Xe]4f145d106s26p1。
1.铊单质
化学式:Tl。
分类:金属单质。
物理性质:灰白色固体,具有金属光泽,密度大,质软,熔点低。
化学性质:
①金属单质的通性:
与非金属单质反应:
与氧气反应:4Tl + O2 = 2Tl2O(类比Na)。4Tl + 3O2 =△= 2Tl2O3(类比Al)。
与氯气反应(类比Al):2Tl + 3Cl2 = 2TlCl3。
与硫单质反应(类比Al):2Tl + 3S =高温= Tl2S3。
与硒单质反应(类比Al):2Tl + 3Se =高温= Tl2Se3。
与碲单质反应(类比Al):2Tl + 3Te =高温= Tl2Te3。
与磷单质反应(类比Al):Tl + P =高温= TlP。
与酸反应:
与稀盐酸反应(类比Na):2Tl + 2HCl = 2TlCl + H2↑。
与稀硫酸反应(类比Na):2Tl + H2SO4 = Tl2SO4 + H2↑。
与稀高氯酸反应(类比Na):2Tl + 2HClO4 = 2TlClO4 + H2↑。
②还原性:
与稀硝酸反应:3Tl + 4HNO3(稀) = 3TlNO3 + NO↑ + 2H2O。
与浓硝酸反应:Tl + 2HNO3(浓) = TlNO3 + NO2↑ + H2O。
2.氧化亚铊/一氧化二铊
化学式:Tl2O。
分类:碱性氧化物。
物理性质:黑色固体,易溶于水。
化学性质:
①碱性氧化物的通性:
与水反应(类比Na2O):Tl2O + H2O = 2TlOH。
与酸性氧化物反应:
与二氧化碳反应(类比Na2O):Tl2O + CO2 = Tl2CO3。
与酸反应:
与稀盐酸反应(类比Na2O):Tl2O + 2HCl = 2TlCl + H2O。
与稀硫酸反应(类比Na2O):Tl2O + H2SO4 = Tl2SO4 + H2O。
3.氧化铊/三氧化二铊
化学式:Tl2O3。
分类:碱性氧化物。
物理性质:棕色固体,难溶于水。
化学性质:
①热不稳定性:
氧化铊/三氧化二铊受热分解:Tl2O3 =△= Tl2O + O2↑。
4.氢氧化亚铊
化学式:TlOH。
分类:强碱。
物理性质:黄色固体,易溶于水。
化学性质:
①碱的通性:
与非金属氧化物反应:
与二氧化碳反应(类比NaOH):CO2 + 2TlOH = Tl2CO3 + H2O。
与酸反应:
与稀盐酸反应(类比NaOH):HCl + TlOH = TlCl↓ + H2O。
与稀硫酸反应(类比NaOH):H2SO4 + 2TlOH = Tl2SO4 + H2O。
②热不稳定性:
氢氧化亚铊受热分解(类比Ag2O):2TlOH =△= Tl2O + H2O。
5.氢氧化铊
化学式:Tl(OH)3。
分类:弱碱。
物理性质:红棕色固体,难溶于水。
化学性质:
①热不稳定性:
氢氧化铊受热分解(类比Al(OH)3):2Tl(OH)3 =△= Tl2O3 + 3H2O。
6.氯化铊/三氯化铊
化学式:TlCl3。
分类:盐。
化学性质:
①热不稳定性:
氯化铊/三氯化铊受热分解:TlCl3 =△= TlCl + Cl2↑。
TlBr3:不存在。
TlI3:不存在。
T2Cl4 = Tl(Ⅰ)[Tl(Ⅲ)Cl4]。
T4Cl6 = Tl(Ⅰ)3[Tl(Ⅲ)Cl6]。
稳定性:Ga2O < In2O < Tl2O。Ga2O3 > In2O3 > Tl2O3。
脱水的难易程度:Ga(OH)3 > In(OH)3 > Tl(OH)3。
碱性:Ga2O3 < In2O3 < Tl2O3。NaOH < TlOH < KOH。
氧化性:Ge2O3 < In2O3 < Tl2O3。
金属性:Al > Ga。
酸性:Al2O3 < Ga2O3。Al(OH)3 < Ga(OH)3。
GaCl3:离子化合物。
InCl3:离子化合物。
TlCl3:离子化合物。
AlX3(X = F、Cl、Br、I):低温气相、非极性溶剂:二聚(Al2X6)。
GaX3(X = F、Cl、Br、I):低温气相、非极性溶剂:二聚(Ga2X6)。
InX3(X = F、Cl、Br、I):低温气相、非极性溶剂:二聚(In2X6)。
TlX3(X = F、Cl):低温气相、非极性溶剂:二聚(Tl2X6)。
本文来自博客园,作者:临化银,转载请注明原文链接:https://www.cnblogs.com/luotei/p/15126233.html
——蘸以清墨,书我弦歌。

