化学反应原理
Previous Part | General Solution#
- 注:⋆ 表示较难 ∗ 表示不学,∗∗ 表示既不学也没见过怎么用。
- 注2:[B] 也可以表示物质 B 的摩尔浓度。
原理题比较杂,不过其核心在于读题,从题中获取关键信息。
做题原则:以题目中的信息、数据为准,不要有自己的思想 !!
对于图像信息的把握:
选必一有很多图像题。
他给你一个图像,你就得明白什么是关键点,图像想告诉你什么信息,它的斜率有什么含义,它的交点有什么含义,它从左往右变化趋势有什么含义,两条线的差距有没有什么含义。等等。
平衡分析问题的角度:
- 动力学,即考虑一个东西的速率是否快
- 热力学,即考虑一个东西进行的是否完全,转化率多大
外界条件控制在一个一个特定的温度,特定的压强,是动力学和热力学的共同作用(还有技术问题)。反应必须速率足够快,并且转换率足够大。
Part 1 热效应 与 机理#
1.1 反应热与焓变#
焓(H)。焓变 (ΔH)在反应前后等压条件下等于反应热(又名热效应,字母 Q)。
1.2 盖斯定律#
反应物一定,生成物一定,ΔH 就一定。
1.3 有效碰撞理论#
活化能,活化分子,活化分子数,活化分子百分数(活化分子数分子数),有效碰撞。
1.4 熵#
熵,S 表示体系混乱程度。
气体数量越多,种类越多越混乱,熵越大。
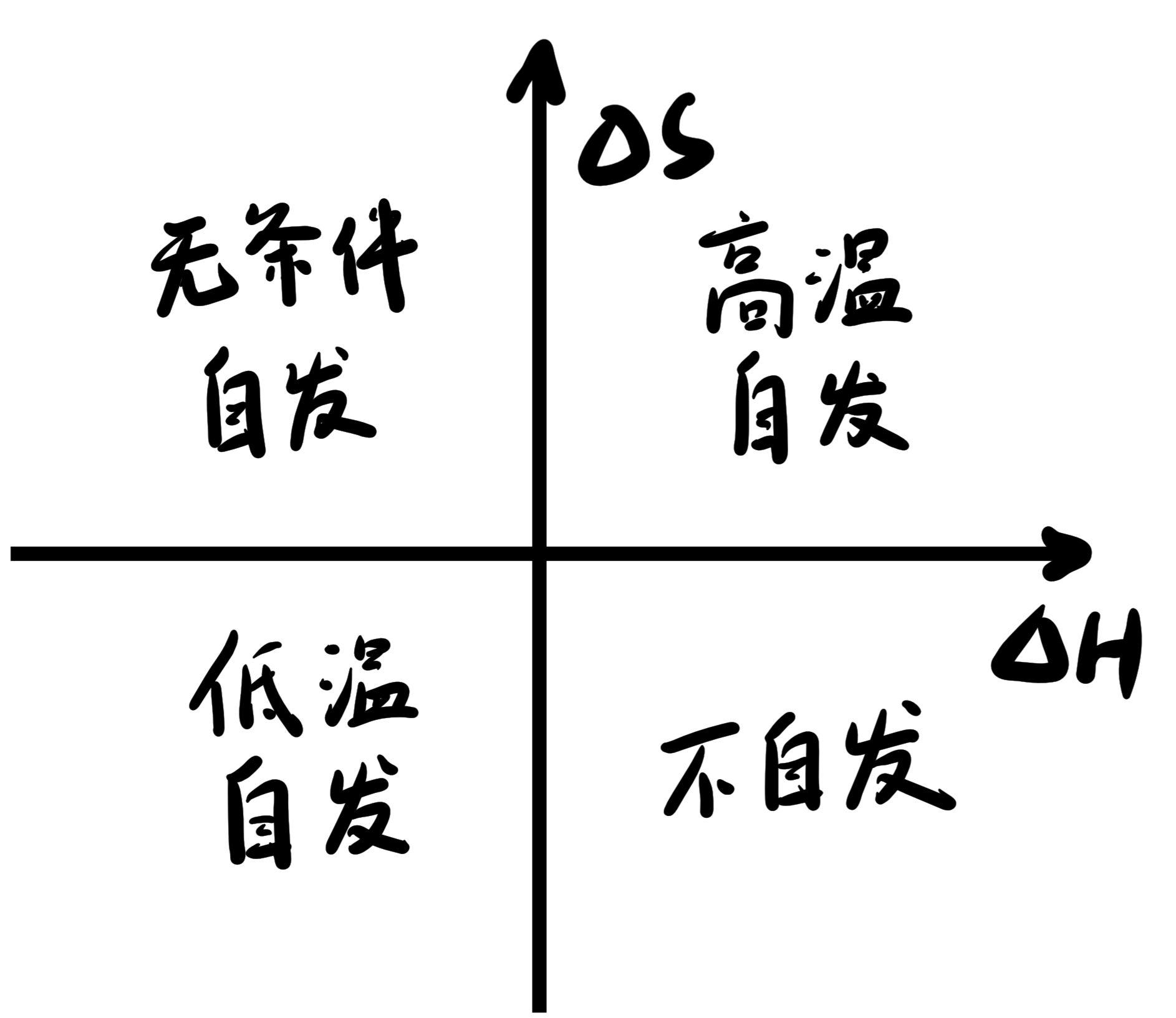
1.5 吉布斯自由能#
定义 ΔG=ΔH−T⋅ΔS,G 表示吉布斯自由能,ΔG 用来衡量反应能否自发。
- ΔG<0 自发进行
- ΔG=0 不能进行
- ΔG>0 逆反应自发进行
Part 2 动力学 —— 速率#
有净胜速率 v=ΔcΔt,瞬时速率。
瞬时速率 v正=v逆 时,反应达到平衡。
Part 3 热力学 —— 限度(平衡)#
首先先明确一点,K 是万能的(除非题目给了你信息),而勒夏特列原理是有局限的。
通常我们优先考虑勒夏特列原理,然后才考虑 K。
3.1 平衡的特征#
逆等动定变
3.2 平衡常数 K#
对于反应 aA(g)+bB(g)⇔cC(g)+dD(g),我们定义 Qc 为当前时刻的 cc(C)⋅cd(D)ca(A)⋅cb(B),K 为反应达到平衡时刻的 Qc。
- K 仅与 T 有关
- Qc 与 K 的关系可以判断平衡移动的方向。Qc>K 平衡逆向移动,Qc<K 平衡正向移动。
一个需要知道的尝试:K>105 几乎反应完全,K<10−5 几乎不反应。
有的题目还会出现用分压代替摩尔浓度求得的压强平衡常数 Kp。我们定义 A 物质分压 p(A)=p0⋅n(A)n总。(p0 表示总压)
K=cc(C)⋅cd(D)ca(A)⋅cb(B)=nc(C)⋅nd(D)na(A)⋅nb(B)⋅Va+b−c−d
Kp=pc(C)⋅pd(D)pa(A)⋅pb(B)=nc(C)⋅nd(D)na(A)⋅nb(B)⋅(n总p0)a+b−c−d=nc(C)⋅nd(D)na(A)⋅nb(B)⋅(VRT)a+b−c−d=K⋅(RT)c+d−a−b
如果题目给的是恒容条件,建议使用 K;恒压建议使用 Kp。
还有别的平衡常数:比如物质的量分数代替物质的量浓度。
3.3 ∗阿伦尼乌斯公式及速率常数 k#
对于反应 aA(g)+bB(g)⇔cC(g)+dD(g),瞬时反应速率 v正=k正⋅ca(A)⋅cb(B),v逆=k逆⋅cc(C)⋅cd(D)
- 阿伦尼乌斯公式:k=A⋅e−EaRT,也就是说温度越高 k 越大,活化能越高 k 越小。
- 我们其实可以写出 K 与 k 的关系:K=k正k逆=e(Ea逆 −Ea正 )⋅1RT
- 也就是说温度升高时,如果 Ea逆>Ea正(反应放热)那么 K 减小,Qc>K,平衡逆向移动。
3.4 勒夏特列原理#
勒夏特列原理是对恒容体系的平衡常数的定性经验总结
- 改变一个因素
- 平衡朝着减弱这个因素的影响的方向去移动
- 胳膊拧不过大腿,结果这个因素还是改变了。比如你升温,反应会朝着吸热的方向移动,但最终温度还是比原来高。
它的 K=c(C)c(A)⋅c(B)
- 如果升高温度,我们可以用 k正 和 k逆 来证明。
- 如果投入 A,那么 Q 的分母变大,Q<K,平衡正向移动。
- 如果增加压强 x 倍,根据 pV=nRT,我们可以得出 n 与 c 增大了 k 倍,把它带进 Q,分子多乘了一个 x,分母多乘了一个 x2,Q<K,平衡正向移动。
- 再比如说对于 A(g)+B(g)⇔2C(g) 这个反应,分子分母同时乘了一个 x2 所以平衡不移动。
那么它不能适用的就有以下几种情况:
- 定量计算平衡
- 改变多个因素,比如我同时增加 A,C 的量,或者同时增加压强和温度。
- 一方 c=1 且另一边只有一个气体 CaCO3(s)⇔CaO(s)+CO2(g) 加入 CO2 并不会有胳膊
3.5 ⋆等效平衡#
投料 = 投入原料
等效平衡就是说对于 aA(g)+bB(g)⇔cC(g)+dD(g),你用不同的方式投料,达到平衡时各物质浓度都一样,这样子所有的投料方式等效平衡。
恒温恒容的等效平衡:在恒温恒容的条件下,你充入 a mol A、b mol B 和充入 c mol C、d mol D 它们等效平衡。
你同时充入 a2 mol A b2 mol B c2 mol C d2 mol D 与上述两种方式等效平衡,以此类推。
原因就是原子守恒,且 K 不变。
对于不同的加料方式有不同的分析方法,以恒温恒容 N2+3H2⇔2NH3 为例。
假设已经加入了 1 mol N2 和 3 mol H2,反应达到平衡。
- 投料比相同,如果再加入 1 mol N2 和 3 mol H2 或者是 2 mol NH3,等价于加压,平衡相比原来的平衡正向移动,α(NH3) 减小。
- 投料比不同,如果仅加入 1 mol N2,α(H2) 一定增大,平衡正向移动,α(N2) 减小(高中阶段是这样的,你可以理解成加入 ∞ 的 N2 也会这样)。
- 投很多不同的,比如加入 114514 mol N2 和 1919810 mol H2,就把它拆开分析。
投料比不同,其实就是一个制约。如果仅加入 1 mol N2,那么 N2 就会被 H2 制约,因为 H2 的量有限,即使你加入 ∞ 的 N2 反应也不能彻底,而你的转化率显然降低。
如果投料比相同就是上文所说的等效平衡,从左边投和从右边投它们最终达到的结果是一致的,但是压强(物质的量,浓度)显然增大了,因此第一个例子 α(NH3) 减小。
恒温恒压的等效平衡:以反应 H2(g)+I2(g)⇔2HI(g) 为例
充入 1 mol H2、1 mol I2 和 2 mol H2、2 mol I2 和任意 mol HI 等效平衡。
等效平衡的形象的理解方式:
充入 2 mol H2、2 mol I2 等价于分开成两个相同容器同时反应,最后再把这两个容器合在一起。由于等压,V 变为两倍,浓度不变。
Part 4 水中电离水解平衡#
4.1 酸碱的电离及其电离平衡常数 Ka Kb#
- 强酸强碱一步电离
- 弱碱都是一步电离(高中范围内)
- 一元弱酸一步电离
- 多元弱酸分布电离,如 H2CO3⇔H++HCO−3⇔2H++CO2−3
- 两性物质两种电离方式
影响电离平衡的因素:
以 H2CO3 为例,因为有两步电离,所以它的平衡常数分别是 Ka1 和 Ka2。
- Ka1=c(H+)⋅c(HCO−3)c(H2CO3)
- Ka2=c(H+)⋅c(CO2−3)c(HCO−3)(其实是HCO−3 的电离)
酸是越电离越难电离的:多元弱酸相邻 Ka 数量级差值约为 105,因为第一步电离产生的 H+ 限制了之后的电离。所以看酸性强弱只用看第一步电离的 Ka 的大小。
有一些特例需要记住:
- N2H4 是个弱碱,它的电离方程式是:N2H4+H2O⇔N2H+5+OH−。
- 硼酸是一元弱酸:H3BO3+H2O⇔B(OH)−4+H+。
- CH3NH2+H2O⇔CH3NH+3+OH−
电离度 α=电离溶质物质的量浓度总溶质物质的量浓度×100%
4.2 水的离子积常数 Kw#
水可以电离出 H+ (H3O+)与 OH−,平衡常数可以写作 c(H+)⋅c(OH−)c(H2O)。纯液体的浓度视作 1,因此我们便去掉 c(H2O),得到:
Kw=c(H+)⋅c(OH−),这玩意显然仅跟温度有关,常温下为 10−14。
4.2.5 pH#
pH 的定义:一个溶液的 pH=−lgc(H+)。
同理你可以定义 pOH=−lgc(OH−)。
常温下水中 c(H+)=c(OH−)=10−7,因此中性溶液的 pH=7。
另一个公式:对于所有的 HA⇔H++A−
- pH=pKa+lg[A−][HA](如果题目真的让你计算则对于所有酸(酸式盐)都可以使用,因为多元酸的额第一步电离程度远大于后面几步)
需要了解的酸碱指示剂:

4.3 水解及水解平衡常数 Kh#
水解:弱酸根离子和 H+ 或者是弱碱阳离子和 OH− 的结合,可以看作是电离的逆过程。
以 CH3COO− 的水解为例,反应方程式是:CH3COO−+H2O⇔CH3COOH+OH−。
这个水解反应的平衡常数 Kh=c(CH3COOH)⋅c(OH−)c(CH3COOH−)
4.3.5 ∗酸碱质子理论#
酸碱质子理论认为,凡是能给出质子的物质都是酸,凡是能接受质子的物质都是碱。
HA酸⇔H+质子+A−共轭碱
| 共轭酸 |
CH3COOH |
H2CO3 |
HCO−3 |
NH3 |
NH+4 |
H2O |
H3O+ |
HCl |
| 共轭碱 |
CH3COO− |
HCO−3 |
CO2−3 |
NH−2 |
NH3 |
OH− |
H2O |
Cl− |
容易发现,电离和水解本质上都是质子的转移。电离的本质是水从酸那抢走一个质子变成 H3O+,水解的本质是酸根离子从水那抢走一个质子产生 OH− 。
较强酸与较强碱生成较弱酸和较弱碱的反应:HA酸I+B−碱II=HB共轭酸II+A−共轭碱I
酸性有 HA>HB,碱性有 B−>A−。
4.4 一些因素对电离的影响#
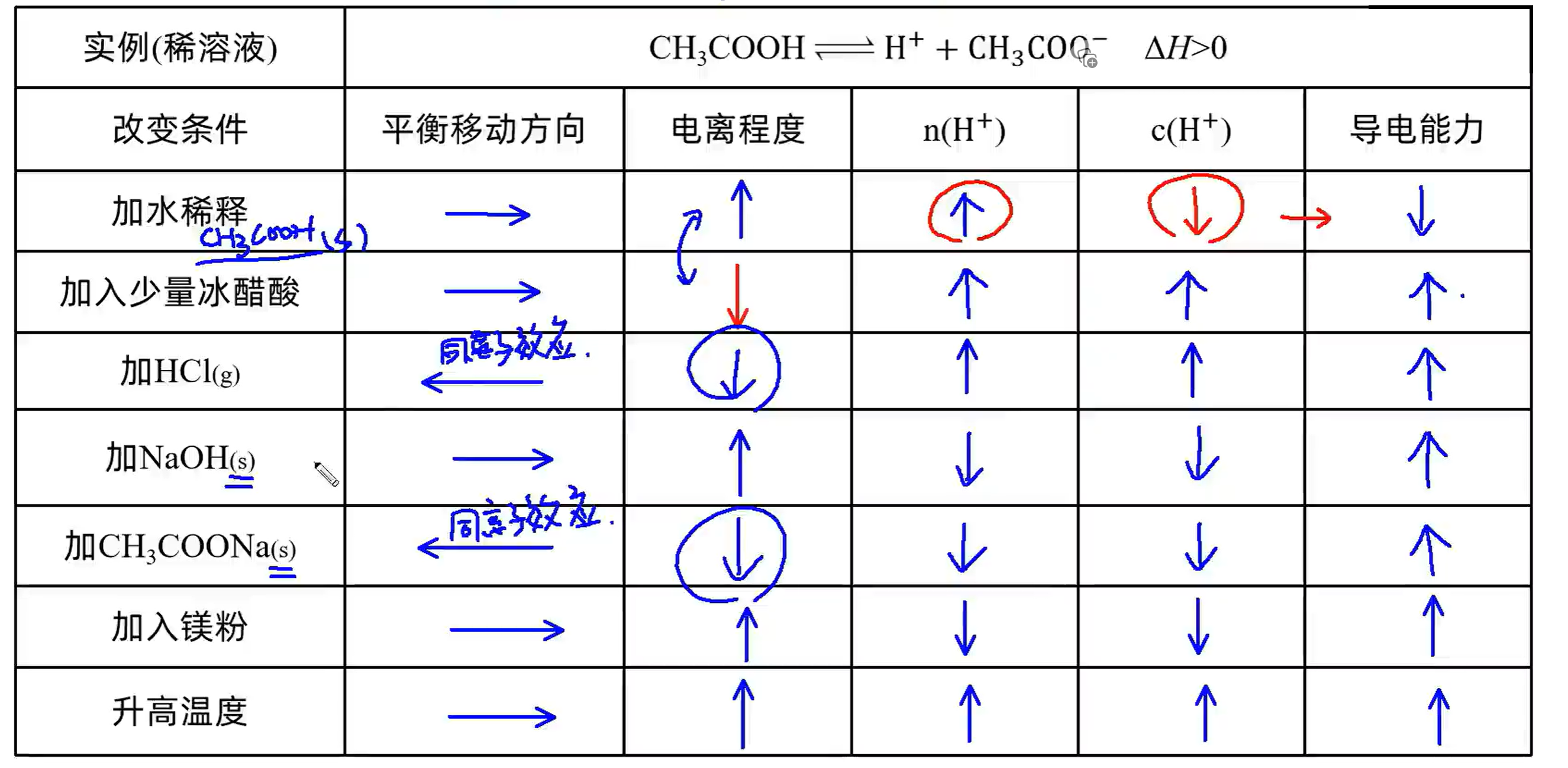
同离子效应就是加同种离子互相抑制电离。
加入溶质电离程度降低的原因是:等效平衡,类似于增大压强,因此平衡逆向移动。
4.5 剧烈的双水解#
剧烈的双水解就是说两个水解互相促进,导致两个水解都完全反应了。
剧烈双水解的例子:
- Al3+ 与 S2−,HS−,CO2−3/HCO−3,AlO−2
- NH+4 与 SiO−2,AlO−2
- Fe3+ 与 CO2−3/HCO−3,AlO−2
4.6 等量关系#
- 对于弱酸,有 Kai⋅Khi=Kw,结合具体例子理解
证明(以 CO2−3 为例):
- H2CO3 电离常数 Ka1=c(HCO−3)⋅c(H+)c(H2CO3),Ka2=c(CO2−3)⋅c(H+)c(HCO−3)
- HCO−3 水解常数 Kh1=c(H2CO3)⋅c(OH−)c(HCO−3),有 Ka1⋅Kh1=Kw。
- Ka2⋅Kh2=Kw 同理。
- 弱碱同理。
4.7 ⋆三大守恒#
以 NaHCO3 为例来书写,省去粒子前面的 c。
电子守恒:溶液成电中性,总正电荷与总负电荷数量相等。
- H++Na+=OH−+HCO−3+2CO2−3
物料守恒:盐中 Na 与 C 两种元素数量比为 1:1,水溶液中也应该如此。
- Na+=H2CO3+HCO−3+CO2−3
质子守恒:H+ 与 OH− 浓度本该相等,所以你需要找到那些 H+,OH− 所在之处。
- H++H2CO3=OH−+CO2−3
这三者知二可硬求一。
物料守恒:分别找到 Na 和 C 在水中的所有去处。
质子守恒:H2CO3 可以视作由原本的 HCO−3 抢夺了水中原本一个质子得到的,而 CO2−3 则可以视作由 HCO−3 丢失一个质子(从而减少一个水中原本的 OH−)得到的。
标箭头法:写出物料守恒和质子守恒的方法。
- 第一步,在纸的中央写出弱酸根盐。
- 第二步,向上写出不断水解得到的物质,向下写出不断电离得到的物质,用箭头连接。
- 若是物料守恒,找元素就完了。
- 若是质子守恒,则把 H+ 写在等号左边,把 OH− 写在等号右边。把向上水解的物质写在左边,把向下电离的物质写在右边,注意系数。
- 每标一个箭头表示该物质系数 +1。
原理:其实你画一遍你就懂了。快去画吧。
4.8 沉淀溶解平衡以及溶度积 Ksp#
把一个难溶电解质放入水中,既存在电解质电解生成离子进入水中的过程,也同时存在水中离子结合产生沉淀的过程。
以反应 AgCl⇔Ag++Cl− 的过程为例,有离子积 Qc=[Ag+]⋅[Cl−]。
我们定义溶度积 Ksp 为反应平衡时的 Qc。
溶解度:某温度下,100 g 溶剂最多溶解的溶质的质量。
溶解度大小 (g):易溶 (10),可溶 (1 - 10),微溶 (0.01 - 1),难溶 (< 0.01)。
4.9 一些计算实例#
H2S+CuSO4=H2SO4+CuS↓ 能反应的原因:
- 离子方程式:H2S+Cu2+=2H++CuS↓
- H2S 的电离:Ka1⋅Ka2=[H+]⋅[HS−][H2S]⋅[H+]⋅[S2−][HS−]=[H+]2[H2S]
- CuS 的沉淀:Ksp=[Cu2+]⋅[S2−]
- 反应的平衡常数 K=[H+][H2S]⋅[Cu]2+=[H+]⋅[S]2−[H2S]⋅[Cu]2+⋅[S]2−=Ka1⋅Ka2Ksp≈1016
- BaCl2 与 SO2 不能反应,计算过程同理。
4.10 比较 Ksp 以及沉淀转化#
通常我们认为一个离子浓度达到 10−6 或 10−5 就已经沉淀完全。
以 Fe(OH)3 为例,Ksp=[Fe3+]⋅[OH−]3
查表可知 Ksp=8×10−38,当 [Fe3+]=10−5 时,可以算出 [OH−]=3√KspFe3+=2×10−11,pH=3.3 的时候 Fe3+ 沉淀完全。
那么,其实这玩意就可以运用在工艺流程中 —— 分级调 pH 产生沉淀,这样就可以沉掉不需要的离子,保留需要的。
Part 6 电化学#
6.1 原电池#
6.2 电解池#
6.3 实例#






【推荐】国内首个AI IDE,深度理解中文开发场景,立即下载体验Trae
【推荐】编程新体验,更懂你的AI,立即体验豆包MarsCode编程助手
【推荐】抖音旗下AI助手豆包,你的智能百科全书,全免费不限次数
【推荐】轻量又高性能的 SSH 工具 IShell:AI 加持,快人一步
· 无需6万激活码!GitHub神秘组织3小时极速复刻Manus,手把手教你使用OpenManus搭建本
· Manus爆火,是硬核还是营销?
· 终于写完轮子一部分:tcp代理 了,记录一下
· 别再用vector<bool>了!Google高级工程师:这可能是STL最大的设计失误
· 单元测试从入门到精通