Characterization of urinary exosomes purified with size exclusion chromatography and ultracentrifugation(尺寸排阻色谱与超速离心纯化尿液外泌体的表征)解读人:徐宁
期刊名:Journal of proteome research
发表时间:2020年6月
IF:4.074
单位:
- 复旦大学化学系和生物医学科学研究所
- 大连医科大学附属第二医院泌尿外科
技术:分子排阻色谱,超速离心,Western blot,纳米颗粒跟踪分析,荧光显微,Nano-LC-MS/MS等
一、 概述:
本研究采用分子排阻色谱(size-exclusion chromatography, SEC)和超速离心(ultracentrifugation, UC)两种方法分离尿液中的外泌体,随后比较了两种方法制得外泌体的特性,发现SEC外泌体的回收率更高,所得尺寸可用SEC色谱评估;而UC由于使外泌体发生溶解或不完全沉淀情况,因此回收率较低。对两种方法得到的外泌体进行受体细胞内化能力比较,结果显示SEC纯化的外泌体有更高的受体细胞内化率。
二、 研究背景:
外泌体是真核细胞分泌的一类纳米级胞外囊泡,作为细胞间通讯的重要信使参与了很多生物学过程,近年来对其研究与日俱增。很多研究表明外泌体在调控受体细胞生物学活性与靶向药物呈递过程中扮演重要作用,还有研究发现尿液外泌体能够提供比未分离尿液更准确的疾病诊断与预测,因此可以作为疾病诊断的新型生物标志物。研究还发现尿液和细胞系培养基质中分离所得外泌体可以依据尺寸分组,不同组别外泌体的内容物有显著差异,说明其来源与所调控的受体细胞均不同。
但由于体液的复杂性与外泌体体积小、密度低的特点,外泌体的分离具有很大的挑战性。现在广泛用于外泌体研究的是超速离心法和分子排阻色谱法,前者基于理化性质制备外泌体,但长时间的高速离心易破坏外泌体的膜结构,此外还存在耗时、耗力且需要昂贵仪器的缺点;后者基于外泌体的分子大小进行分离。本文旨在比较这两种方法提取尿液外泌体的表征,确定分离外泌体的最佳方法。
三、实验设计:

四、研究成果:
1、SEC外泌体与UC外泌体的表征。UMOD是尿液中的高丰度蛋白,可看做外泌体提取的污染物;TSG101和CD9都是外泌体标志物。

图1 提取尿液样本中外泌体的两套方法流程(上:SEC法。下:UC法)
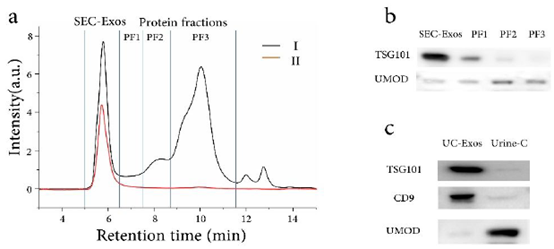
图2 a:尿液浓度监测的SEC色谱图(Ⅰ:280nm紫外吸收,Ⅱ: 荧光波长λex/em = 550/565 nm。PF1/2/3: 蛋白馏分1/2/3)。b: SEC外泌体与提取蛋白的Western blot结果。c: UC外泌体与尿液上清液(Urine-C)的Western blot结果。
2、SEC与UC提取外泌体的回收率比较。根据BCA蛋白定量评估蛋白回收率,纳米颗粒跟踪分析评估外泌体回收率,结果均为SEC外泌体回收率高于UC外泌体。
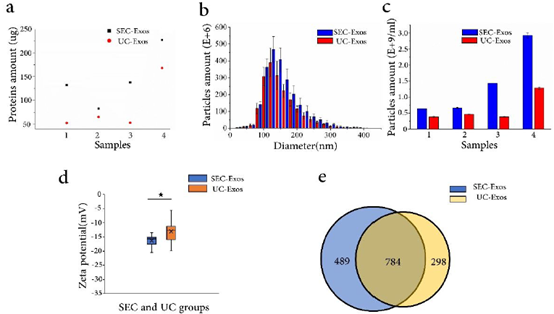
图3 比较SEC与UC的外泌体回收率(a),外泌体尺寸分布(b),颗粒回收率(c),Zeta电位(d),蛋白鉴定数(e)。
3、UC过程中外泌体破裂。
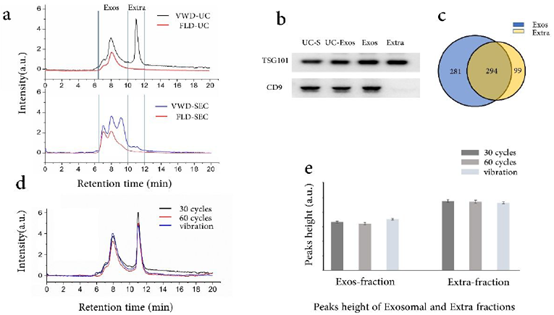
图4 (a)UC外泌体(上)与SEC外泌体(下)的色谱图。(b)超速离心上清(UC-S), UC外泌体, 外泌体碎片(Exos)和外部碎片(Extra)的Western blot结果。(c)外泌体碎片与外部碎片的蛋白鉴定结果。(d)重悬UC外泌体的色谱图。(e)重悬外泌体碎片与外部碎片的峰高。

图5 (a)SEC外泌体,UC外泌体与UC上清液的色谱图。(b)UC外泌体,SEC外泌体与UC上清液中外泌体的蛋白数。
4、SEC外泌体与UC外泌体的内化能力。外泌体可以通过不同机制(融合、受体内吞、胞饮、吞噬)由受体细胞内化。与两种细胞系共培养的结果显示,荧光标记的SEC外泌体与UC外泌体的内化能力存在差异,前者具有更强的内化能力。UC过程导致外泌体结构受损可能导致其无法被受体细胞识别。而SEC外泌体保留了结构完整性与生物学活性,更有利于后续分析。
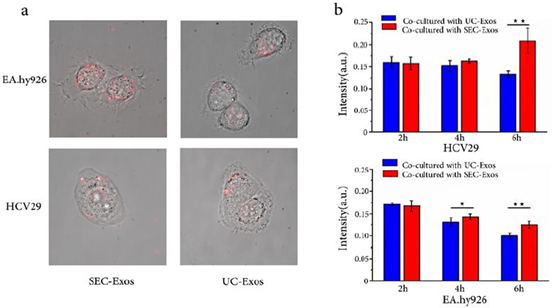
图6 (a) EA.hy926和HCV29细胞系中提取的SEC外泌体和UC外泌体。(b)孵育2,4,6小时,受体细胞与SEC外泌体、UC外泌体共培养的荧光强度结果。
五、结论:
虽然超速离心仍然是分离外泌体的主要方法,但已有很多研究报道了这种方法的缺点。本研究比较了SEC外泌体和UC外泌体的回收率,前者高于后者。这可能与UC过程中外泌体破裂与不完全沉淀有关。且与UC外泌体相比,SEC外泌体在受体细胞内化方面的能力更强。因此,在使用超速离心法分离外泌体时,应探索合适的离心时间与速度,以维持外泌体结构稳定、提高回收率与质量。
阅读人:徐宁
DOI:10.1021/acs.jproteome.9b00693



 浙公网安备 33010602011771号
浙公网安备 33010602011771号