Serum Targeted HILIC-MS Metabolomics-based Analysis in Infants with Ureteropelvic Junction Obstruction(血清靶向HILIC-MS代谢组学在婴幼儿肾盂输尿管连接部梗阻中的应用)解读人:黄旭蕾
期刊名:Journal of Proteome Research
发表时间:(2020年5月)
IF:3.780
单位:1Paediatric Nephrology Unit, First Department of Paediatrics, Hippokratio Hospital, Aristotle, University of Thessaloniki
研究对象:婴幼儿肾盂输尿管连接部梗阻
技术:靶向HILIC-MS代谢组学
一、 概述:(用精炼的语言描述文章的整体思路及结果)
肾盂输尿管连接部梗阻(UPJO)是新生儿和婴儿梗阻性肾病的主要病因。关于UPJO的机制、评估和治疗的基本问题仍然没有答案。本研究的目的是通过对UPJO患儿的血清代谢谱分析,阐明UPJO患儿与非手术患儿和正常年龄对照组的潜在差异。最终的目标是利用找出的生物标记物进行早期诊断。本研究收集了20名术前患者、19名保守治疗的轻度狭窄患者和17名健康对照者的血清样本。采用亲水作用液相色谱-质谱联用技术(HILIC-LC-MS/MS)对所有样品进行靶向代谢组学分析,随后进行单变量和多变量统计分析。PCA和OPLS-DA评分图显示,研究组之间存在显著差异,包括肌酐、色氨酸、胆碱和天冬氨酸在内的一组代谢物将需要手术的患者与系统监测后的患者以及健康对照组区分开来,显示出作为UPJO疾病指标的潜能。
二、研究背景:(简要介绍研究进展动态、研究目的和意义)
肾盂输尿管连接部梗阻(UPJO)是梗阻性肾积水的主要病因,经产前超声筛查,其发生率约为1/1500。由于三分之二的UPJO患儿不存在肾损伤或不需要手术,肾积水会自然改善,临床医生要决定谁需要肾盂成形术,因而是一项重大挑战。目前对婴儿和儿童UPJO的诊断方法是基于超声检查或有创性放射性同位素检测的连续监测,但似乎无法可靠地确定患者是否有明显的梗阻,是否有发展为永久性肾损害的风险。不幸的是,肾盂扩张与肾闪烁显像的相关性仅在最严重的病例中是可预测的,而在大多数“中间”病例中是不可预测的。此外,关于新的生物标记物在早期检测婴儿和儿童UPJO肾损害方面的准确性和可靠性,也有不同的结果。
代谢组学作为分析生物化学中一种有用且应用广泛的工具,在实时监测肾功能和检测不良肾事件方面具有重要的作用。基于代谢组学的分析可以定性或定量地同时测定基质中的大量内源性小分子化合物,从而提供生命系统的整体代谢特征。考虑到当前传统标记物的局限性,小分子代谢物可以为肾脏疾病的新的生物标记物提供机制上的见解。
本研究的目的是阐明患有UPJO的婴儿的代谢谱是否与健康婴儿的代谢谱有显著差异,以及这些差异是否能导致识别新的生物标记物,从而实现早期诊断肾功能不全。此外,也研究是否代谢谱的指标能够区分外科和非外科病例,以及它们是否有助于这些病人的长期随访。为了达到我们的目标,我们设计了一个前瞻性的病例对照研究,在这个研究过程中,我们确定了患者和对照组的代谢谱,并建立了梗阻性肾病的影像学和血清生物标记物。
三、实验设计:

四、研究成果:(重点图表展示)
所有受试组共测定了54种低分子量血清代谢物,其中48种通过了所有质控设定。测定的代谢物包括氨基酸、胺、有机酸、酰基肌醇、维生素和核苷酸。在本文中,目的仅仅是比较样品之间的代谢物趋势,因此使用了峰面积进行比较分析。
从OPLS-DA评分图(图1a)看出,血清样本被清楚地分离:A组(手术组)和C组(对照组),其中7种代谢物对两组的分离影响最大。3-羟基异戊酸、肌酐、泛酸、5-氧丙烷均下调,而同型半胱氨酸、异亮氨酸和色氨酸均较正常值上调(对照组)。
从OPLS-DA模型(图1b)看出,手术病例也可与保守治疗的病例(B组)区分开来,。在此情况下,8种代谢物被突出显示,即天冬氨酸、胆碱、二甲胺、甘氨酸、异亮氨酸、亮氨酸、苯丙氨酸和5-氧丙烷,均呈现VIP值>1.0。从这一比较中,B组的所有调节代谢物均呈下降趋势。
OPLS-DA评分图(图1c)也显示了保守治疗的患者(B组)和健康对照组(C组)之间的明显区别。这一比较似乎在研究组之间具有最大的统计差异,共有10种代谢物受到影响,其中包括3-羟基异戊酸、乙酰肉碱、胆碱、肌酐、二甲胺、谷氨酸、甘氨酸、泛酸、5-氧丙烷和色氨酸。分化代谢产物VIP值>1.0,q值<0.05,倍数变化>30%,除色氨酸外,B组均呈下降趋势。
表2给出了评价OPLS-DA模型有效性的参数,如R2Y、Q2Y、CV-ANOVA的p值,以及模型的特异性和敏感性,而表3给出了所有改变的血清代谢物及其各自的q值、VIP得分、倍变值和曲线下面积(AUC)值。可见,交叉验证的CV-ANOVA分析的p值对所有构建的模型均<0.05。此外,所有情况下的R2Y和Q2Y都被认为是令人满意的。此外,图2还构建了所有独立的重要个体代谢物的接收器工作特性(ROC)曲线。所有计算的AUC值在0.70到0.86之间,显示出可接受的临床模型。
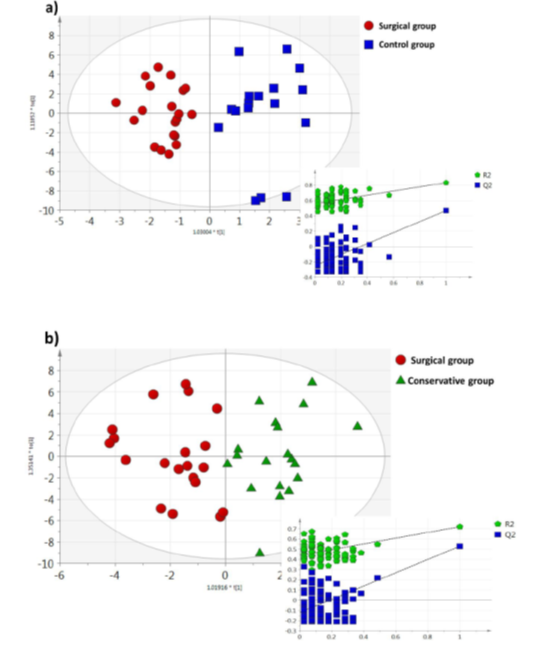
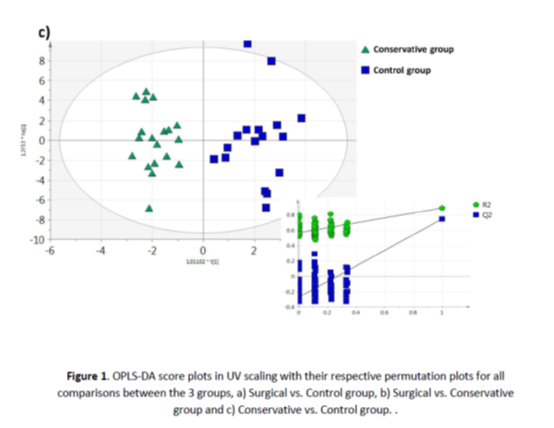
图1:所有3组间比较的UV缩放的OPLS-DA评分图及其各自的置换图,a)手术组与对照组,b)手术组与保守组,c)保守组与对照组
表2:UPLO婴儿与年龄匹配的对照组及相互比较的OPLS-DA模型的交叉验证数据
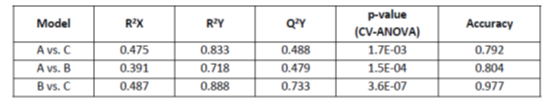
表3:对区分研究组差异有贡献的代谢物
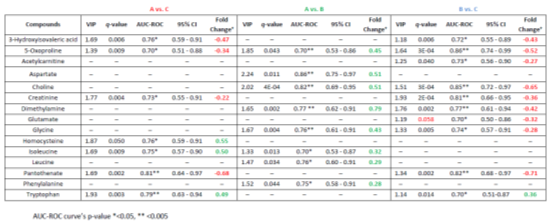
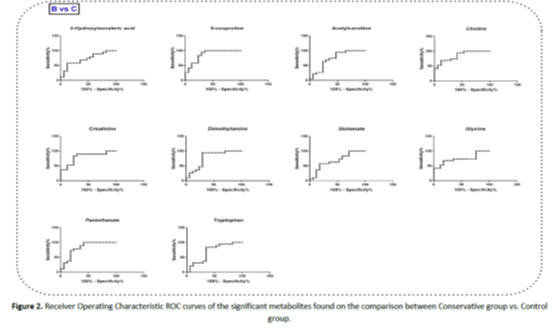
图2:保守组与对照组比较中发现的重要代谢物的ROC曲线
五、文章亮点(结论讨论):
在本研究中,结合临床和代谢组学资料,健康人的代谢组中与患有UPJO的新生儿和婴儿的血清代谢组具有明显差异。导致分化的代谢物如表3所示。在疾病组中发现显著改变的生化途径如图3所示。
总的来说,本研究的发现与以前在啮齿动物模型中进行的研究一致,并扩展了新生儿对UPJO的认识。一些氨基酸相关的生化途径被发现受到影响,但没有迹象产生由于慢性纤维化的情况而发生的严重代谢负担。在受干扰的代谢物色氨酸中,胆碱(分别来自A vs C组和B vs C组)和天冬氨酸(分别来自A vs B组)可能是一个很有前途的生物标记物小组,根据单变量和多变量统计分析的结果来评估是否存在肾代谢失衡。肌酐的最高得分从统计分析中证明其在肾脏相关疾病中的临床意义。对这些发现的探讨有助于加深对疾病机制的认识,支持血清生化和肾脏组织病理学的研究。
对病人结果的生化解释是一个具有挑战性的步骤。以往在动物模型中进行的研究,通常更可控,为进一步的研究提供了可靠的信息。基于患者代谢谱的疾病机制阐明遇到了与药物治疗、膳食摄入和不同遗传背景等因素有关的困难。在人类研究中,对照组不能完全匹配,而内源性化合物的基线水平可能不同。本研究由于监测到的代谢物数量有限,只能进行谨慎的推测。只有分析与受影响生化途径有关的所有代谢物才能得出安全的结论,否则,剖面图只能提供在样本采集时捕获的快照,而不能提供找到途径方向的有力证据。血液(血清和血浆)代谢组在慢性肾病相关疾病中易受损害,可进一步用于支持建立良好的临床血液标记。本研究旨在为进一步研究和验证潜在的生物标记物奠定基础,这些生物标记物可与临床实践的发现同时使用。
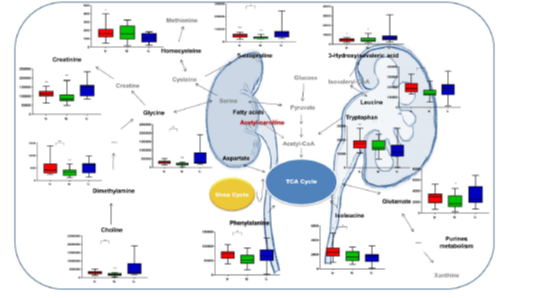
图3:新生儿和婴儿UPJO的所有分化代谢产物及其各自的生化途径。
阅读人:黄旭蕾
DOI:10.1021/acs.jproteome.9b00855



 浙公网安备 33010602011771号
浙公网安备 33010602011771号