Dysregulation of Exosome Cargo by Mutant Tau Expressed in Human-induced Pluripotent Stem Cell (iPSC) Neurons Revealed by Proteomics Analyses(蛋白质组学揭示了人诱导的多能干细胞(iPSC)神经元中表达的突变Tau对外泌体的失调) 解读人:梁玉婷
期刊名:MCP
发表时间:(2020年4月)
IF:4.828
单位:Skaggs School of Pharmacy and Pharmaceutical Sciences, University of California San Diego
物种:人
技术:LC-MS/MS Tandem Mass Spectrometry; label free quantitation
一、 概述:(用精炼的语言描述文章的整体思路及结果)
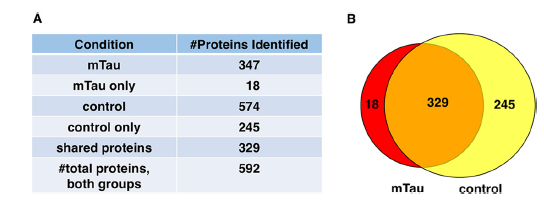
本研究以人iPSC神经元合成的外泌体为实验材料,进行LC-MS/MS分析,展示了wt-Tau外泌体和m-Tau外泌体的蛋白质组学差异。研究发现了18个蛋白仅出现在m-Tau外泌体中,245个蛋白仅出现在wt-Tau外泌体中,329个蛋白在两种外泌体中均被鉴定到。
二、 研究背景:(简要介绍研究进展动态、研究目的和意义)
高磷酸化的Tau蛋白可聚集成神经原纤维缠结(NFTs),大脑中的NFTs和淀粉样蛋白斑累积可导致阿兹海默症。iPSC神经细胞是用来研究由外泌体介导的Tau积累和增殖的模型,m-Tau可导致其NFTs明显增多。最近的研究表明,外泌体与Tau蛋白的转运有关。虽然m-Tau能通过外泌体转运,但m-Tau是否能够影响外泌体的蛋白组成还不清楚,为了解决这个问题,研究人员对wt-Tau外泌体和m-Tau外泌体进行了全蛋白质组分析。研究结果显示m-Tau引起了外泌体蛋白的失调。
三、实验设计:

四、研究成果:(重点图表展示)
1、在m-Tau模型和control模型中,分别鉴定到347和574个蛋白,其中,329个蛋白在两种模型中都鉴定到了,18个蛋白仅在mTau模型中鉴定到,245个蛋白仅在control模型中鉴定到。
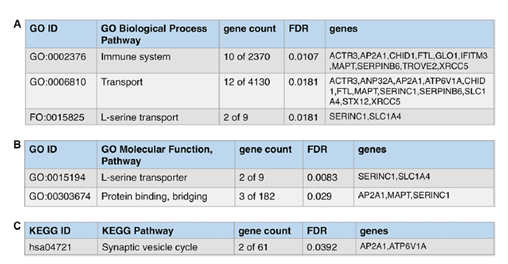
2、对仅在m-Tau模型中鉴定到的18个蛋白进行GO注释和KEGG通路分析,这些蛋白涉及转运、免疫、蛋白结合和突触囊泡等过程,而这些过程通常与阿尔茨海默症、神经退行性疾病有关。
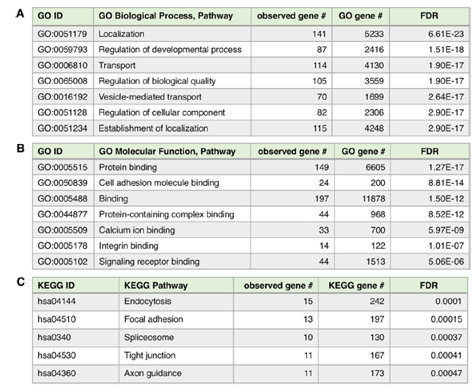
3、对245个仅在control组中鉴定到的蛋白进行GO注释和KEGG分析,GO biological process显著富集到了定位和包括囊泡介导的转运,GO molecular function显著富集到了蛋白质结合、细胞黏附、钙离子结合等多种结合相关的分子作用,这些蛋白并未在m-Tau模型中鉴定到,提示m-Tau可能阻止这些功能蛋白包装到m-Tau外泌体中,从而使转运和结合功能失调。245个蛋白中有234个蛋白有显著的蛋白互作网络,其中互作最多的两个蛋白为RHOA和AHSG,RHOA是控制细胞骨架和突触可塑性的GTPase,AHSG与突触、神经突的定位和表达水平相关。

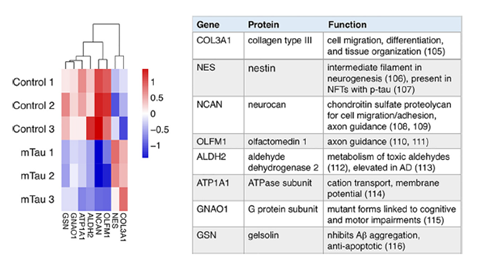
4、对329个共享蛋白进行GO注释,发现这些蛋白代表基本的外泌体功能,包括囊泡介导的转运,胞吐作用和分泌过程,随后对共享蛋白进行无标定量,结果显示在m-Tau模型中,NCAN,OLFM1,ALDH2,ATP1A1,GNAO1和GSN明显下调,COL3A1和NES明显上调。这些发现表明,m-Tau通过上调和下调蛋白水平来调节外泌体过程。
五、文章亮点(结论讨论):
这篇文章证明了m-Tau的表达改变了外泌体蛋白质组,包括增减外泌体中的蛋白种类及调节蛋白水平。一些与阿尔茨海默症和神经退行性疾病有关的蛋白仅在m-Tau外泌体中出现,而将近一半的蛋白质在m-Tau外泌体中缺失,这些蛋白代表了定位、转运、囊泡介导转运的途径,以及细胞粘附、复合物、钙、整合素和信号转导中的蛋白结合功能,m-Tau通过某种方式阻止了这些蛋白包装到外泌体中。确定m-Tau表达过程中可能导致的细胞蛋白质组变化,深入了解m-Tau表达和m-Tau外泌体对细胞神经毒性的影响,将是未来研究的重点。
阅读人:梁玉婷


 浙公网安备 33010602011771号
浙公网安备 33010602011771号