Accelerated Lysis and Proteolytic Digestion of Biopsy-level Fresh Frozen and FFPE Tissue Samples Using Pressure Cycling Technology (压力循环系统可加速新鲜冻存和福尔马林固定样本的裂解及蛋白酶解)【分享人:张雨星】
题目:Accelerated Lysis and Proteolytic Digestion of Biopsy-level Fresh Frozen and FFPE Tissue Samples Using Pressure Cycling Technology (压力循环系统可加速新鲜冻存和福尔马林固定样本的裂解及蛋白酶解)
期刊名:Journal of proteome research
发表日期:2020.5.17
影响因子(IF):3.78
DOI: 10.1021/acs.jproteome.9b00790
作者及单位
1、 Huanhuan Gao;Key Laboratory of Structural Biology of Zhejiang Province, School of Life Sciences, Westlake University, Institute of Basic Medical Sciences, Westlake Institute for Advanced Study
2、 Fangfei Zhang;Key Laboratory of Structural Biology of Zhejiang Province, School of Life Sciences, Westlake University, Institute of Basic Medical Sciences, Westlake Institute for Advanced Study
3、 Yi Zhu;Key Laboratory of Structural Biology of Zhejiang Province, School of Life Sciences, Westlake University, Institute of Basic Medical Sciences, Westlake Institute for Advanced Study
4、 Tiannan Guo;Key Laboratory of Structural Biology of Zhejiang Province, School of Life Sciences, Westlake University, Institute of Basic Medical Sciences, Westlake Institute for Advanced Study
一、 概述
随着蛋白质组开始应用于精准医学,高通量成为对临床样本进行定性定量的首要问题,受限于传统过于耗时的蛋白提取、酶解方法,压力循环技术(pressure cycling technology)可以显著的缩短这一过程,并且能在包括冷冻样本和福尔马林固定,石蜡包埋的样本(FFPE)等常见临床样本中保证较高的效率及重复性。传统基于的PCT的蛋白提取及酶解方法主要包括4步:1)PCT辅助的组织蛋白提取;2)蛋白的还原烷基化;3)PCT辅助Lys-C酶解;4)PCT辅助的胰蛋白酶酶解。每一步结束均需要人工操作,打开PCT小管加入对应的试剂,当样本量较大时就会显得非常乏味,同时也延长了整个过程的时间。
本篇文章在不改变流程的情况下,对传统的4步方法合并为2步,并优化了其中试剂的比例,在不降低肽段得率和质谱的定性、定量结果的情况下,整体时间缩短了一半,更有助于蛋白质组学在临床医学上的应用。
二、 优化步骤及实验流程
传统的PCT从蛋白提取到最后得到酶解的肽段需要4步,如图1A所示,而作者首先尝试着将前两步合并为一步,在样本没有裂解、蛋白还没有被提出来之前就加入了用于还原的TCEP和用于烷基化的IAA,传统的方法中没有将两者合并时因为一般认为两个步骤的反应条件不同,但作者通过实验发现,合并前两步之后最后肽段的得率、漏切、肽段于蛋白的质谱鉴定数目与传统步骤相比没有明显的变化。随后他们将后两步也合并在一起,发现按照常规Lys-C和trypsin的比例加入时,肽段的漏切率会明显增加。随后他们对酶的比例做了相应的优化,当把trypsin与肽段的比例从1:50增加为1:25时,肽段漏切率明显下降。(图2)

图1. 传统PCT辅助的蛋白质组学流程(A)与优化后的PCT辅助的蛋白质组学流程(B).

图2. 不同trypsin与肽段的比例对肽段酶解及质谱鉴定的影响。(A)每毫克新鲜冷冻(FF)小鼠肝脏样本中肽段的得率。(B)肽段的漏切率。(C)肽段的质谱鉴定数目。(D)蛋白的质谱鉴定数目。
三、 与传统PCT的比较及临床应用
首先作者将优化后的PCT流程与传统PCT流程下的实验结果做了比较,使用了小鼠肝脏的冷冻样本(FF),通过比较发现,在优化后的PCT流程下,小鼠肝脏冷冻样本无论是肽段的得率,肽段的质谱鉴定率还是蛋白的鉴定率,都有略微的提升,而肽段的漏切率还有明显的下降(图3),随后作者又用福尔马林固定,石蜡包埋(FFPE)的小鼠肝脏组织对两种PCT流程进行了对比,优化后的PCT结果与FF样本类似,肽段的得率、鉴定数目、蛋白鉴定数目与传统PCT方法相比没有明显的差别,而肽段的漏切率相对传统PCT有明显的下降(图4)。
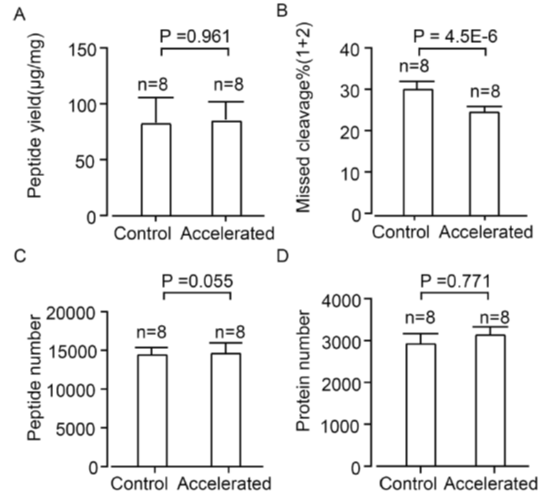
图3. 传统PCT流程与优化后的PCT流程在小鼠肝脏冷冻组织中的结果对比。(A)每毫克肝脏样本的肽段得率。(B)肽段漏切比例。(C)肽段的质谱鉴定数目。(D)蛋白的质谱鉴定数目。
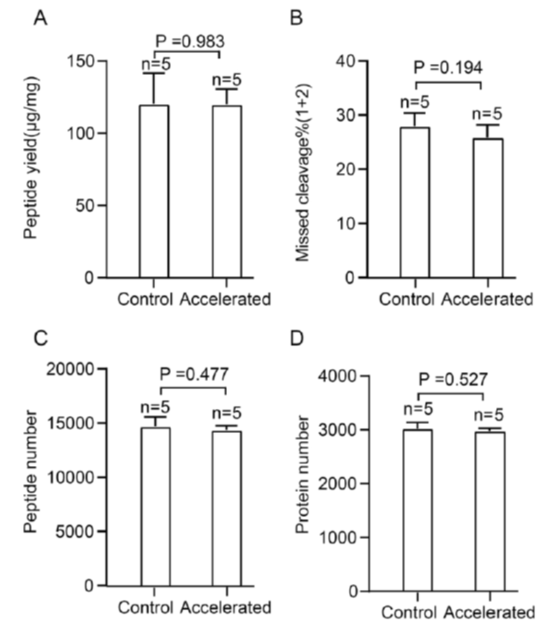
图4. 传统PCT流程与优化后的PCT流程在小鼠肝脏FFPE组织中的结果对比。(A)每毫克肝脏样本的肽段得率。(B)肽段漏切比例。(C)肽段的质谱鉴定数目。(D)蛋白的质谱鉴定数目。
在确定了优化后的PCT流程在蛋白鉴定方面与传统的PCT流程没有区别外,作者又进一步对蛋白定量方面做了比较,他们首先制备了10份肝癌细胞FFPE组织样本(5份良性样本,5份恶行肿瘤),采用15分钟短梯度的SWATH质谱方法对两种方法酶解的肽段进行定量比较。
从质谱结果来看,在HCC FFPE样本中,两种PCT流程制备的肽段在得率上接近(图5A),通过SWATH的定量结果可以看到两者之间有非常好的相关性(图5B,5C),证明了在定量方面优化后的PCT流程依然可以得到与传统PCT方法一致的结果。
由于短梯度的SWATH可定量蛋白只有3828,为了进一步测试优化的PCT方法在定量中的影响,作者选择了常规梯度的10标TMT和PulseDIA对同样的10组HCC FFPE样本进行定量比较(图5D)。从结果可以看出(图5E,F),优化的PCT制备得到的肽段在常规10标TMT和PulseDIA中均可以得到较高的肽段和蛋白鉴定率,同时较低的定量缺失值(10标TMT为1.59%,PulseDIA为12.3%),两次技术重复之间也都有较高的相关性。
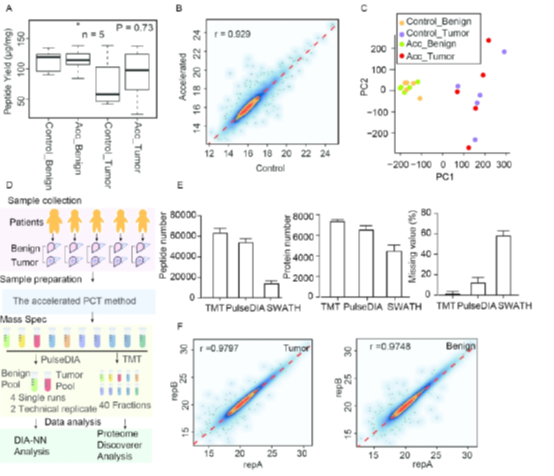
图5. 优化后的PCT在HCC FFPE样本中的表现。(A)每毫克组织样本的肽段得率。(B)传统PCT与优化PCT定量结果的皮尔森相关系数。(C)两种方法结果的PCA分析。(D)10标TMT和PulseDIA的实验流程。(E)三种定量方法的肽段的鉴定数目、蛋白鉴定数目及定量缺失值比例。(F)PulseDIA两次技术重复定量结果之间的皮尔森相关系数。
最后,作者将他们优化的PCT流程应用于25例HCC病人队列,包括来自于同一病人的良性肿瘤和恶性肿瘤。病人信息及质谱上机分组如图6A,6B。最终经过数据分析,他们鉴定到774个在恶性肿瘤组织中上调和234个下调的蛋白,肿瘤组织的高表达蛋白中鉴定到了之前被报道过的多种在HCC中高表达的蛋白,包括MCM7、MAPRE1、SSRP1等。证明了优化过的PCT方法不会影响组织样本的真实情况。
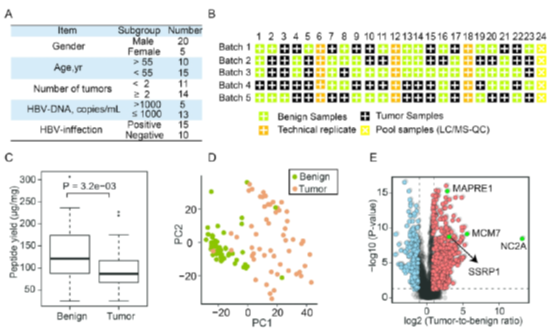
图6. 优化后的PCT流程应用于HCC病人队列。(A)25位病人的相关病例信息。(B)上机批次安排。(C)每毫克组织的肽段得率。(D)25对良性与恶行肿瘤组织定量结果的PCA分析。(E)恶行肿瘤组织相对于良性肿瘤组织蛋白表达倍数的火山图(差异倍数>2倍,P value <0.05),上调用红色表示,下调用蓝色表示。
四:总结
本篇文章作者对传统PCT流程进行了优化,将传统流程中的4步合并为了2步,将这个流程时间减少了近一半,并且将优化的流程与传统流程制备的样本进行了多个层次的比较,并最终通过应用在HCC FFPE样本中证明优化后的PCT流程除了可以减少时间,降低肽段的漏切等优势外,相对于传统的PCT并没有任何缺点,能够保证蛋白的定性和定量,并能真实的反应样本中的蛋白表达差异。整篇文章实验数据扎实,可以确定优化后的PCT流程确实可行,个人认为作者优化PCT流程的思路也可以在传统不基于PCT的样本制备方法中进行尝试,以提升蛋白组学的通量。
分享人:张宇星


 浙公网安备 33010602011771号
浙公网安备 33010602011771号