Nature Methods | 王崇志 | 组合“天然”与“组学”质谱来鉴定跟膜蛋白结合的内源配体
文献名:Combining native and ‘omics’ mass spectrometry to identify endogenous ligands bound to membrane proteins(组合“天然”与“组学”质谱来鉴定跟膜蛋白结合的内源配体)
期刊名:Nature Methods
发表时间:(2020年5月4日)
IF:28.467
单位:
- 英国牛津大学
- 英国牛津OMass Therapeutics公司
- 瑞典卡罗林斯卡学院
- 英国南安普顿大学
- 美国Thermo Fisher Scientific公司
物种:大肠杆菌,红球菌
技术:天然质谱+组学质谱
原文链接:https://doi.org/10.1038/s41592-020-0821-0
微信文章封面摘要:牛津大学Gault等人提出了基于GC-MSn的天然组学(nativeomics),能鉴定膜蛋白上的配体,其要点是检测完整蛋白质-配体组合体、接着在同一质谱实验中解离和鉴定单个配体。
微信文章封面配图:
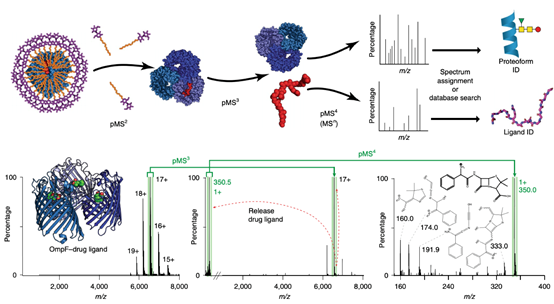
本文缩略语:
nMS:native MS,天然质谱
MSn:multi-stage MS,多级质谱,pMS3即三级质谱
一、 概述:(用精炼的语言描述文章的整体思路及结果)
结合在蛋白质组装体上的配体提供了关于功能的关键信息,但通常很难捕获和定义。该研究中作者开发了一种自顶向下的方法,称为天然组学(nativeomics),用天然质谱来统一“组学”(脂质组学、蛋白质组学、代谢组学)分析,以鉴定膜蛋白质组合体上的配体。通过整个实验过程中保持蛋白质和配体之间的连接,作者定义了跟膜蛋白和线粒体转运体相联系的脂质组/代谢组,以便发现蛋白质功能的潜在调控子。
二、 研究背景:(简要介绍研究进展动态、研究目的和意义)
决定跟蛋白质组装体直接接触的脂质、代谢物和辅因子的化学本质是一个重大挑战,这个挑战因来自电子显微镜和晶体成像的大量图像而陡然成为焦点,这些图像带有未分配或分辨率较差的配体密度。识别小分子结合物的现有策略通常依赖于大规模筛选,或者涉及未知分子的化学提取,并使用“组学方法”(蛋白质组学、脂质组学、代谢组学)来进行分析和生物信息学推断。这些方法通常需要配体化学的一些先验知识,而且重要的是,萃取操作切断了结合物与配体之间的联系。随后必须通过额外的原始蛋白质/复合物孵育实验来确认所推断的配体,排除掉多种伴随互作的鉴定结果,并合理解释为何许多受体仍是不带已知内源性配体的“孤儿”。
天然质谱(nMS)让我们能直接观测结合在可溶蛋白和膜蛋白上的内源性配体。但是,仅靠质谱测量不足以推导出配体的化学性质(例如,脂质类别),更不用说定义异构体(例如,不同的烃链长度或不饱和度),而这两者对于确定膜蛋白和双层脂质又都很重要。要在不事先提取或分离的情况下鉴定所结合的配体,我们需要一个nMS平台;该平台要能够检测完整的蛋白质-配体组装体(可高达数百万Da),同时能够进行复杂的解离,然后进行配体的选择和裂解(<1500Da)。
三、实验设计:
技术路线设计
作者设计了多轮MS(MSn)来鉴定膜蛋白等蛋白质组装体上的配体;①对从生物体提纯的、用去污剂包裹的蛋白质组装体进行电离(MS1);②对膜组装体来说,首先需要一个关键的激活步骤来去除胶束(pMS2);③去除胶束后的组装体进一步分解得到蛋白质及配体(pMS3);④最后配体进一步碎裂(pMS4)。随后在计算机上解析谱图、鉴定配体。
天然组学平台开发定制
为了实现这种方法,作者开发了一种新的三合一Orbitrap质谱仪,这种仪器结合了为蛋白质复合物nMS所做的功能参数修改和执行MSn的能力。简而言之,增加了源/入口区域和离子路由多级杆(IRM)中的活化能,增加了IRM中的压力,并增强了离子光学器件的调谐。还对离子阱操作进行了更改,以完成离子在(m/z>4000)和低(m/z<1000)范围内的同时传输、激活和选择。最关键的是,通过这些修改,就可以对可溶性组装体或膜组装体进行nMS分析并保留非共价结合的配体。由此,作者将nMS与基于组学的方法相结合,构建起一个所谓“天然组学”(nativeomics)平台。
概念验证和应用扩展
为了突出这个“天然组学”平台的潜力,作者首先选择了大肠杆菌外膜孔蛋白F(OmpF,该蛋白复合物具有混杂性和在控制进入细菌细胞中起关键作用)来验证可行性。进而将平台和方法扩展应用到另两种蛋白质复合物上:水通道蛋白Z(AqpZ,其中的特定脂质参与了大肠杆菌细胞膜水通道的功能调节)和线粒体外膜转运蛋白(TSPO,这是一种在各种病理条件下都上调的关键药物靶标)。
四、研究成果:(重点图表展示)
大肠杆菌外膜孔蛋白F(OmpF)
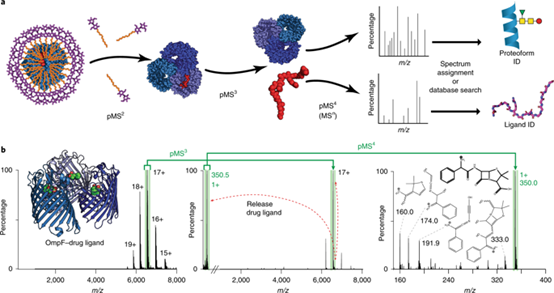
图1 利用多阶段质谱(MSn)逐步剖析,天然组学定义了跟三聚体膜孔蛋白OmpF结合的配体
三聚体OmpF可形成三种不同的复合物来分别控制细胞毒性大肠菌素的穿线、受脂质结合调节和介导抗生素的内化。复合物瓦解、释放出化学上多样的配体,进而用MSn来表征。该研究案例表明了,与化学上各种各样的配体(脂质、肽、药物)相结合的模孔蛋白是可以维持、分离、裂解和破碎的,从而产生指纹图谱、用以区分出数据库中潜在的配体结构。
大肠杆菌细胞膜水通道蛋白Z(AqpZ)
建立概念验证后,作者进一步研究了AqpZ。用内源性脂质纯化好的的四聚体AqpZ显示出多种加合物和潜在的蛋白质变体。选择并解离四聚体(pMS3)揭示了自上而下的碎片化(pMS4)的单体蛋白形式;碎片化产生的b和y离子证实了~30-40%的AqpZ带有N端甲酰化(以前报道过这种修饰)。
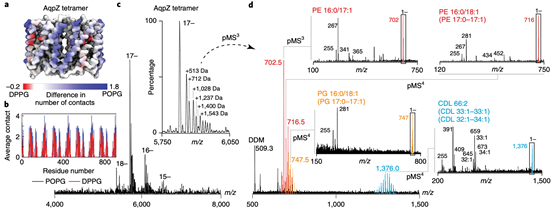
图2 天然组学和分子动力学模拟定义了直接结合在AqpZ上的内源脂质的结构。
针对AqpZ(17-)相关的加合物峰,作者选择了一个宽m/z窗口并释放了多个低m/z的物质。系统性选择和碎裂(至多pMS6)揭示出脂质家族: PE、PG、CDL以及PE-PG二聚体和洗涤剂加合物。最强负离子极性的PE和PG的碎片化揭示出它们的链长不对称和不饱和程度(这里确定的PG和PE脂质平均链长比之前报道的更短)。与先前研究结果的这种差别可能是合理的,因为天然组学是调查与蛋白质直接接触而非在扩展外壳中的脂质。
对于短链不饱和脂质的这种偏好,作者对PE/PG混合脂质双层中的AqpZ进行了分子动力学模拟,该双层包含了POPG或DPPG的模拟。在整个模拟过程(1000ns)中,水通道蛋白残基和POPG之间的平均接触数始终高于DPPG。由于唯一的区别在于尾部的不饱和度,这表明不饱和的POPG预先组织形成了比饱和PG更有利的与蛋白质表面互作。鉴于脂质可以控制水的运输,因而推测,具有较短链长和较低不饱和度的PG可能在调节膜内的通道渗透性中发挥作用。
线粒体外膜转运蛋白(TSPO)
作者还将其方法扩展到TSPO,该蛋白组装体的模糊电子密度已分配给配体。来自球形红球菌的TSPO具有与神经系统疾病相关的A147T突变,其二聚体晶体结构显示出一个卟啉衍生物结合位点和一些与单油精相关的表面。一个单体的螺旋1和另一单体的螺旋4之间的电子密度长度不完全满足,而是比结晶条件中存在的任何已知组分更长。这可能意味着一个连续的转运通路,它同时被多个配体或者尚未考虑过的一个新配体所占据;而这对于我们的组学平台而言,是理想的情况。
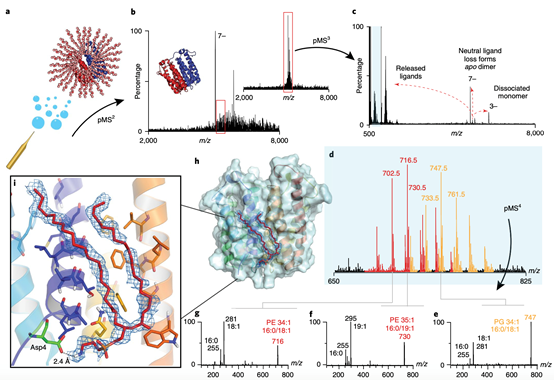
图3 鉴定结合在TSPO上的未知配体,随后拟合PE16:0/18:1到X-射线结构中
作者提取了大肠杆菌中表达的TSPO来进行天然组学研究。观察到,多种洗涤剂加合物与一种未知配体(+716 Da)一起粘附在TSPO二聚体上。分离并解离(pMS3)配体结合的蛋白质二聚体,揭示出洗涤剂簇和一系列以m/z 716为中心的同源脂质,主要是PE类物质(32:1到36:2)。负离子pMS4揭示了分量尾巴长度;其中PE 16:0/19:1由于其高度不对称的酰基链而受到关注。但是,与TSPO二聚体结合的主要PE是PE 34:1(16:0/18:1)。因此,作者将PE及其对照物PG(16:0/18:1)拟合到TSPO晶体结构中的电子密度中。PE模型的特征是,通过尾巴和脂类头基更深地穿透电子密度,它也可以与附近的氨基酸互作,而末端胺与Asp4互作。其他具有不同酰基尾的同源PE也可以容纳在电子密度内。这表明,通过定义头基、侧链不对称性以及链长分布可以改善磷脂建模。该研究结果提出了一个具体的脂质结合位点,并贡献了更多证据表明TSPO参与脂质运输。
五、文章亮点(结论讨论):
先前报道的方法提供了有关蛋白质-配体互作的宝贵信息。纯化后添加的脂质存在时,热变化分析和碰撞诱导的展开提供了对膜蛋白稳定性的测量。最近的一项里程碑式研究结合了生物信息学和遗传学筛选,并为三个独立的筛选平台合成了200多种肽,结果成功地使几种G蛋白偶联受体脱孤(即为受体找到了配体)。但是,天然药物组学与此处概述的其他方法之间的重要区别在于,它没有为了测试而对脂质或肽进行选择;相反,是捕获和调查在折叠的蛋白质装配体环境中的天然内源性配体。天然组学的潜在局限性包括无法捕获、离子化或片段化配体,或无法表征数据库中尚未描述的新配体。但是,可以在单个“发现模式”自上而下的实验中使用天然组学来表征蛋白形式以及相关的脂质、代谢物和蛋白质结合伴侣,从而始终保持配体和蛋白质之间的必要联系。
天然组学平台使许多应用成为可能,包括在高分辨率图谱中定义未知的电子密度和发现目前还没有分配功能的关键代谢物、内源性配体和庞大膜蛋白转运体和受体内的辅因子。
解读人:王崇志


 浙公网安备 33010602011771号
浙公网安备 33010602011771号