Mol Cell Proteomics. | Discovery of Species-unique Peptide Biomarkers of Bacterial Pathogens by Tandem Mass Spectrometry-based Proteotyping|基于串联质谱的蛋白质分型技术发现细菌病原体特有的多肽生物标志物|(解读人:黄旭蕾)
(基于串联质谱的蛋白质分型技术发现细菌病原体特有的多肽生物标志物)
期刊名:Molecular & Cellular Proteomics
发表时间:(2020年3月)
IF:4.828
单位:Department of Infectious Diseases, Institute of Biomedicine, Sahlgrenska Academy of the University of Gothenburg, SE-40234 Gothenburg, Sweden
研究对象:细菌病原体
技术:串联质谱,蛋白质组学
一、 概述:(用精炼的语言描述文章的整体思路及结果)
质谱(MS)和蛋白质组学为微生物提供了全面的表征和鉴定,并发现了可用于传染病诊断的蛋白质生物标记物。生物标记物在临床诊断中的应用越来越广泛,多肽生物标记物在临床实验室的应用也越来越受到重视。呼吸道感染是医学治疗的主要原因,临床评估和标准的临床实验室方案很费时,往往不足以作出可靠的诊断。需要新的方法,最好直接应用于临床样本,不包括培养步骤,以改进传染病的诊断,提供充分的治疗,减少抗生素的使用和相关的抗生素耐药性的发展。本研究应用纳米液相色谱(LC)与串联质谱(MS)联用,生物信息学流程和一个高质量参考基因组序列的内部数据库,以确定物种独特肽作为呼吸道感染常见四种细菌病原体的潜在生物标记物:金黄色葡萄球菌;卡他莫拉菌;流感嗜血杆菌和肺炎链球菌。在细菌参考菌株的纯培养物中最初鉴定出物种独特的肽,反映了四种物种的基因组变异,随后,未经事先培养的情况下在临床呼吸道样本中也鉴定出来,说明了在感染的临床条件下表达的蛋白质。对于这四种细菌病原体中的每一种,我们提出了最主要在临床样本中发现的肽生物标记物候选物。作为原理证明,最有前途的物种独特肽被应用于临床样品的靶向串联质谱分析中,并验证了它们与病原体鉴定(即蛋白质分型)的相关性,从而证明了它们作为用于传染病诊断的肽生物标记物的潜力。
二、研究背景:(简要介绍研究进展动态、研究目的和意义)
呼吸道感染是医学治疗的主要原因,主要使用抗生素治疗。在不知道病原体是细菌还是病毒的情况下,医生往往使用广谱抗生素治疗,增加了细菌耐药性的风险。为避免使用广谱抗生素,需要开发快速、精确和全面的诊断方法。基于DNA的诊断方法,如实时多聚酶链反应(RT-PCR)目前已在临床微生物实验室的常规方案中得到应用,全基因组测序技术也得到了越来越多的应用。然而,PCR是一种有针对性的方法,因此只能检测和识别已知的和选定的目标,这可能导致结果有偏差和物种分辨率和特征描述不足。基于MALDI-TOF质谱的微生物物种鉴定已成为传统表型或基因型方法的替代方法。MALDI-TOF质谱鉴定技术在大多数情况下具有可靠的物种级分辨率、易用性和样品处理速度以及每次分析的低成本等优点,目前已在全球范围内的临床中得到应用。然而,MALDI-TOF质谱分析的一个显著缺点是,在大多数情况下,需要耗时的培养和相关微生物的分离。进一步的缺点包括在区分密切相关的物种方面的局限性,包括链球菌属的Mitis群的一些物种。为了提高鉴别近缘物种的能力和分辨率,甚至对菌株级分型,在肽级的串联质谱法被采用。多肽生物标记物的发现是通过开发自底向上的“高分辨率精确质量(HRAM)”串联质谱蛋白质组学的质谱仪器来实现的,能够在一次分析中同时鉴定数千个多肽。在本研究中,该工作流程结合了HRAM串联质谱和TCUP(使用自下而上串联质谱蛋白质组学对细菌进行分型和鉴定)生物信息学流程,以寻找新物种独特的肽作为呼吸道病原体金黄色葡萄球菌、卡他莫拉菌、流感嗜血杆菌和肺炎链球菌的潜在生物标记物。与传统的基于培养的方法相比,蛋白质分型并不依赖于可培养细胞的恢复,而是可以直接应用于临床样品。本研究的目的是从目标细菌的参考菌株的细菌培养物中初步鉴定物种特异性肽作为潜在的肽生物标记物,然后在没有任何培养步骤的临床呼吸器样本中确认这些候选生物标记物。
三、实验设计:

四、研究成果:(重点图表展示)
1. 在发现阶段,对每个物种进行至少21 次质谱分析,以确定物种独特的肽(表V)。金黄色葡萄球菌和卡他性葡萄球菌中发现的物种特异性肽数量最多(分别为5847和5810),流感嗜血杆菌中含有2978种特异性肽,而肺炎链球菌中发现的物种特异性肽数量最少(782)。
2. 在定性阶段,评价了特异性多肽作为潜在多肽生物标记物的适用性。阴性的临床样本中加入不同浓度的细菌细胞,并使用包含在发现阶段确定的100种最高等级独特肽的包含列表进行质谱分析。
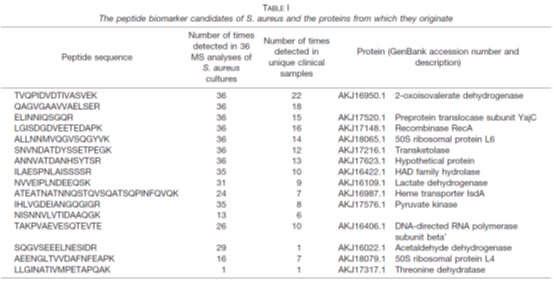
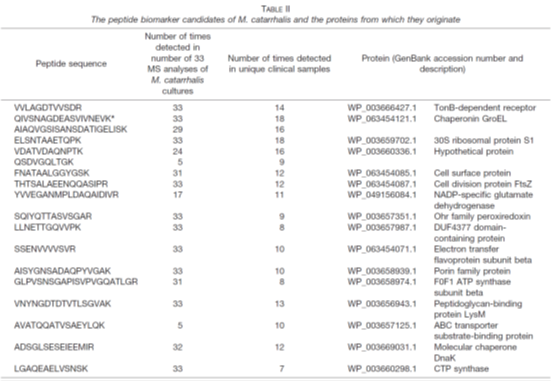
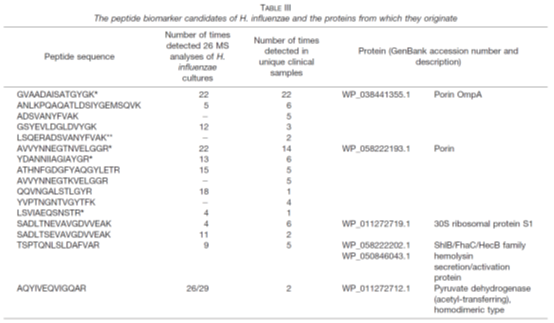
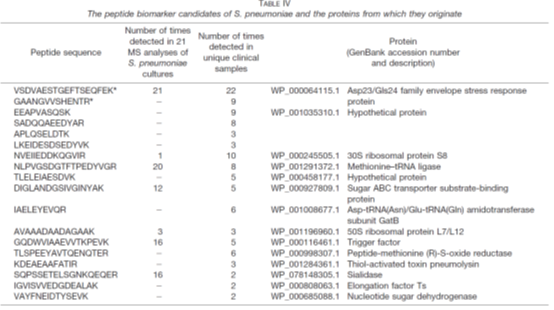
3. 在验证阶段,共收集218份临床呼吸道样本,这些样本报告了金黄色葡萄球菌、卡他葡萄球菌、流感嗜血杆菌和/或肺炎链球菌。因此,这些样品被用作质谱分析的“阳性对照”样品。临床微生物学实验室报告,临床样本至少包含一种研究中包含的病原体,但在许多情况下,样本显示与这四种病原体中的两种或两种以上共同感染。通过分析这些样本,检测并鉴定了肽生物标记候选物,证实了肽生物标记候选物来源的蛋白质存在于体内。表I-IV列出了临床样品中最明显检测到的肽及其相应的蛋白质,以及在细菌参考菌株培养物中检测到它们的次数。为了验证临床样品中肽的特性,所有的碎裂光谱都是手工检查的。在验证阶段的临床样本分析中,根据肽的排序,不断修改包含肽生物标记候选物的列表。最后的名单被减少到只有15-20个最有希望的肽生物标记物。
4. 最后,作为概念证明,开发了一种PRM方法(图1),通过针对在验证阶段确定的最合适的肽生物标记候选物,提供更高的灵敏度和高选择性。通过将保留时间与正确的离子转变和质量准确度结合起来验证肽的特性。
表I-IV:金黄色葡萄球菌、卡他莫拉菌、流感嗜血杆菌和肺炎链球菌的候选肽标志物及其来源蛋白
表V:分析的菌株数量、相应的质谱分析数量以及为每个物种发现的物种独特肽的数量

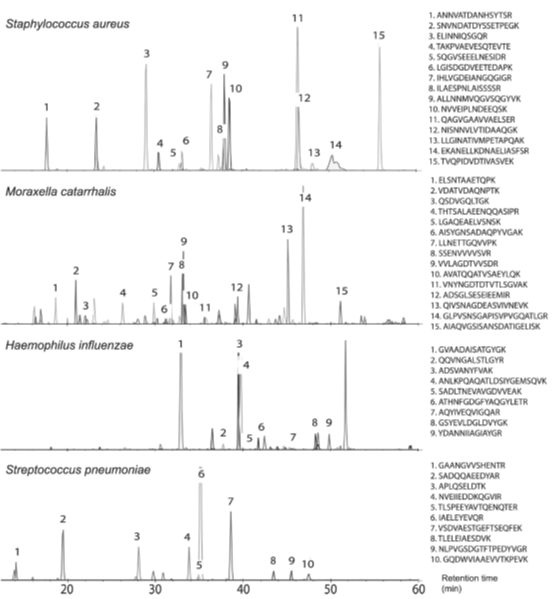
图1:使用PRM,针对如表I-IV所示最有前途的候选肽生物标记物直接分析临床呼吸道样本。
在对肺炎链球菌和流感嗜血杆菌的分析中,可以清楚地看到培养细菌和临床样本的蛋白质谱的差异(表III和表IV)。在这两种细菌中,4种最有前途的流感嗜血杆菌特有肽和13种肺炎链球菌特有肽在临床样品中均未在任何培养的参考菌株的分析中发现。对于卡他性支原体和金黄色葡萄球菌,许多肽生物标记物候选源于高度丰富的胞浆蛋白,包括核糖体蛋白。一般来说,由于胞质自保蛋白水平相对较高,无论生长条件如何,在分析临床样本时,最显著的肽生物标记候选物很可能来自自保蛋白。这些结果与传统的基于基因的方法和MALDI-TOF-MS一致,MALDI-TOF-TOF-MS都是常用的家养基因和蛋白质作为鉴定的靶点。相比之下,从肺炎链球菌和流感嗜血杆菌的候选肽生物标记物中鉴定出的许多蛋白质包括与细胞表面相关的蛋白质。这可能是因为不同物种的分类结构不同。
五、文章亮点(结论讨论):
本研究的目的是初步鉴定呼吸道感染细菌(金黄色葡萄球菌、卡他菌、流感嗜血杆菌和肺炎链球菌)参考菌株培养物中的独特肽,并确定临床样品中最有前途和最适用的肽生物标记物候选。以前的蛋白质组学研究,主要集中在发现用于传染病诊断的肽生物标记物,大多是使用体外模型系统样品进行的,主要是由于分析方面的挑战,如从人类临床样本中回收足够数量的细菌蛋白质,以及人类污染蛋白质的高背景阻碍了从细菌中检测肽生物标记物。在这项研究中,开发了一个简单的工作流程,包括从临床呼吸道样本中去除人体材料,同时仍然能够回收足够数量的细菌,用于检测肽生物标记物候选物。重要的是,数百个临床呼吸道样本在没有任何培养的情况下被直接分析,从而证实了临床样本中存在肽生物标记物候选,同时,它们与病原体鉴定和诊断生物标记物的相关性。
在进一步的研究中,肽生物标记物候选者将被用于靶向MS方法的开发,如图1所示。与发现阶段的研究相比,靶向方法如PRM和SRM/MRM(选择性反应监测/多反应监测)具有许多优点,如更高的敏感性和特异性、简化的MS分析和数据评估。在这项研究中,通过标准的临床微生物学方法,对经证实对呼吸道病原体呈阳性的临床样本进行质谱蛋白质组学分析,被用作从本研究所包括的相关病原体中鉴定肽的一种成本效益高的方法。值得注意的是,在通过标准方法确认正确的鉴定之前,样品被冷冻,冷冻步骤可能对某些对冷冻敏感的物种产生负面影响,从而在为质谱分析工作流程制备样品之前减少完整细胞的数量。为了比较肽生物标志物方法与传统的基于培养的临床微生物学诊断方法,实验设计将有所不同,即样品在处理前不会被冷冻,更多的样品体积将用于蛋白质分型。在敏感性、特异性、速度和成本方面,有必要将基于质谱的多肽生物标记物用于识别呼吸道病原体与传统方法(包括培养依赖性技术,如MALDI-TOF质谱)进行比较。然而,正如在这里用概念证明PRM分析所证明的那样,本文展示了一种有针对性的方法对于未来在复杂样本(如临床呼吸道样本)中高通量和特异性检测细菌的价值,即无需预先培养步骤。
阅读人:黄旭蕾
原文链接:https://www.mcponline.org/content/19/3/518


 浙公网安备 33010602011771号
浙公网安备 33010602011771号