Quantitative Proteomics of Enriched Esophageal and Gut Tissues from the Human Blood Fluke Schistosoma mansoni Pinpoints Secreted Proteins for Vaccine Development (解读人:张聪敏)
文献名:Quantitative Proteomics of Enriched Esophageal and Gut Tissues from the Human Blood Fluke Schistosoma mansoni Pinpoints Secreted Proteins for Vaccine Development(从人类血吸虫曼氏血吸虫中富集的食道和肠道组织的定量蛋白质组学确定了用于疫苗开发的分泌蛋白)
期刊名:Journal of Proteome Research
发表时间:(2019年11月)
IF:3.78
单位:
- 欧罗普雷托联邦大学
- 约克大学
- 利物浦大学
- 圣保罗大学
物种:曼氏血吸虫
技术:无标记定量蛋白质组学和QconCAT绝对定量蛋白质组学
一、 概述:(用精炼的语言描述文章的整体思路及结果)
本研究选取曼氏血吸虫的食道和肠道组织、采用LC-MS/MS平台进行无标记定量蛋白质组学研究和QconCAT绝对定量蛋白质组学研究。本研究中,我们开发了一种解剖技术,能够产生食管碎片,用于曼氏血吸虫食道的详细表征。研究结果还揭示了食管区域中复杂的蛋白质组成,并有MEG编码蛋白质抗原变异的证据,这可能对免疫逃逸产生严重影响。总之,此研究为更好地选择消化道候选疫苗进行开发提供了基础。
二、 研究背景:(简要介绍研究进展动态、研究目的和意义)
血吸虫是居住在血液中的蠕虫寄生虫,可导致血吸虫病,这是一种使人衰弱的疾病,导致发炎,在极端情况下,还会损害多种器官。控制传播的主要挑战仍然存在,保护性抗原的发现对于疫苗开发仍然至关重要。猕猴在血吸虫感染后可以自行治愈,产生的抗体会把来自外皮,肠和食道的蛋白质作为目标,但是目前对食道蛋白质的研究是最少的。
本研究开发了一种解剖技术,可以在雄性血吸虫食道和肠的比较蛋白质组学分析中提高敏感性。雄性血吸虫食管的蛋白质组分析确定了由微外显子基因(MEG)编码的13种蛋白质,其中11种独特地位于食道腺中。基于此信息和转录组信息,设计了QconCAT用于绝对定量选择目标。 MEG 12、4.2、4.1和VAL7最丰富,每个细胞跨越245-六百万个拷贝,而天冬氨酰蛋白酶,棕榈酰硫酯酶和半乳糖基转移酶的拷贝数小于100万个。本研究也证实了通过MEG蛋白的可变剪接产生的抗原变异以及食管中蛋白糖基化或分泌蛋白的专用机制。此外,一些胃真皮分泌物在肠道中高度富集,而另一些则更均匀地分布在整个寄生虫中,可能表明溶酶体活性。
总的来说,我们的研究结果在经过验证的保护性免疫模型的背景下,为血吸虫病疫苗候选者提供了更合理,方向更明确的选择。
三、实验设计:

四、研究成果:(重点图表展示)
1、ESO的质谱分析可检测预测的食道腺蛋白和序列变异
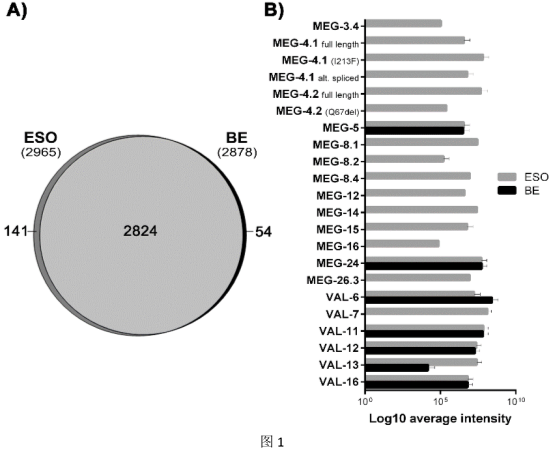
如图1所示,ESO和BE组织共有超过90%的蛋白质可以共同检测到,而141和54种蛋白质分别是ESO和BE样品所独有的。ESO和BE组织的比较蛋白质组分析确定了由微外显子基因(MEG)编码的13种蛋白质,11种独特地位于食道腺中。此外,我们研究的第二个蛋白家族是毒液变应原样(VAL)蛋白,因为VAL-7是发现的第二个腺体特异性成分。我们的数据证实,与BE相比,VAL 7和13在ESO组分中高度富集,而两种组织中VAL 11、12和16的强度相似,而BE中的VAL-6含量更高。
从蠕虫库中检测到的序列变异包括其他剪接序列,残基取代和缺失。如图2所示,与全长MEG-4.1相比,我们观察到两个氨基酸取代K57E和I213F,并且外显子10(红色区域)编码的氨基酸被删除,外显子8/11的直接连接发生(绿色区域)。第二个例子是关于MEG-4.2蛋白序列,MEG-4.2序列中谷氨酰胺残基(Q67)的缺失也导致了该食管蛋白的另一种可检测的蛋白型肽(以红色突出显示)。

2、QconCAT蛋白质组学可确定腺体分泌蛋白的丰度
我们采用基于QconCAT的定量方法来捕获ESO蛋白质组中九种特定腺体抗原的丰度。因为细胞蛋白质拷贝数(cpc)可以将蛋白质丰度归一化为产生细胞的数量,所以我们使用cpc来表示我们的绝对定量数据。MEG-12、4.2、4.1和VAL-7最丰富,每个细胞跨越245万到六百万个拷贝,而天冬氨酰蛋白酶,棕榈酰硫酯酶和半乳糖基转移酶的拷贝数小于100万个。此外,我们在QconCAT分析中考虑了有关MEG-4家族成员亚型的存在。 因为EsoCAT中包含的MEG-4.1的两种蛋白型肽允许定量特定亚型的子集。所以,在第213位上含有异亮氨酸而不是苯丙氨酸残基的MEG-4.1变体占使用已知替代序列保守的第二种肽QINDGTSDKPK检测到的所有拷贝的71%(图3; MEG-4.1实线和虚线)。
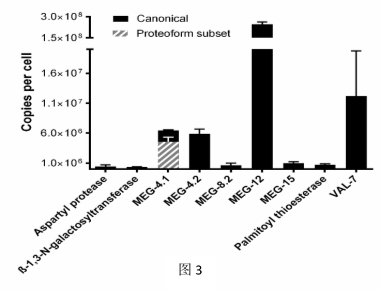
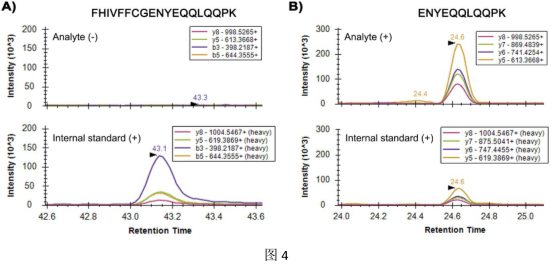
图4(A)监测到的FHIVFFCGENYEQQLQQPK肽的跃迁提取离子色谱图表明,MEG-12(Smp_152630.2)同工型低于检测限。 相反,在ENYEQQLQQPK内标浓度相同的情况下,检测到源自MEG-12(Smp_152630.1)亚型的内源性分析物。
3、GO分析表明蠕虫食道具有独特的分子功能
我们使用无标记的相对定量进行了ESO与BE的比较分析。Orbitrap
Fusion和Q
Exactive HF两组数据,分别表明了442和396种差异蛋白质(图5)。最终在这两个平台上总共发现了669个差异蛋白质。

差异蛋白的STRING功能分析表明,富含甘油磷脂和鞘脂代谢的食管蛋白簇以及差异丰富的蛋白中的溶酶体卵磷脂:胆固醇酰基转移酶富集(图6,右)。另一方面,半胱氨酸/木瓜蛋白酶样肽酶金属蛋白酶和C1A肽酶的过量表达表明BE中的蛋白酶显着富集(图6;左)。

接下来,通过GO分析直接比较了在雄虫ESO中富集的359种蛋白质与BE中富集的330种蛋白质。与BE相比,ESO中GO功能富集较多。在ESO和BE的差异丰富蛋白质的直接比较中,与食管中的生物能量学(氧化磷酸化),生物合成过程(蛋白质生物合成和糖基化)和囊泡介导的转运相关的功能过度表达(FDR≤0.05)(图7)。

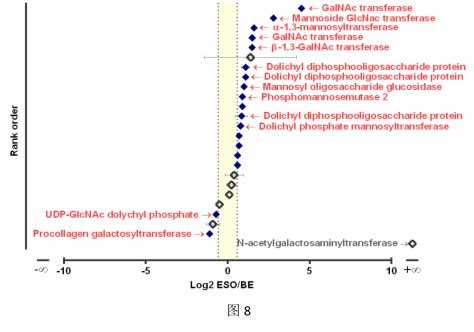
仔细研究25种定量的糖基转移酶的总数,发现食管区域的丰度更高,中位数为1.8倍。值得注意的是,ESO样品中富集了18种差异丰富的糖基转移酶中的16种(图8)。这些中的七个是多环醇脂质连接的内质网转移酶。总之,这些发现表明在食管腺体中产生特殊聚糖的独特机制。
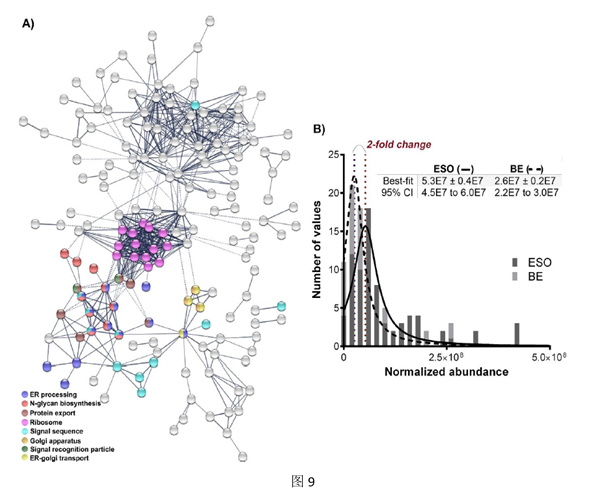
在ESO中差异丰富的蛋白质的STRING分析还揭示了一个连接蛋白质生物合成,糖基化和分泌途径的网络(图9(A))。该图突出显示了在ESO中差异丰富的蛋白质之间的蛋白质生物合成,糖基化和分泌途径(彩色圆圈)的聚类。空白圆圈主要与生物能学和小分子代谢有关。这些差异蛋白中,包含参与各种囊泡运输过程的蛋白质,同时,富集的信号识别颗粒和信号肽酶强调了经典的分泌途径在食道中起作用。另外,许多与SEC易位通道相关的差异丰富的蛋白质,COPII和COPI囊泡衣的Coatomer亚基,转运子相关蛋白和ARF GTPases为内质网/高尔基分泌小泡的形成提供证据。总的来说,所有这些蛋白质的丰度都向寄生虫食道倾斜了2倍(图9(B))。
4、通过比较分析确定胃表皮分泌物
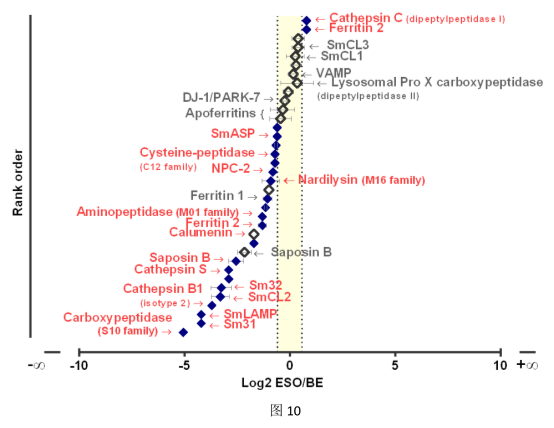
我们的ESO vs BE无标签定量结果提供了与食管和下胃真皮范围内的消化过程相关的蛋白质表达模式。图10展示了ESO和BE样品中推测的肠道分泌物的差异丰度。该图显示了胃表皮标记朝向血吸虫后端(左侧)的偏向表达。有趣的是,迄今为止归因于胃真皮的一组蛋白质在ESO和BE样品之间(阴影区域)显示出均匀的分布。
五、文章亮点(结论讨论):
1. 在这项研究中,我们开发了一种解剖技术,能够产生食管碎片,用于曼氏血吸虫食管的详细表征。我们的研究结果揭示了食管区域复杂的蛋白质组成,并有MEG编码蛋白质的抗原变异的证据,这可能对免疫逃逸产生严重影响。
2. 食管与后端的解剖关系提供了丰富的两个身体片段中不同的生物过程的概述,以及更新了血液消化和营养获取后期步骤中涉及的蛋白质组成。
阅读人:张聪敏



 浙公网安备 33010602011771号
浙公网安备 33010602011771号