Mass Spectrometry-Compatible Subcellular Fractionation for Proteomics 质谱兼容的蛋白质组学的亚细胞分离(解读人:王茹凯)
文献名:Mass Spectrometry-Compatible Subcellular Fractionation for Proteomics(质谱兼容的蛋白质组学的亚细胞分离)
期刊名:Jpornal of Proteome research
发表时间:(2020年1月)
IF:4.173
单位:
- 熊本大学
- 京都大学
- 庆应大学
物种:人的细胞
技术:磷酸化蛋白质组学和蛋白质组学
一、 概述:(用精炼的语言描述文章的整体思路及结果)
本研究选取细胞进行免疫印迹法和间接免疫荧光法、NanoLC−MS进行磷酸化蛋白质组学和蛋白质组学研究。我们使用含有乙二醇EG和相转移表面活性剂PTS的RIPA缓冲液开发了蛋白质组学的新型亚细胞分离分离方法,我们首次确定了蛋白质亚细胞定位的调控磷酸化位点的候选对象。
二、 研究背景:(简要介绍研究进展动态、研究目的和意义)
真核细胞包含多个细胞器。为了观察其中的蛋白质定位,已使用RIPA缓冲液连续离心或与密度梯度法结合的超速离心进行亚细胞分离分离。这些传统的亚细胞分离方案分离效率高,但回收率低。此外,由于蛋白质含量低,以及与MS不相容的表面活性剂(例如Triton X-100和十二烷基硫酸钠SDS),很难将这些分离的样品直接用于基于液相色谱-质谱的蛋白质组学。本研究拟研究一种新的RIPA缓冲液开发蛋白质组学的新型亚细胞分离方法可将分离的样品直接用于蛋白质组学的研究。
三、实验设计:
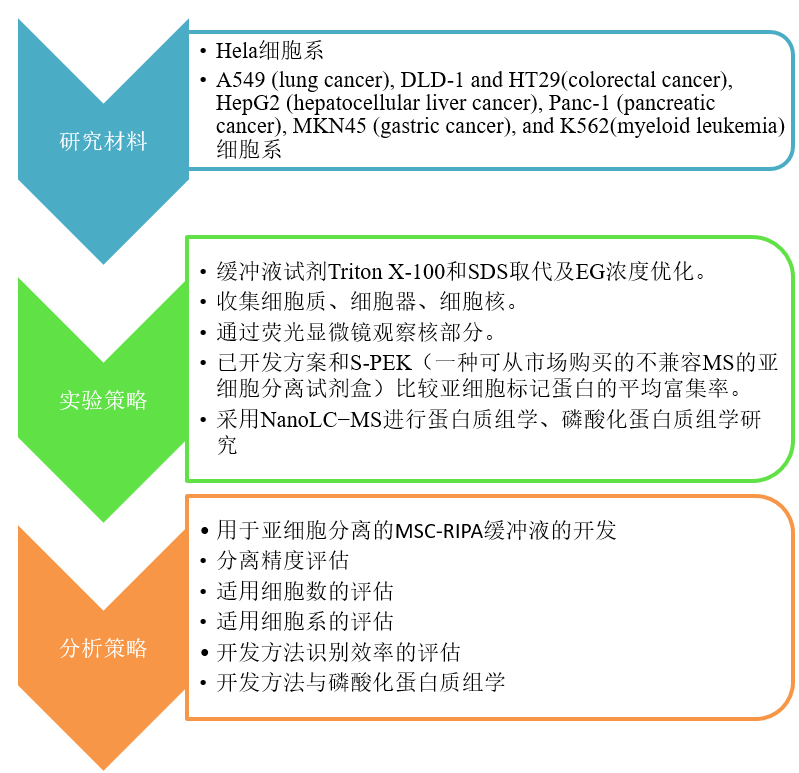
三、 研究成果:(重点图表展示)
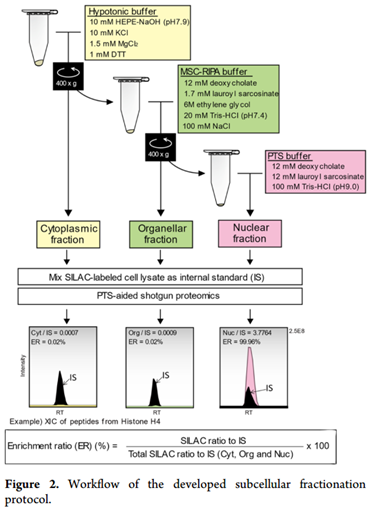
1、免疫印迹富集模式与通过蛋白质组学方法获得的富集模式高度一致(图3B)LDHA(细胞质标记),钙联蛋白calnexin(细胞器标记)和核纤层蛋白lamin A / C(核标记) 。免疫荧光观察到标记蛋白在HeLa细胞中预期的位置(图3C)。

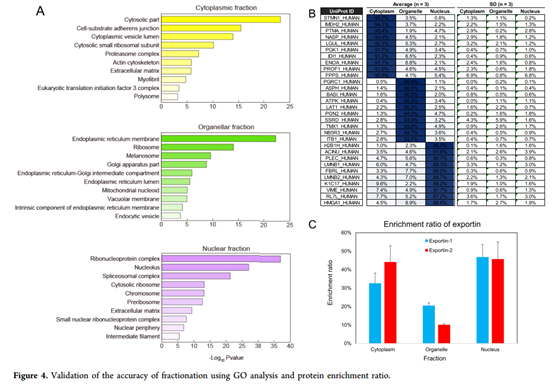
2、开发的方案还可以成功分离其他蛋白, GO富集分析(图4A)表示相应的GO术语在每个馏分中均高度富集。胞质部分(-log10 P值:23.18),内质网膜(-log10 P值:22.28)和核糖核蛋白复合物(-log10 P值:36.98)在细胞质,细胞器和核级分中分别含量最高。为了进一步验证,我们检查了每个馏分中10种最丰富的蛋白质的亚细胞定位(图4B)。exportin是一种众所周知的核质穿梭蛋白,可转运大分子,如RNA和蛋白质。如预期的那样,exportin-1和-2主要位于细胞质和核级分中(图4C)。这些数据表明,开发的协议适用于蛋白质亚细胞位置的大规模鉴定。
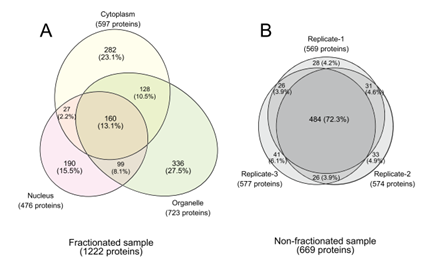
3、在未分离的样品中仅鉴定了基于5493个肽的669种蛋白质(FPR:1.15%),而分离的样品中总共鉴定出基于12 756个肽的1222个蛋白。在分离的样品中,只有13.1%的蛋白质在三个不同的部分中重叠,而通过对未分离的样品进行三次分析,鉴定出了72.3%的蛋白质(图5),表明在每次LC-MS / MS分析中鉴定出许多独特的蛋白质使用亚细胞分离分离。
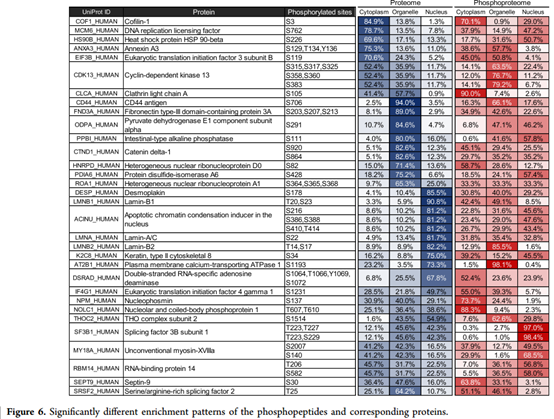
4、大多数磷酸肽显示与相应蛋白质相似的富集模式。但是,来自32种蛋白质的42个磷酸肽上的59个磷酸化位点显示出明显不同的富集模式(p <0.01,最大富集率差异> 25%)。 在目前的蛋白质组学数据中,94.0%的CD44富含细胞器部分。在细胞器中,来自CD44的磷酸肽(Ser-706)的富集率降至66.1%。相反,该核肽中的磷酸肽的富集率是总CD44的五倍。 这些数据表明,使用开发的方案结合蛋白质组学方法,可以观察到磷酸化的CD44进入核内的转运。
五、文章亮点(结论讨论):
开发了一种蛋白质组学的新型亚细胞分离分离方法,该方法可将分离的样品直接用于蛋白质组学的研究。
阅读人:王茹凯


 浙公网安备 33010602011771号
浙公网安备 33010602011771号