Journal of Proteomics Research | Th-MYCN转基因小鼠的定量蛋白质学分析揭示了Aurora Kinase抑制剂改变代谢途径和增强ACADM以抑制神经母细胞瘤的进展
题目:Quantitative Proteomics of Th-MYCN Transgenic Mice Reveals Aurora Kinase Inhibitor Altered Metabolic Pathways and Enhanced ACADM To Suppress Neuroblastoma Progression
期刊:Journal of Proteome Research
发表时间:September 27, 2019
DOI:10.1021/acs.jproteome.9b00245
分享人:廖文丽
内容与观点:
一、概述
研究首先分析了神经母细胞瘤患者的转录组,发现Aurora kinase导致患者的存活率低,并且与MYCN和高危疾病呈正相关。pan-aurora kinase抑制剂(tozasertib)治疗不仅诱导细胞周期停滞并抑制MYCN扩增(MNA)神经母细胞瘤细胞系中的细胞增殖,迁移和侵袭能力,而且还抑制肿瘤细胞生长并延长Th-MYCN转基因小鼠的存活时间。此外,研究对Th-MYCN转基因小鼠进行了定量蛋白质组学研究,并鉴定了tozasertib治疗后150种差异表达的蛋白。蛋白功能和网络研究表明tozasertib改变了代谢过程,并提高ACADM表达。研究表明pan-aurora kinase抑制剂可能通过干扰碳水化合物和脂肪酸的代谢途径引起代谢失衡,而ACADM可能是MNA神经母细胞瘤的潜在靶标。
二、研究背景
神经母细胞瘤是神经嵴衍生的胚胎肿瘤,约占儿童所有癌症死亡的15%。MYCN扩增与高危神经母细胞瘤的侵袭性和晚期有关。国际神经母细胞瘤分期系统(INSS)将神经母细胞瘤患者按年龄、组织学类型和v-myc禽骨髓细胞增生症病毒致癌基因神经母细胞瘤同源物(v-myc avian myelocytomatosis viral oncogene neuroblastoma-derived homolog, MYCN)分为不同的分期。MYCN扩增(MNA)是侵袭性神经母细胞瘤最常见的特征之一,也是预后差的生物标志物。MNCY状态已被用于儿童的风险分层系统,肿瘤学将儿童分为三个风险组:低、中、高风险组。然而MNCY的预后意义和特点仍不清楚,即使采用强化的多种方式治疗,高危的MNA神经母细胞瘤仍难以治疗。
Aurora kinase A, B和C (AURKA, AURKB, AURKC)是高度保守的丝氨酸/苏氨酸激酶,调节有丝分裂,并参与多种信号通路。作为致癌基因的AURKA和AURKB与结直肠癌、胃癌、肺癌和乳腺癌有关。且AURKA与MYCN蛋白有直接的物理相互作用,接到MYCN的稳定并促进神经母细胞瘤的发展。因此,一旦Aurora kinase活性被阻断,其对MYCN扩增的神经母细胞瘤的影响理论上可以被抑制,然而,关键的代谢途径仍有待阐明。
三、实验设计
1. 神经母细胞瘤患者的转录组学寻找药物靶标;
2. 体内和体外实验分析tozasertib对神经母细胞瘤的影响;
3. iTRAQ定量蛋白质组学分析Th-MYCN转基因小鼠的代谢途径。
四、 研究成果
1. 神经母细胞瘤患者的转录组分析显示AURKA和AURKB与神经母细胞瘤的低生存率、高风险疾病和MYCN高表达有关。同时,在MNA和神经母细胞瘤高风险的病人中AUKA、AUKB显著升高
2. tozasertib对SK-N-DZ和SK-N-BE(2)C两个神经母细胞瘤细胞系产生了剂量依赖和时间依赖的细胞毒性,而且聚落形成实验也证实tozasertib对神经母细胞瘤具有长期的抗增殖活性(图1)。且tozasertib显著诱导细胞凋亡和死亡,降低肿瘤细胞迁移和侵袭。
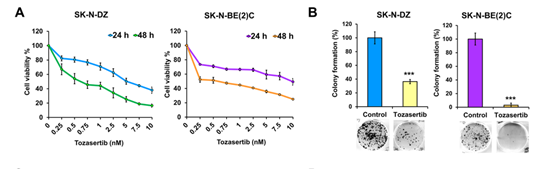
图1 Tozasertib在MYCN扩增(MNA)SK-N-DZ和SK-N-BE(2)C神经母细胞瘤细胞系中的作用。 (A)Tozasertib以剂量和时间依赖性方式降低MNA神经母细胞瘤细胞系的细胞生存力,IC50值对于SK-N-DZ,在24小时后为5.17μM,在48h后为0.62μM,对于SK-N-BE(2)C在24 h后为9.76μM ,在48 h后为0.59μM。 (B)Tozasertib治疗(0或48 h IC50)后MNA神经母细胞瘤细胞系集落形成的定量分析,菌落形成测定的代表性图像显示在底部。
2.Tozasertib处理Th-MYCN转基因小鼠结果显示肿瘤生长速度显著降低,且延长了Th-MYCN转基因小鼠的存活时间,肿瘤组织出现坏死的特征,基底膜和组织结构紊乱(图2)。
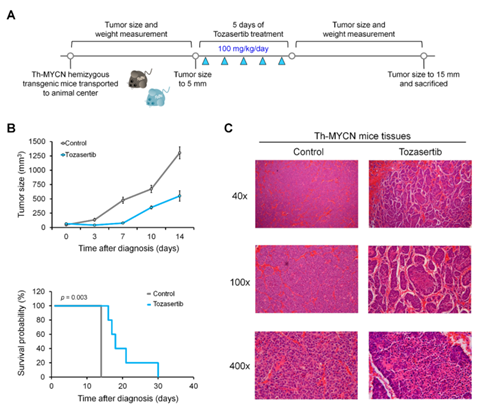
图2 Tozasertib在Th-MYCN转基因小鼠模型中抑制肿瘤生长。(A)在Th-MYCN转基因小鼠模型中用tozasertib治疗的工作流程的示意图。(B)从第3天到第14天(第3天,p <0.05;第7-14天,p <0.01),Tozasertib显着抑制了肿瘤的生长(上图)。 Tozasertib显着延长了Th-MYCN转基因小鼠的存活时间(下图)。(C)在经Tozasertib治疗的Th-MYCN转基因小鼠的肿瘤切片中观察到组织学损伤
3. Tozasertib处理的转基因小鼠的定量蛋白质组分析鉴定得到11076个肽段,2255个蛋白。功能富集网络显示,在Th-MYCN转基因小鼠中,tozasertib治疗与碳水化合物代谢过程,脂肪酸代谢过程,脂质生物合成过程,肌肉组织发育,伤口愈合,核糖体生物发生以及对缺氧的反应有关,其中24.7%参与代谢途径。根据KEEG途径分析,大部分蛋白与脂肪酸代谢和碳代谢有关。将这些蛋白根据细胞成分进行DAVID功能注释分析显示,最具代表性的上调蛋白分布在线粒体、细胞骨架和细胞器内腔中,最具代表性的下调蛋白分布在核糖体中(图3)。因此,Tozasertib可能通过改变脂肪酸和碳代谢的过程来印象肿瘤的进展,Tozasertib上调了脂肪酸氧化的过程,这可能会阻止癌细胞的生长并改善神经母细胞瘤的预后。

图3 Tozasertib处理Th-MYCN转基因小鼠中具有差异表达的蛋白质的功能蛋白富集。 (A)150种差异表达蛋白的基于网络的功能富集分析。 节点表示富集的GO项(p <0.05),边界表示节点之间的基因重叠分数大于0.5。 节点的大小表示富集蛋白质的数量。 具有类似功能的GO术语被手动分类到群集中,并用圆圈和标签突出显示。 (B)根据KEGG途径进行的DAVID功能注释分析的前10个术语。 KEGG途径的百分率是根据前10位KEGG途径而定。 (C)使用95种上调(上图)和55种下调(下图)蛋白根据细胞成分进行DAVID功能注释分析的前10个术语
4. 上面推测糖酵解和β-氧化与高风险MNA神经母细胞瘤的进展有关。 因此,评估了代谢酶PGAM2和ACADM的丰度与神经母细胞瘤生存和aurora kinase的相关性。 发现ACADM和PGAM2的高表达在神经母细胞瘤患者中具有更好的总体存活率,这与上述tozasertib治疗的神经母细胞瘤和小鼠的结果一致。重要的是,研究发现ACADM与AURKA和AURKB呈负相关,这表明Tozasertib可能抑制AURKA和AURKB,并提高ACADM表达以增强脂肪酸代谢过程。因此,通过靶向aurora kinase β-氧化过表达可能减少神经母细胞瘤细胞的增殖, ACADM可能是高风险MNA神经母细胞瘤的潜在靶标。

图4 (A)与ThzaMYCN转基因小鼠中的tozasertib治疗相关的途径。 列出了参与糖酵解和β-氧化的已鉴定蛋白质的比例,并且差异表达的蛋白质以红色标记。 (B)通过蛋白质印迹法验证了经tosasertib处理的Th-MYCN转基因小鼠的蛋白表达,在(A)图中以蓝色标记。 箱形图表示通过β-肌动蛋白归一化的PGAM2和ACADM的平均蛋白质表达量。 (C)高表达的ACADM在神经母细胞瘤患者中具有更好的总体生存率和无事件生存率。 高表达的PGAM2仅在神经母细胞瘤患者中具有更好的总体存活率。 (D)AURKA和AURKB与ACADM呈显着负相关,但与PGAM2不相关。
综上所述,研究试图评估tozasertib(一种aurora kinase的pan-aurora kinase抑制剂)对MNA神经母细胞瘤和Th-MYCN转基因小鼠的作用,结果表明tozasertib诱导细胞周期停滞并抑制细胞增殖,迁移和侵袭,在MNA神经母细胞瘤细胞系中具有抗肿瘤活性,并且还可以抑制肿瘤生长并延长Th-MYCN转基因小鼠的动物存活率。此外,这项研究是第一个分析响应tozasertib治疗的Th-MYCN转基因小鼠模型的差异表达蛋白和功能网络的研究。总的来说,我们预计pan-aurora kinase抑制剂对MNA神经母细胞瘤的作用将为代谢在肿瘤发生中的多方面作用以及替代的抗癌治疗策略提供证据。


 浙公网安备 33010602011771号
浙公网安备 33010602011771号