A Systems-Level Characterization of the Differentiation of Human Embryonic Stem Cells into Mesenchymal Stem Cells (解读人:王欣然)
文献名:A Systems-Level Characterization of the Differentiation of Human Embryonic Stem Cells into Mesenchymal Stem Cells(人类胚胎干细胞到间充质干细胞的分化的系统性表征)
期刊名:Molecular & Cellular Proteomics
发表时间:(2019年10月)
单位:
- Camargo Cancer Center
- University of Southern Denmark
- The Rockefeller University
- University of Sydney
- Department of Gynecology and Obstetrics, Hôpital Foch
- Max Planck Institute for Heart and Lung Research
物种:人胚胎干细胞、骨髓间充质干细胞
技术:下一代RNA测序,定量蛋白质组学
一、 概述:
本文结合多组学技术,包括转录组学、蛋白质组学和磷酸化蛋白质组学分析,阐明了人类胚胎干细胞到间充质干细胞的分化机制。通过RNA-蛋白关联分析,发现了与分化高度相关的多组基因;在众多分化早期磷酸化修饰蛋白中发现了可能与分化启动相关的蛋白AHNAK;HOX基因2种不同表达模式,以及基因沉默阶段AGO2到AGO3转变被发现;多种非编码RNA可能成为分化过程新的生物标志物;一些特异性的磷酸化位点及相关激酶PAK2和RAF1也参与到分化过程当中。多角度、系统性的分析对干细胞分化机制的解释对干细胞生物学有重要意义。
二、 研究背景:
间充质干细胞(mesenchymal stem/stromal cells, MSCs)是一种具备自我复制能力的多能细胞,拥有再生,分泌和免疫调节能力,因此在细胞治疗等方面有巨大潜力。其中,来源于能够高度增殖的人类胚胎干细胞(human embryonic stem cells,hESCs)的MSCs相比成体组织MSCs在可用性、生物安全和标准化治疗方面更具优势。这类MSCs可以通过多种方法从ESCs和诱导性多功能干细胞(iPSCs)中产生,本文提出了骨髓MSC(BM-MSCs)分化至ESC条件培养技术的改良方法,并运用多种大规模分析技术包括转录组、组蛋白、DNA甲基化和定量蛋白质组/磷酸化蛋白质组质谱分析,来研究ESC多能性和定向分化为MSC的分子机制,从而提供一个基于多组学对ESC分化到MSC机制更全面的解释。
三、实验设计:
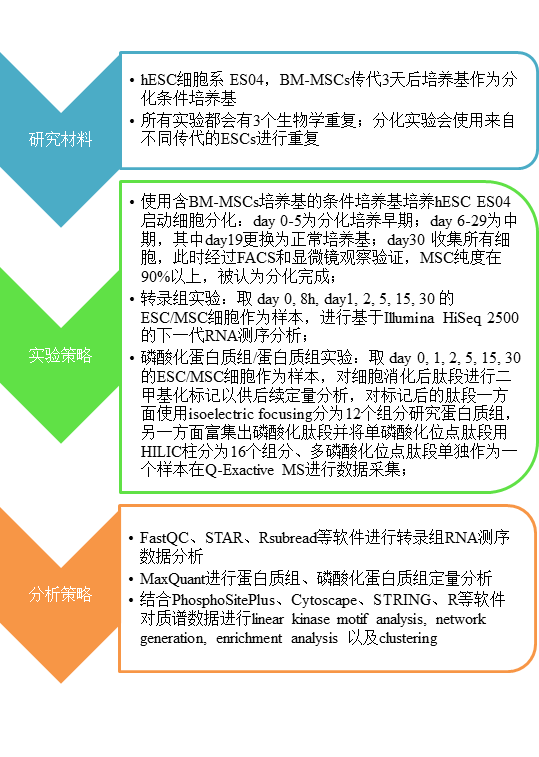
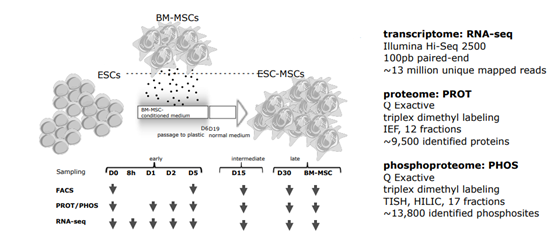
图1. 实验流程总览
四、研究成果:(重点图表展示)
1、对经典ESC和MSC特别是中胚层标志物,进行了随时间前进的表达变化的基于RNA-seq和蛋白质组方面的整体分析,这些标志物在功能上与细胞焦点粘连和分化密切相关。在这些组学分析中,RNA-seq分析平均涵盖了95038个转录子对应17665个基因,这其中10264个基因具备蛋白编码能力;蛋白质组分析涉及了9470种蛋白,其中4325种蛋白在能所有样本中可定量;另外识别了3621种磷酸化蛋白上的13826个磷酸化位点,下图2 A、B分别为部分标志物转录子表达随分化发生的变化,以及RNA、蛋白质组和磷酸化蛋白质组表达在分化各阶段的整体变化。
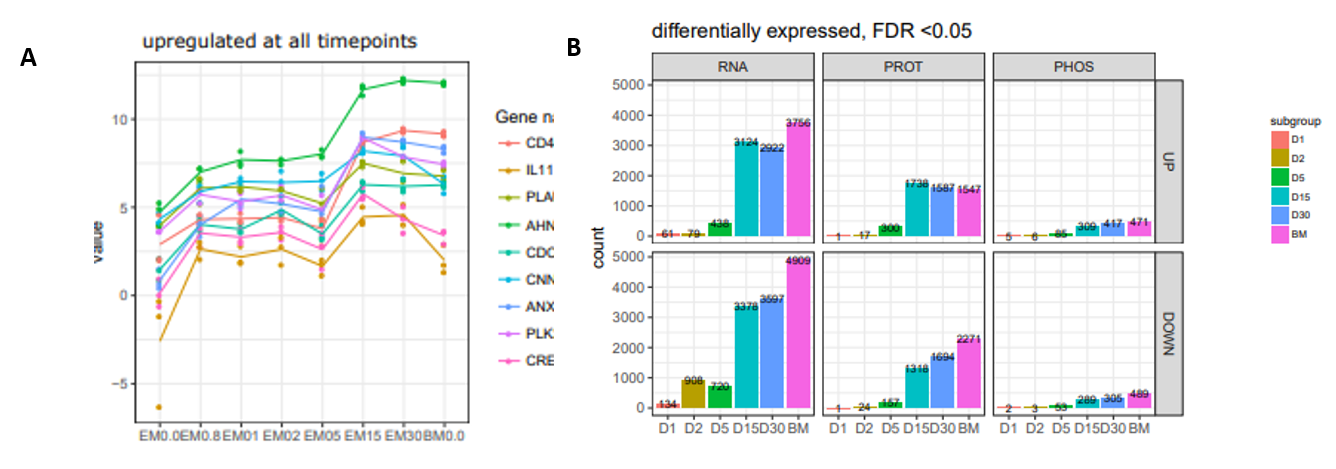
图2. A.分化开始后RNA水平上调;B. 不同组学的表达差异
2、研究者通过对表达差异进行富集分析(如图3所示),发现基因表达相关进程在分化时期普遍受到抑制。相反,结合蛋白互作网络分析和磷酸化蛋白质组分析,表明了RNA主导的基因沉默相关表达上调,如AGO3蛋白,诱导基因沉默复合物的核心组件种的一种,分化时期会在LIMD1蛋白消解后替代AGO2形成切换。富集分析同时指明了诸如囊泡运输、细胞骨架结构、分化等进程的表达上调。
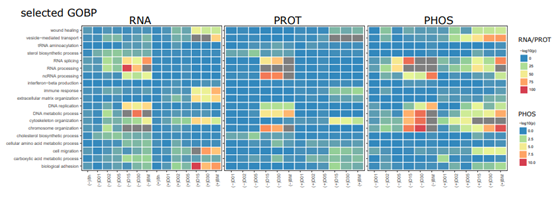
图3. RNA, 蛋白质组和磷酸化蛋白质组的富集分析
3、研究者又对long-noncoding RNAs等所有RNA的聚类分析和富集分析进行了解读,以发现那些决定性的转录因子,如homeobox基因家族,被认为在分化过程中可能是主要调控子。这又引发了对RNA与蛋白表达关联性的兴趣,有1896个具有表达差异的转录子与蛋白质组产生了良好的关联性,使得105个转录因子, 65种激酶和24种磷酸化酶与ESC分化高度相关。
4、对磷酸化蛋白质组进行了详细分析。其中,磷酸化位点数较多的蛋白,如AHNAK,在分化进程中通常有更激烈的表达变化,差异分析表明其在分化初期大量表达,可能与焦点粘连进程相关。磷酸化基序分析也表明了细胞分化前后富集的磷酸化氨基酸种类改变,反应了分化时期的细胞内部状态,同时也印证了RNA-seq结果中PLK2激酶表达上调的结果。
5、研究者使用KSEA对诱导磷酸化的上游激酶进行分析。预测激酶的层次聚类分析表明这些酶的表达并非与相关蛋白磷酸化差异直接相关;PAK2和RAF1是表达活性最高的2种激酶,参与TGFβ信号通路和SMAD 激活这些细胞增殖重要进程;同时也总结了ESC和MSC细胞特异性表达改变的激酶。
五、文章亮点(结论讨论):
本文整合多组学方法,详细呈现了hESCs到MSCs分化过程详细图景,涵盖了蛋白编码和非编码ORFs的表达差异和分化过程中的细胞信号转导。多组学数据表明例如细胞骨架、焦点粘连等是ESC分化早期出现的进程,而DNA复制剪切相关的活动整体下调;也指出如中胚层标志物和ANHAK等,以及大量转录因子如homeobox基因家族在分化进程中起到关键作用;这些数据从多个角度向我们展示了ESC定向分化至MSC过程的分子机制,为更深入的研究提供基础。
阅读人:王欣然


 浙公网安备 33010602011771号
浙公网安备 33010602011771号