Mol. Cell. Proteomics | 癌细胞衍生的小细胞外囊体通过促进HGF-Met途径促进受体细胞转移
题目:Cancer cell derived small extracellular vesicles contribute to recipient cell metastasis through promoting HGF/c-Met pathway
期刊:MOLECULAR & CELLULAR PROTEOMICS
发表时间:June 13, 2019
DOI:10.1074/mcp.RA119.001502
分享人:廖文丽
内容与观点:
一、概述
本研究旨在揭示小细胞外囊泡蛋白(sEVs)促进肿瘤受体细胞转移的机制。通过定量蛋白质组学分析比较高/低转移性肺癌细胞系95D / 95C,发现了促进受体细胞增殖和迁移的268种蛋白。其中62个蛋白参与了细胞迁移过程,且HGF蛋白的变化量最大,HGF是上皮-间质转化(epithelial-mesenchymal transition,EMT)的调节因子。通过体内和和体外实验证明了sEVs内的HGF激活了受体细胞中的c-Met,最终研究结果表明,肿瘤细胞来源的sEVs-HGF通过激活c-Met信号通路和促进EMT促进受体细胞的转移。
二、研究背景
肿瘤转移是一个复杂的过程,常与上皮-间质转化(EMT)相关。EM的特征包括上皮细胞失去细胞粘附和细胞极性,获得间充质表型,侵袭和转移能力增强。最近的研究表明,肿瘤衍生的外泌体可以作为EMT启动信号和传递EMT诱导物的桥梁。因此,受体细胞发生了与上调N-cadherin和Vimentin以及下调E-cadherin (EMT的标记)相关的生理变化(17)。然而,肿瘤外泌体蛋白通过EMT诱导肺癌转移的机制尚未完全阐明。
三、实验设计
1. 定量蛋白质组分析比较高/低转移性肺癌细胞95D/95C的sEVs蛋白质组表达量;
2. 选择与癌细胞转移相关的蛋白进行临床和体内实验;
3. 在体外进一步验证了这些蛋白的作用和机理。
四、 研究成果
1. sEVs的摄取是通过内吞作用、受体-配体相互作用或直接融合完成的,高转移性细胞分泌的sEVs可以促进受体细胞的增殖,特别是95D细胞分泌的95D-sEVs,可以通过促进EMT信号传导,增强细胞的侵袭和迁移(图1)。
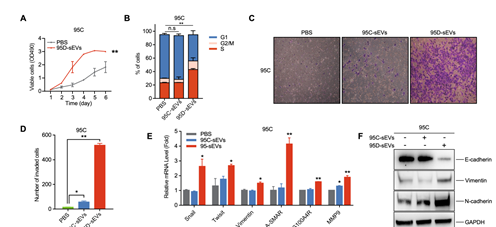
图1 95D细胞分泌的sEVs调节受体细胞的增殖和转移。(A)分别用10 g/mL 95D-sEVs和空白PBS处理95C细胞,MTS检测细胞存活率。(B)分别用10 g/mL 95C- sevs、10 g/mL 95D-sEVs和空白PBS处理95C细胞48 h,流式细胞术检测细胞周期。细胞在G1、S和G2/M中的比例用堆叠柱状图表示。(C, D)分别用10 g/mL 95C- sevs、10 g/mL 95D-sEVs或空白PBS处理95C细胞72 h后的迁移试验。迁移的细胞数量在直方图中显示。(E, F)分别用10 g/mL 95C- sevs、10 g/mL 95D-sEVs或空白PBS处理95C后,采用qRT-PCR和western blot检测关键EMT标志物基因表达情况
2. 采用定量蛋白质组学鉴定了95C-sEVs和95D-sEVs中共1411个蛋白,268个蛋白在两者中存在显著变化,其中259个蛋白在95D-sEVs中上调,9个蛋白在95D-sEVs中下调,且62个蛋白参与了细胞迁移,且HGF的变化量最大(图2)
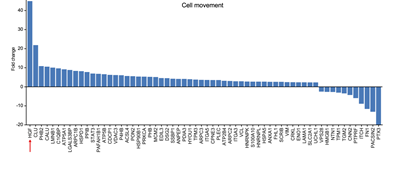
图2 IPA分析得到的62种与细胞迁移有关sEVs蛋白的变化倍数。红色箭头表示变化最多的蛋白HGF。
3. 在小鼠体内实验中,与注射95C细胞的小鼠相比,通过检测CD47,一种常在肿瘤细胞上表达的跨膜蛋白可知注射95D细胞的小鼠转移瘤数量显著增加,并向肺、肝部扩散,且在临床HGF在晚期癌症患者(阶段Ⅲ/Ⅳ) 血浆样本的sEVs中表达量明显较高。这说明,血浆中sEVs-HGF可以作为判断晚期癌症或预后不良的良好指标(图3)。
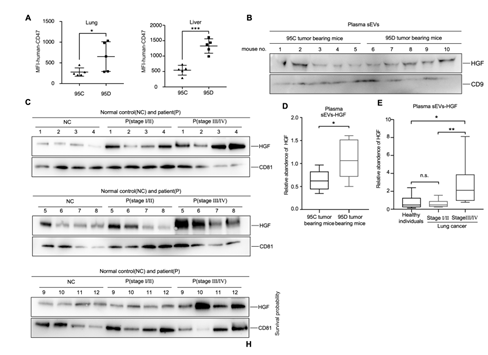
图3 临床sEVs样品中HGF的验证。(A) 95C肿瘤小鼠和95D肿瘤小鼠肺、肝组织中人cd47的MFI。(B) 95C肿瘤小鼠和95D肿瘤小鼠血浆sEVs中HGF的Western blot检测。采用CD9作为对照。定量数据见(D). (C)正常对照组和不同分期肺癌患者血浆sEVs中HGF的Western blot。采用CD81作为对照。相应的量化数据如(E)所示
4. 研究发现HGF/c-Met信号通路主要由肿瘤细胞分泌的sEVs-HGF激活。HGF是EMT的调节因子,调节c-Met的激活增加的磷酸化水平c-Met,随后活化Ras-Raf-MEK-ERK1/2激酶级联,导致Snail的表达,snail是一个参与EMT的转录抑制因子。Snail抑制E-cadherin的表达,增加N-cadherin的表达,随后细胞-细胞黏附丧失,上皮结构解离,细胞活力增加,肿瘤转移
综上所述,研究结果表明,肿瘤细胞来源的sEVs-HGF通过激活c-Met信号通路和促进EMT促进受体细胞的转移。更重要的是,血浆sEVs中HGF的高表达与肺癌患者的转移呈正相关。我们的研究结果揭示了癌细胞与邻近正常细胞相互作用的分子机制,这将有助于制定有效预防和治疗肺癌转移的治疗策略
作者:廖文丽
文章引用:
DOI: 10.1074 / mcp.ra119.001502
文章链接:https://www.mcponline.org/content/early/2019/06/13/mcp.RA119.001502



 浙公网安备 33010602011771号
浙公网安备 33010602011771号