解读人:林山云,Proteomic Identification of Protein Glutathionylation in Cardiomyocytes(心肌细胞蛋白质谷胱甘肽修饰的蛋白质组鉴定)
发表时间:(2019年4月)
IF:3.950
单位:韦恩州立大学化学系
物种:小鼠心肌细胞
技术:谷胱甘肽修饰蛋白组学
一、 概述:
本研究采用化学选择性蛋白组学方法,鉴定出过氧化物诱导HL-1小鼠心肌细胞后的含有半胱氨酸特异位点谷胱甘肽修饰多肽1763个,经过生信分析发现125个与心肌疾病相关的谷胱甘肽修饰蛋白,这些被修饰蛋白包括肌节结构和收缩蛋白、分子伴侣、信号及调节蛋白。并进一步通过对修饰位点的结构分析,预测蛋白质谷胱甘肽修饰对功能的作用。本研究建立了一个选择性直接鉴定谷胱甘肽修饰蛋白质的方法。
二、 研究背景:
活性氧自由基 (ROS)的过量产生于许多心血管疾病相关,如心肌病变。ROS会介导多种氧化修饰,谷胱甘肽化就是在氧化应激时一种重要的蛋白质氧化作用。但直接并且位点特异性的鉴定谷胱甘肽修饰心肌蛋白的蛋白质组学方法很有限。本研究建立“可键接谷胱甘肽(clickable glutathione )“法,能够直接鉴定谷胱甘肽修饰心肌细胞蛋白质。
三、实验设计:

四、研究成果:
1. 可键接谷胱甘肽法的建立。
(A)HL-1细胞转染突变型谷胱甘肽合酶GS M4后,催化叠氮丙氨酸合成N3-GSH,过氧化物刺激后,通过键接反应使谷胱甘肽修饰蛋白被生物素或荧光基团标记。
(B)标记生物素-DADPS的谷胱甘肽修饰多肽结合链亲和素-琼脂糖,经过胰酶消化。然后酸性反应下DADPS链接断开,谷胱甘肽修饰多肽被洗脱并LC-MS/MS分析。
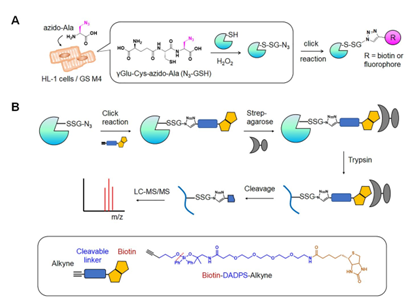
图1.键接谷胱甘肽法鉴定特异半胱氨酸残基谷胱甘肽修饰多肽图示
2. 使用该法在HL-1小鼠心肌细胞里鉴定出谷胱甘肽修饰多肽超过1700条、蛋白质1000多个(图2C),比无ROS诱导时,即未被谷胱甘肽修饰时鉴定到的数量大大增加(图2A/2C)。并比较了3种生物素衍生物的洗脱效率,发现DDE和DADPS(图2B)洗脱信号最强。生信分析(DAVID GO)表明谷胱甘肽修饰会影响多种生物进程,包括代谢、翻译和蛋白折叠(图3)。STRING和聚类分析发现其中125个蛋白的突变或功能改变与心肌病变有关(图3A);尤其是肌原纤维和电子传递链的蛋白质,表明谷胱甘肽修饰对蛋白质功能的潜在影响。
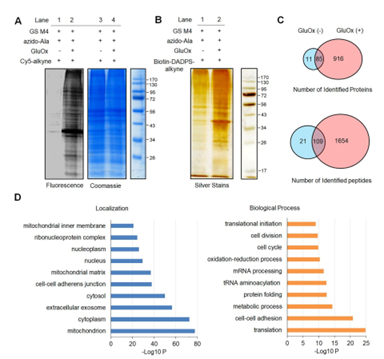
图2
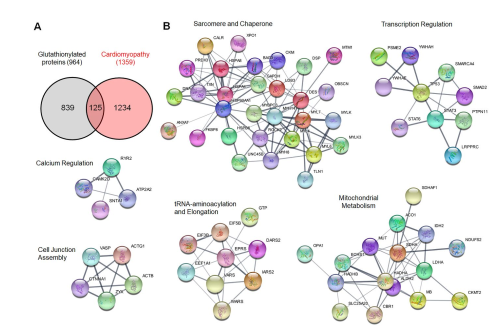
图3
3. 在结构数据中发掘谷胱甘肽修饰半胱氨酸位点,以期能够预测谷胱甘肽修饰对功能的潜在作用,本研究选取了CSRP3/MLP蛋白(图4)——研究表明该蛋白的多点突变会导致心肌病变,发现本研究中该蛋白C25残基被谷胱甘肽修饰,该残基与心肌肥大关联位点S54和E55十分接近(仅6-7 Å),推测谷胱甘肽修饰破坏了S54和E55残基附近的构型,进而导致蛋白功能的改变。
此外,本研究还分析了复合体Ⅰ(图5)、复合体Ⅱ和复合体Ⅲ中半胱氨酸残基谷胱甘肽修饰的情况.
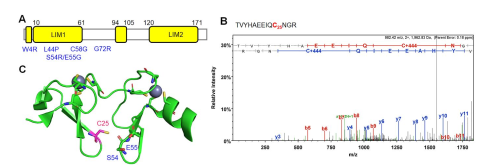
图4
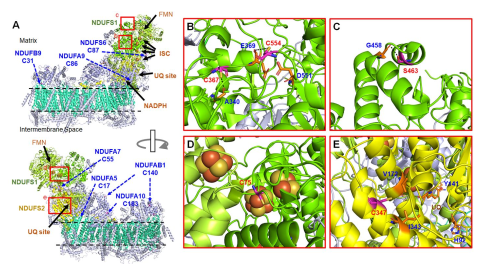
图5
文章亮点(与产品的结合点):
本研究通过键接反应使谷胱甘肽标记上亲和素或荧光基团,从而可以有选择性地富集谷胱甘肽修饰多肽,并直接通过质谱分析确定被修饰位点。建立了一种发掘和鉴定蛋白质谷胱甘肽修饰可行方法。


 浙公网安备 33010602011771号
浙公网安备 33010602011771号