Mol Cell Proteomics. |彭建祥| 人胃肠道间质瘤亚群蛋白质组图谱
大家好,本周分享的是发表在Molecular & Cellular Proteomics 上的一篇关于人胃肠道间质瘤亚群蛋白质组图谱的文章,题目是Proteomic maps of human gastrointestinal stromal tumor subgroups,通讯作者是四川大学生物治疗国家重点实验室的戴伦治。
胃肠道间质瘤(Gastrointestinal stromal tumor, GIST)是一种起源于胃肠道间叶组织的肿瘤,也是最为常见的胃肠道肉瘤(Gastrointestinal tract, GIT),年发病率为10-15/百万。研究发现大约50-60%的GIST发生在胃中,其次是小肠,结直肠,食道等组织,存在0.1-3%的胃肠道恶性肿瘤,且具有较高的复发率和转移率。肥大/干细胞生长因子受体Kit(Mast/stem cell growth factor receptor Kit, KIT/CD117)和血小板衍生生长因子受体A(platelet-derived growth factor receptor A , PDGFRA)的突变被认为是导致GIST的主要原因,主要发生在胃或小肠的肌肉层,因此GIST可能起源于卡氏间质细胞(interstitial cell of Cajal)或类似间质细胞。
国立卫生研究院(National Institute of Health, NIH)共识分类标准基于肿瘤大小和有丝分裂率将GIST患者分为极低风险、低风险、中风险和高风险四个亚群,证明了大的肿瘤和高有丝分裂率的GIST更易于复发和转移,研究还证实了不同风险阶段的患者具有不同的无病存活率。虽然目前在预测GIST的潜在恶性肿瘤方面取得了显著进步,但仍然缺少GIST的蛋白质组学特征,因此作者运用蛋白质组学技术,对人体胃肠道间质瘤亚群进行深入的蛋白质组覆盖和无偏见的蛋白质组学研究,这项工作是GIST蛋白质组的首次大规模定量表征。
作者选择了肿瘤(Tumor, T)和邻近非肿瘤(Normal, N)样本对GIST组织进行了深入的蛋白质组学分析,包括3对NIH-L(极低/低风险),5对NIH-I(中风险)和5对NIH-H(高风险)的GIST样本,使用串联质量标签(Tandem Mass Tag, TMT)10plex标记定量。所有样品设置两次技术重复,student-t检验重复性(p>0.1)。蛋白提取酶解、同位素标记、分离,Q Exactive Plus质谱仪分析后,使用MaxQuant(1.6)在Swiss-Prot数据库中选择人类蛋白质数据(2017/1/14)搜库,按蛋白1%FDR过滤。每个个体的肿瘤蛋白质强度标准化为其相应的非肿瘤样本的蛋白质强度,GIST亚群间差异蛋白也使用student-t检验(p <0.05)。作者自定义了差异蛋白筛选方法:选择样本中T/N比值同时大于或小于1.0的蛋白,将样本的平均T/N大于1.5的定义为上调蛋白质,平均T/N小于0.67定义为下调蛋白质。利用DAVID 6.8和GSEA进行富集分析,通过PLS-DA来评估GIST亚群的差异。此外,作者还选择了118例只有肿瘤组织的样本进行了肿瘤微阵列和免疫组织化学染色,使用Image-PRO Plus 6.0软件来评估蛋白质表达的强度。
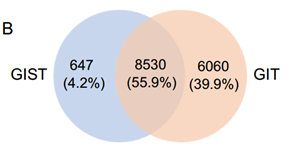
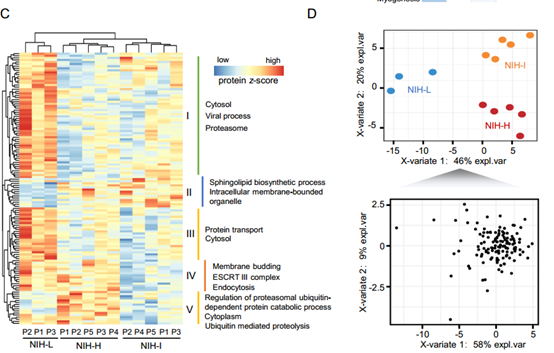
胃肠道间质瘤(GIST)的蛋白质组定量图谱:所有13例样本共定量到9177个蛋白质,占所有胃肠道肉瘤(GIT)编码基因约55.9%,三个亚群中有7230个重叠蛋白。作者从中挑选一些已知的过表达蛋白进行验证,发现这些蛋白的表达模式在三个亚群中和前人研究一致,证明了蛋白定量数据的可靠性。作者又对3个GIST亚群间的4930个蛋白质计算Pearson相关系数,数据表明NIH-I和NIH-H亚群之间具有更高的相似性,符合NIH-L无复发生存的临床表现。
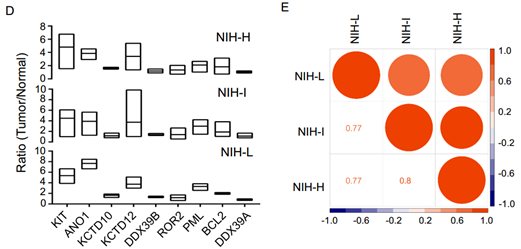
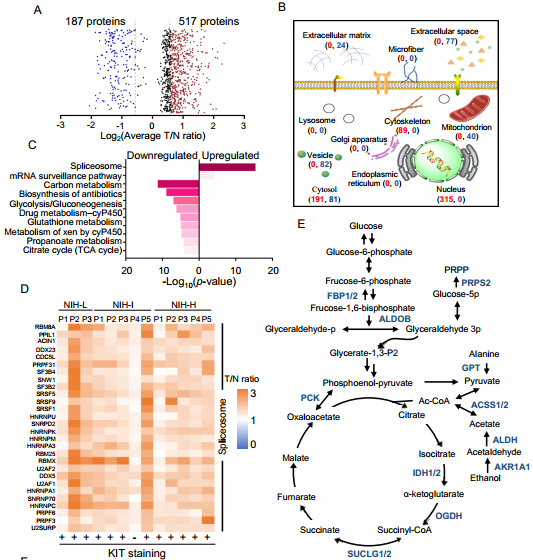
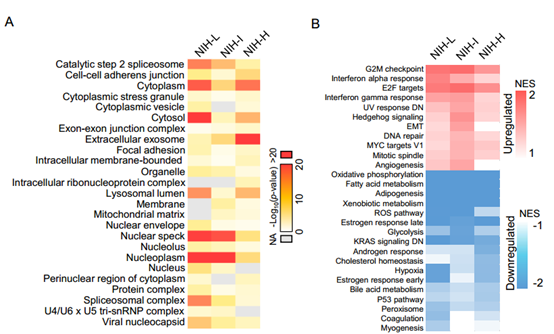
GIST亚群的一般蛋白质组学特征:13例样本中T/N比值同时大于或小于1.0的蛋白有1011个,进一步筛选差异蛋白得到GIST所有亚群中上调蛋白517个(平均T/N大于1.5),下调蛋白187个(平均T/N小于0.67)。对差异蛋白进行GO富集分析发现,上调蛋白显著富集在细胞核和细胞骨架,而下调蛋白主要富集在囊泡、线粒体和细胞外空间。KEGG通路分析显示,上调蛋白主要属于剪接体(如DDX5、SRSF1等),而下调的蛋白质则参与其中代谢途径(如IDH1 /2),包括碳代谢、糖酵解/糖异生、c-P450代谢、TCA循环、丙酸代谢和药物代谢,这与癌症中代谢和解毒的调节异常有关。
GIST亚群间的分子差异: NIH-L亚群分别得到了896个上调蛋白和93个下调蛋白,NIH-I亚群分别得到了549个上调蛋白和243个下调蛋白,NIH-H亚群中分别得到了809个上调和436个下调蛋白。对亚群差异显著蛋白进行分析,发现NIH-H亚群主要富集的是细胞外外泌体蛋白,而NIH-L和NIH-I亚群主要富集一些膜蛋白。GSEA分析表明很多信号通路在三个GIST亚群中显示出相似的调节模式,如与细胞周期密切相关的G2M检查点和E2F靶标被上调,而氧化磷酸化,异生素代谢,脂肪酸代谢和脂肪生成在所有亚群中下调。值得一提的是,胆固醇稳态通路在NIH-L亚群中几乎没有变化,在NIH-I亚群中略微下调,在NIH-H亚群中则显著下调。为了更好地了解蛋白质组差异,作者用两种过滤条件(GIST亚群间差异和亚群内差异)来同时筛选差异表达蛋白,得到131种差异表达蛋白质,使用GOBP,GOCC和KEGG(DAVID 6.8)进行无偏差聚类和聚类特异性富集分析,揭示了GIST独特的生物学过程:NIH-L富集包括内吞作用途径和蛋白质转运过程,NIH-H 在泛素介导的蛋白水解过程富集。通过PLS-DA分析证实了GIST亚群中131个差异表达蛋白的独特特征,13例GIST样本能够根据这些蛋白的表达分为3个亚群。总之,这些差异蛋白分析揭示了GIST亚群的独特蛋白质组学特征。
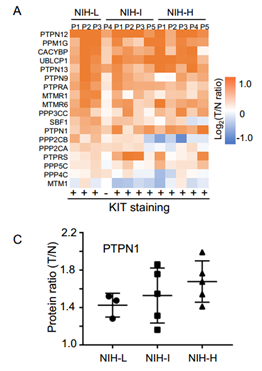
GIST的癌蛋白和肿瘤抑制因子:激活致癌基因和TS基因的失活是肿瘤进展的主要原因。作者接着评估了GIST亚群中癌蛋白(Oncoproteins)和肿瘤抑制因子(Tumor suppressors, TS)的稳态。他们选择了138个注释较好的癌症驱动基因并总结了它们在所有亚群中的倍数变化,在13例GIST中共发现了21种癌蛋白和31种TS。PI3K途径中的KIT(被认为是GIST的标志)以及一些其他癌蛋白(如JAK1、U2AF1、SF3B、PPP2R1A等),在所有GIST亚群中都显著上调。表皮生长因子受体(Epidermal growth factor receptor, EGFR)是肿瘤治疗的一个重要靶点,其过表达和活化与多种肿瘤的发展有关,EGFR在NIH-H亚群中高表达,但不在NIH-L亚群中高表达,表明EGFR途径可能涉及GIST晚期。此外,作者还发现一些TSs(如CDH1、FZR1、SMAD4等)在所有GIST亚群中下调。已有研究报道CDH1功能的丧失导致胃癌发病率显著增加,因此作者推测CDH1的下调很可能与GIST的进展相关。
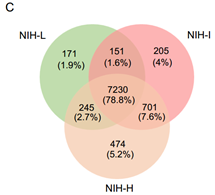
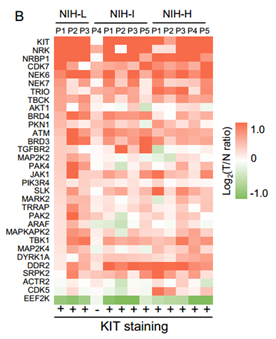
GIST的激酶和磷酸酶:激酶和磷酸酶是两类必需的细胞信号调节因子,被广泛用作新药开发的靶点。作者基于EKPD数据库(Eukaryotic Kinase and Phosphatase Database, 2019/1/1)在13例GIST中发现了18个磷酸酶和和32个激酶。大多数磷酸酶和激酶在GIST中上调,如KIT、NRK、CDK7、NEK6、ATM、BRD3等激酶在肿瘤中上调,EEF2K等激酶下调。与激酶相比,磷酸酶仍未得到充分研究。有趣的是,磷酸酶PPP2CB(Serine/threonine-protein phosphatase 2A catalytic subunit beta isoform)在GIST亚群中显示出独特的表达模式:在低风险亚群中上调,在高风险亚群中下调,并且亚群之间差异显著。作者进一步通过131例样本进行了免疫组织化学和组织微阵列等分析,实验表明高水平的PPP2CB很可能与GIST的低风险有关。而在所有上调的磷酸酶中,PTPN1(Tyrosine-protein phosphatase non-receptor type 1)可能是GIST转移的潜在抑制因子,其功能和机制进展还有待更深入的研究。
文章解读:
文献分享二组-彭建祥
文章引用:
doi: 10.1074/mcp.RA119.001361
文章链接:
https://www.mcponline.org/content/early/2019/02/24/mcp.RA119.001361



 浙公网安备 33010602011771号
浙公网安备 33010602011771号