MIT Molecular Biology 笔记6 转录的调控
视频 https://www.bilibili.com/video/av7973580?from=search&seid=16993146754254492690
教材 Molecular biology of the gene 7th edition J.D. Watson et. al
转录的调控
原核生物的转录调控
一、转录调控原理
1、基因表达由调控蛋白控制
- 激活因子 activator
- 抑制因子 repressor
它们通常都是DNA结合蛋白
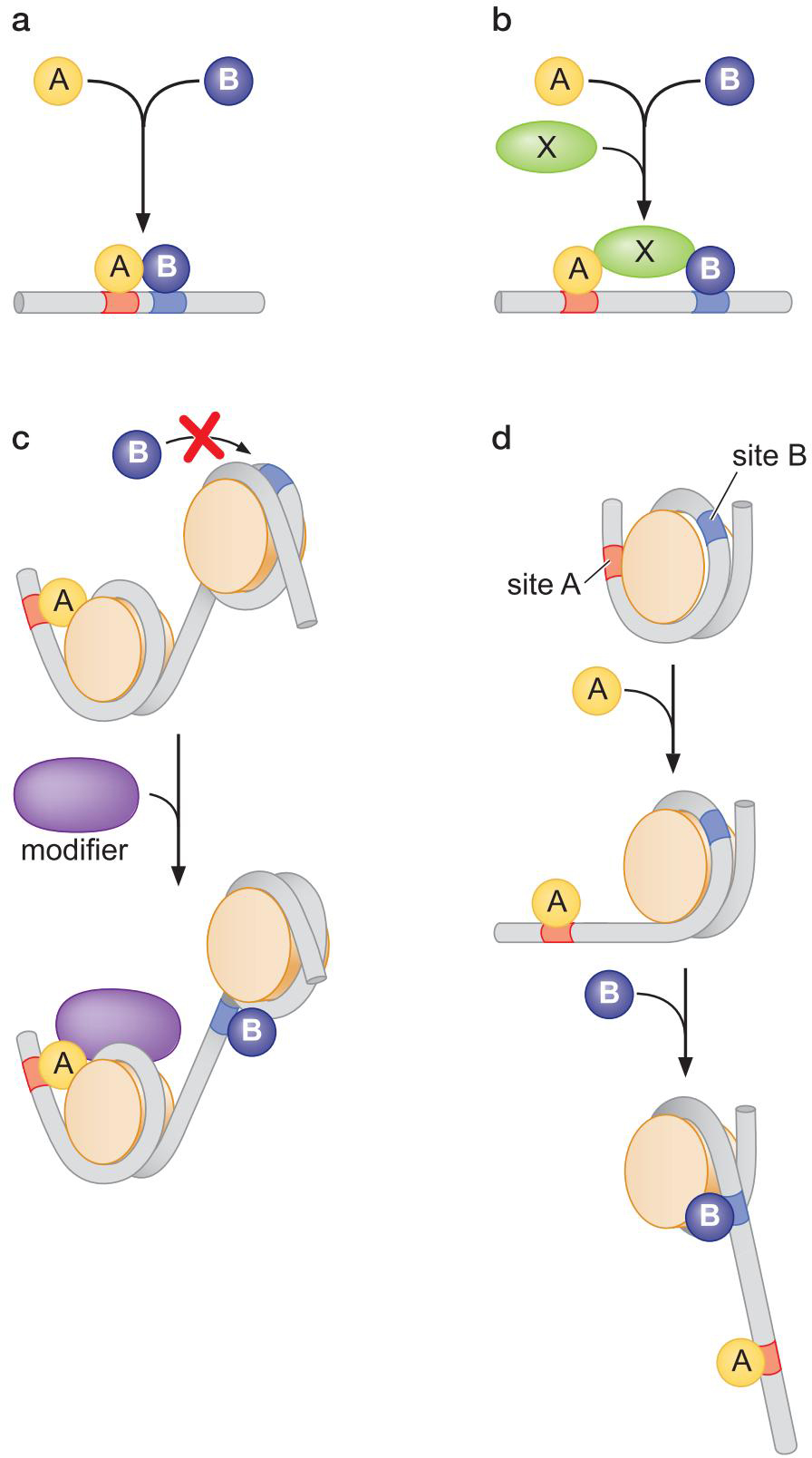
2、大多数的激活因子和抑制因子在转录起始水平发挥作用
①协同结合
- 本底水平basal level(组成型表达constitutive expression)
- 聚合酶在偶然状态下自发结合启动子引起的表达
- 激活因子就是促进聚合酶和启动子的结合
- 激活因子的一个表面结合启动子附近DNA位点,另一表面结合聚合酶,将聚合酶募集(recruitment)至启动子附近
- E'coli就是这种方式
- 抑制因子结合与聚合酶重合的地方抑制转录(操纵子operator)
②变构
- 激活因子 刺激聚合酶 形成开放复合体 (glnA启动子中 NtC)
- 激活因子 引起 启动子DNA构象改变 开放复合体 (merT启动子中 MerR)
- 抑制因子 抑制逃离 (malT基因表达)
③远程激活
- 通过弯曲环化较远距离激活,或者阻碍激活
蛋白与DNA的特异性结合依赖helix-turn-helix与大沟的作用
协同结合和变构在调控中起到多种作用
- 信号的整合
- 特异信号控制调控因子
** 抗终止作用及其延续:基因调控不仅局限于转录起始调控
二、原核生物转录起始的调控
1、
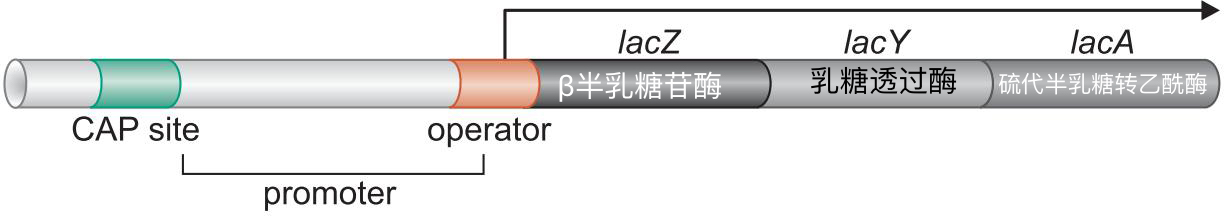
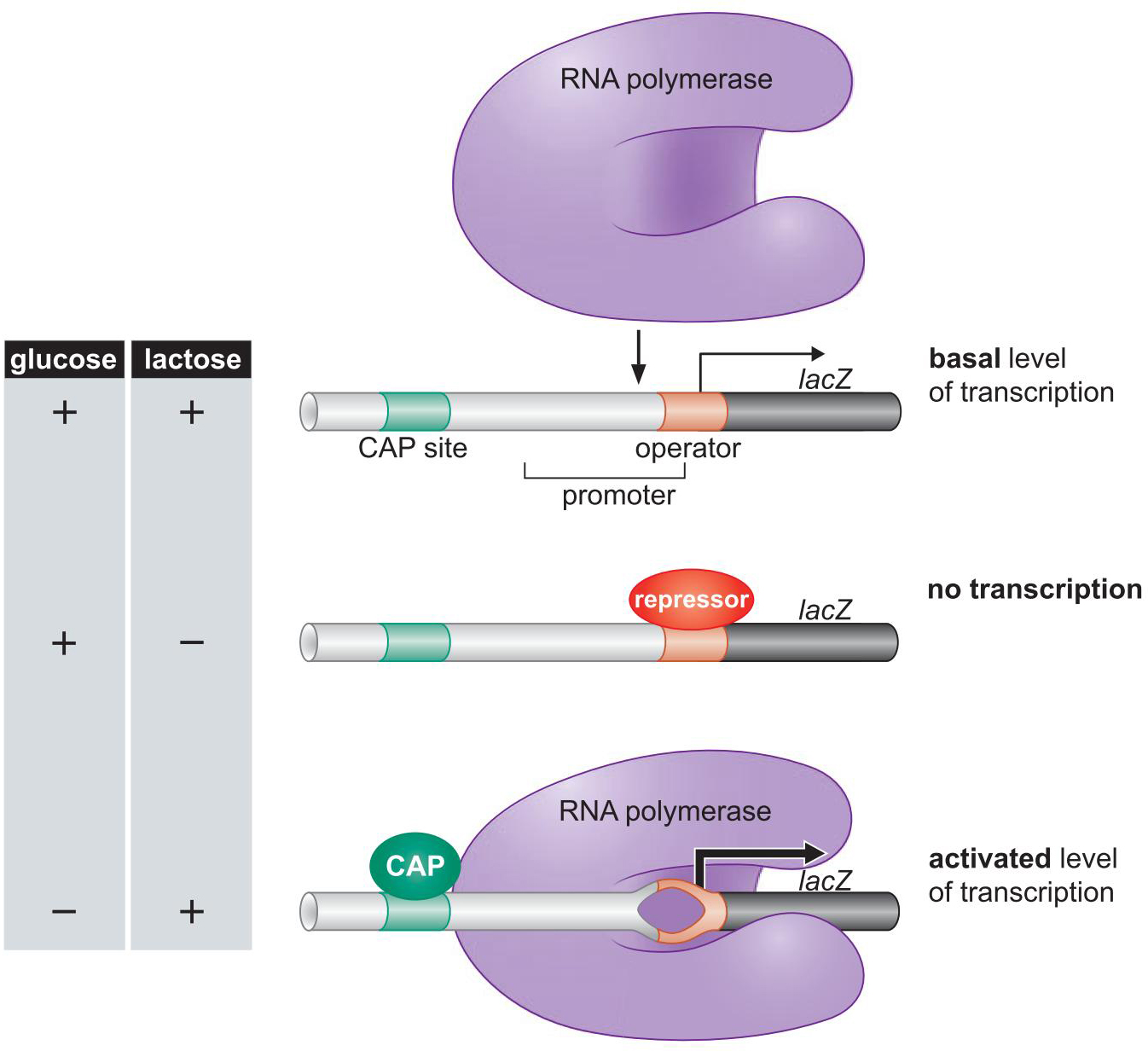
- 激活因子 Cap(catabolic activator protein)
![]()
- 是一种cAMP受体蛋白
- 抑制因子 Lac抑制因子
- 结构性表达
- 葡萄糖缺乏时,Cap相应,结合上游位点
- 乳糖充足时, lac抑制因子没有活性
2、大概的机理
- Cap促进RNA聚合酶结合lac启动子
- Cap招募聚合酶
- lac基因缺乏-35 区,拥有UP-element
- Cap二聚体的结合位点位于大约-60区(UP-element)
- Lac repress 抑制聚合酶结合
- Lac repress 占据了聚合酶的结合位点
lac启动子缺乏-35 区,拥有UP-element,这是激活因子控制的启动子的典型特征
3、Cap的结构:具有独立的激活表面和DNA结合表面
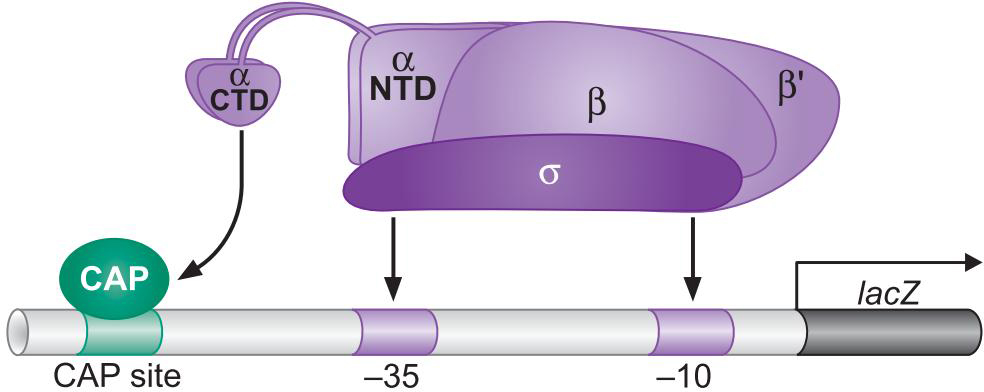
- CAP-αCTD-DNA形成三聚体才能激活转录
正控制 :Positive control,PC
研究此问题时,一个CAP与RNA聚合酶接触的激活区氨基酸发生替换的突变体叫做正控制突变体
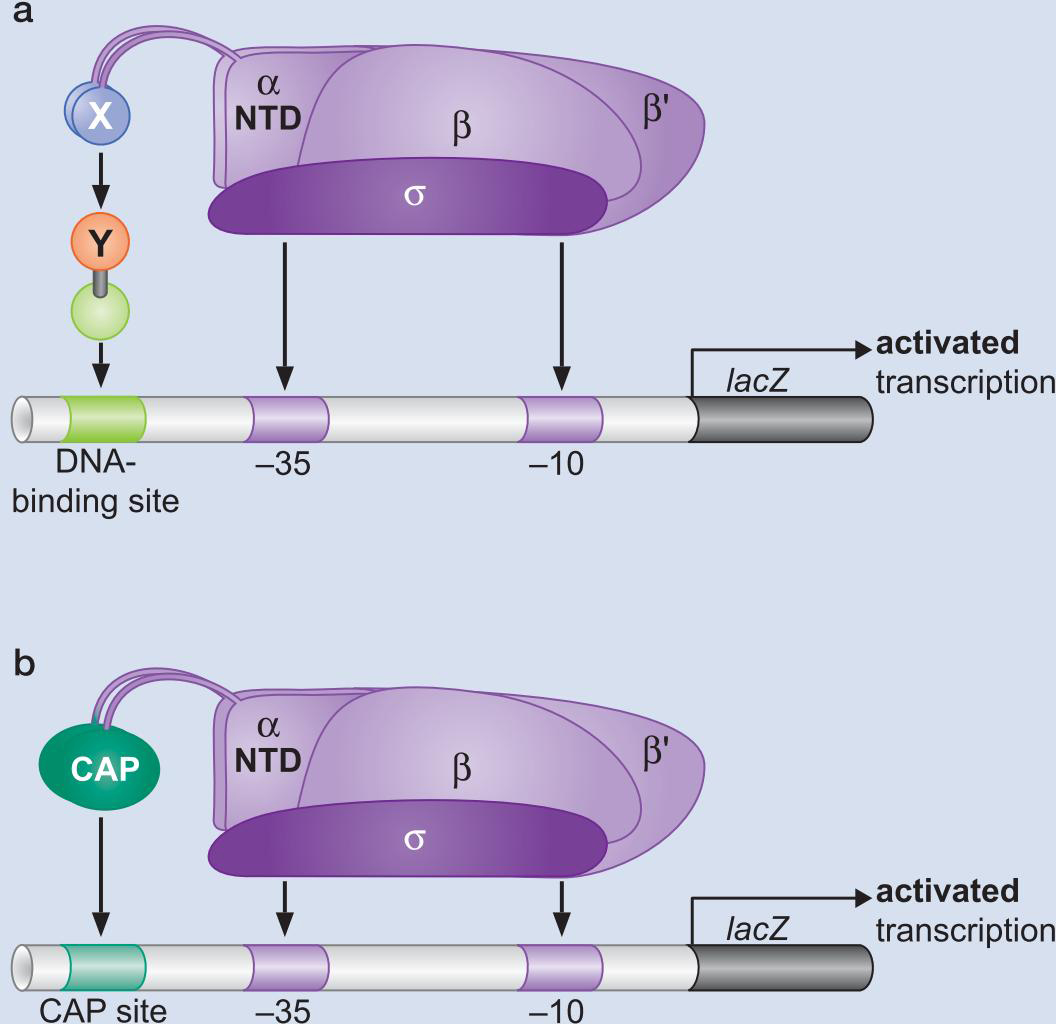
转录因子旁路实验证明了激活因子仅是协助聚合酶结合启动子
- CAP与αCTD 被换
- αCTD被换成DNA结合物(CAP)
- 增加聚合酶浓度
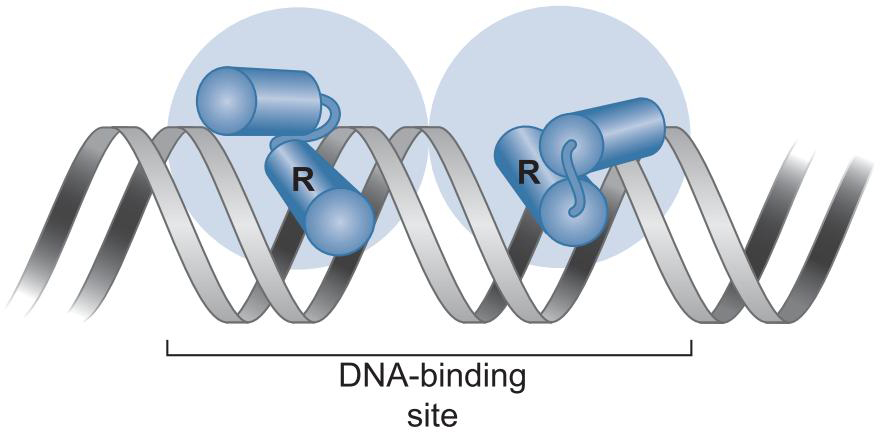
4、调控因子(包括CAP和Lac抑制因子) 以结构模体结合DNA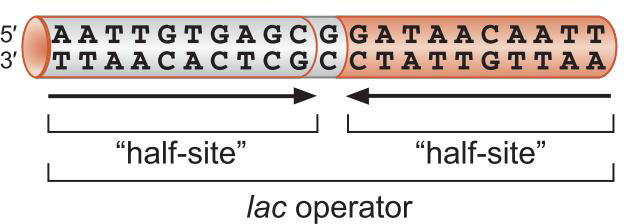
- 蛋白质以同源二聚体形式结合到反向重复序列位点上
- 每一个单体结合一个半位点
- 这一种结合依靠 helix-turn-helix识别特异DNA序列
- 一个α螺旋嵌入大沟
- 另一个α螺旋横跨大沟与主链相联系处
- 如此保证识别螺旋出现在正确位置,增加相互作用结合能
![]()
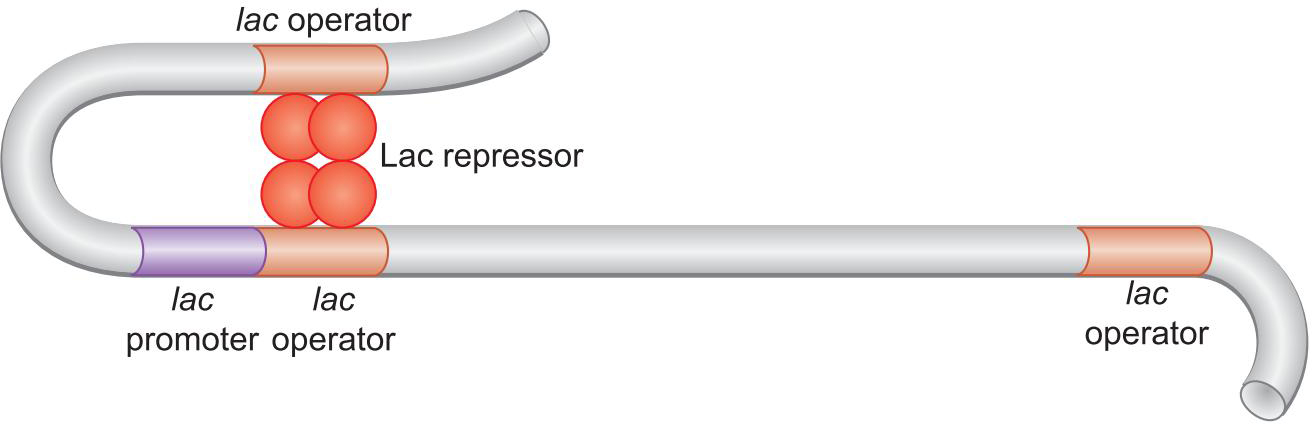
特殊地
- Lac 以四聚体的方式结合,出现环化
- helix-turn-helix 外区域也会与DNA互作
- 蛋白质可能导致DNA弯曲
![]()
5、Lac repress 与 CAP 的活性由信号触发的变构控制
- Lac repress
- 细胞本底表达lacZ编码的半乳糖苷酶
- 乳糖lactose进入细胞内 异构成别乳糖
- 别乳糖 使得 Lac repress 变构 失活
- CAP
- 葡萄糖glucose 减少, cAMP增多
- cAMP 与 CAP形成复合物, 变构,活化,结合DNA

6、组合控制: CAP也控制其他基因 ???????????????
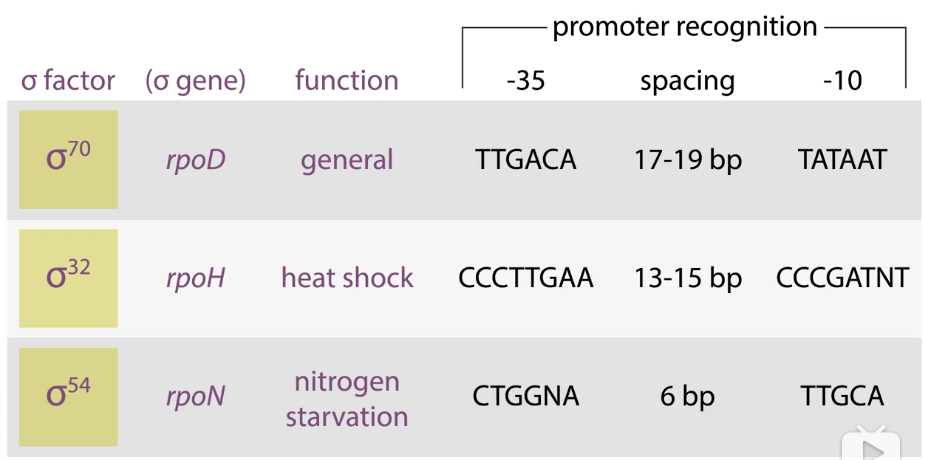
7、选择性的σ因子指导聚合酶选择性地结合启动子
- σ32:
- 热刺激
- σ32mRNA高效翻译
- 蛋白质瞬间稳定
- 启动相关保护基因的转录
- 噬菌体SPO1一系列选择性σ让基因有序表达
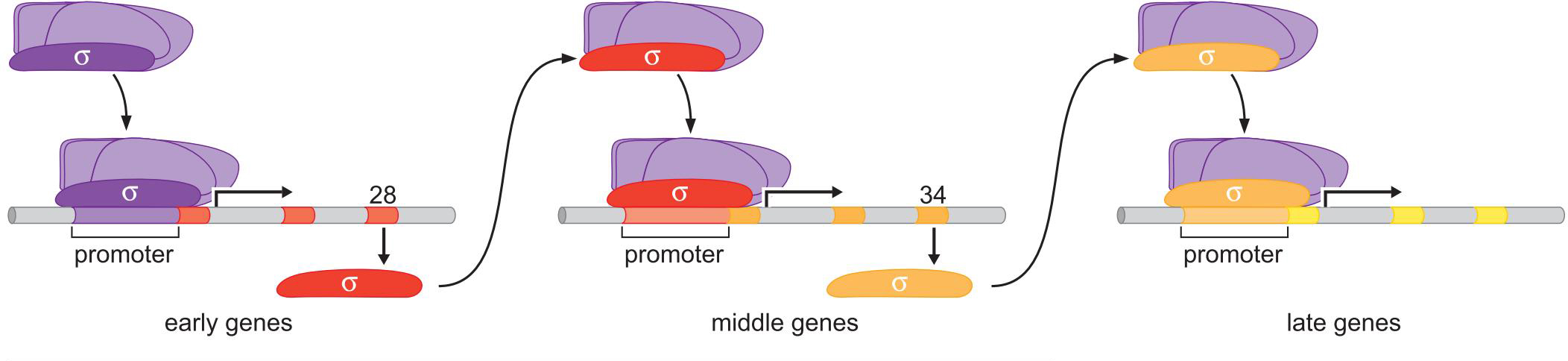
8、NtrC 直接刺激聚合酶 促使形成开放复合物
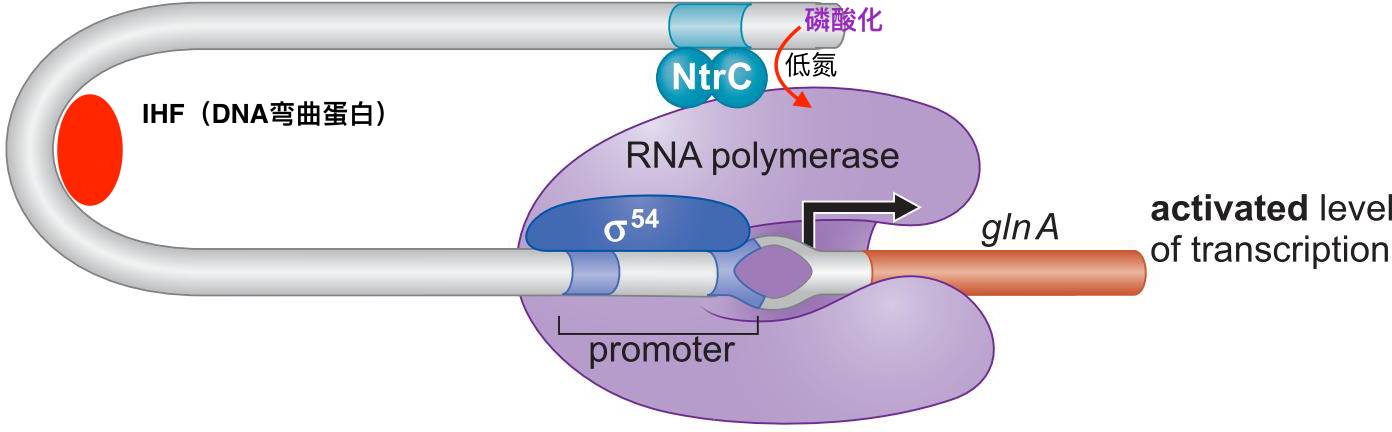
- 低氮 刺激 N突然C磷酸化
- NtrC暴露DNA结合域
- 结合到上游位点,并与σ54作用,启动转录
- NtrC有ATPase活性,为开放复合体形成提供能量
- 需要IHF让DNA弯曲,这是一种远程激活
9、MerR使DNA链扭转 促使形成开放复合物
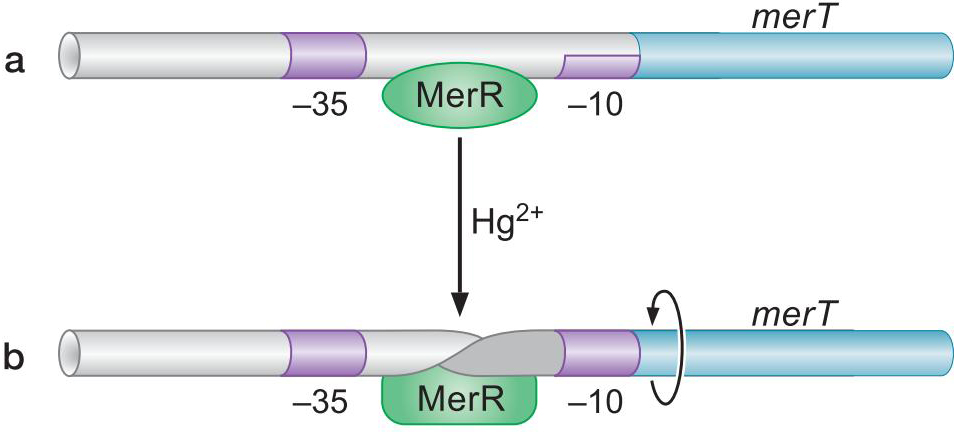
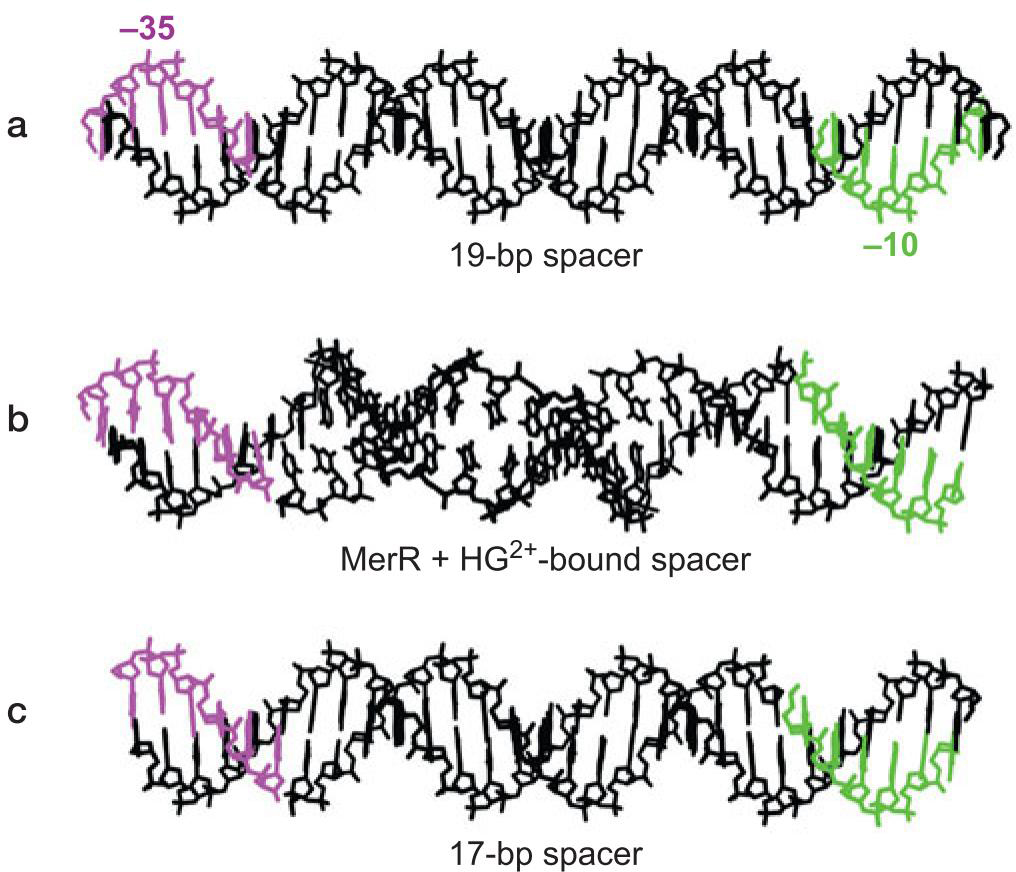
- 汞使MerR在DNA链背面结合
- 扭曲DNA
- 使得-10与-35区分布合理
- merT的-10与-35元件相隔19bp而不是15-17,σ因子难以很好促进转录起始
10、有些抑制因子通过滞留聚合酶来抑制
- E.Coli的 gal抑制因子在没有半乳糖(galactose)的时候,与聚合酶相互作用,抑制向开放复合物的转变
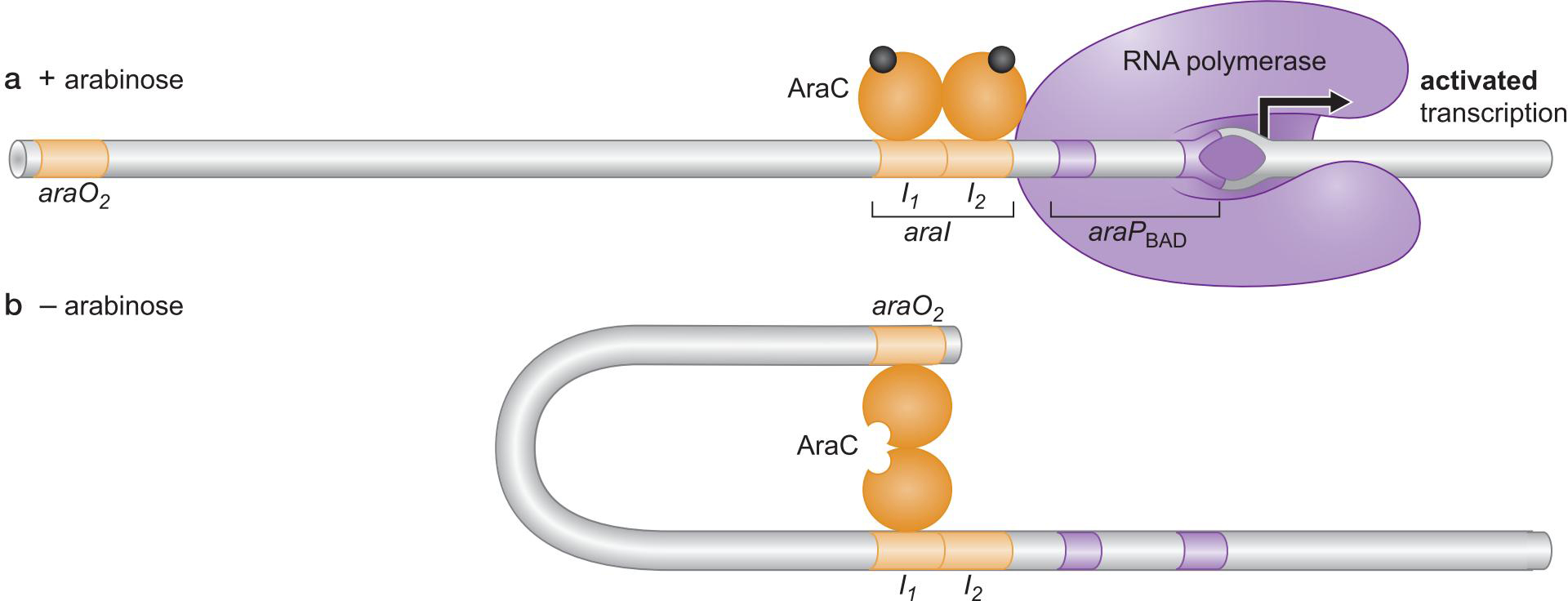
11、AraC 与 CAP一起对araBAD操纵子的控制(双控制)
- AraC 通过与调控区不同的结合方式开进行开启和抑制
- 没有阿拉伯糖时,I2位点没有结合,不能转录
- 此启动子也受CAP控制,最后,在拥有阿拉伯糖且缺乏葡萄糖时被启动
-
araBAD启动子常被用作表达载体 expression vector
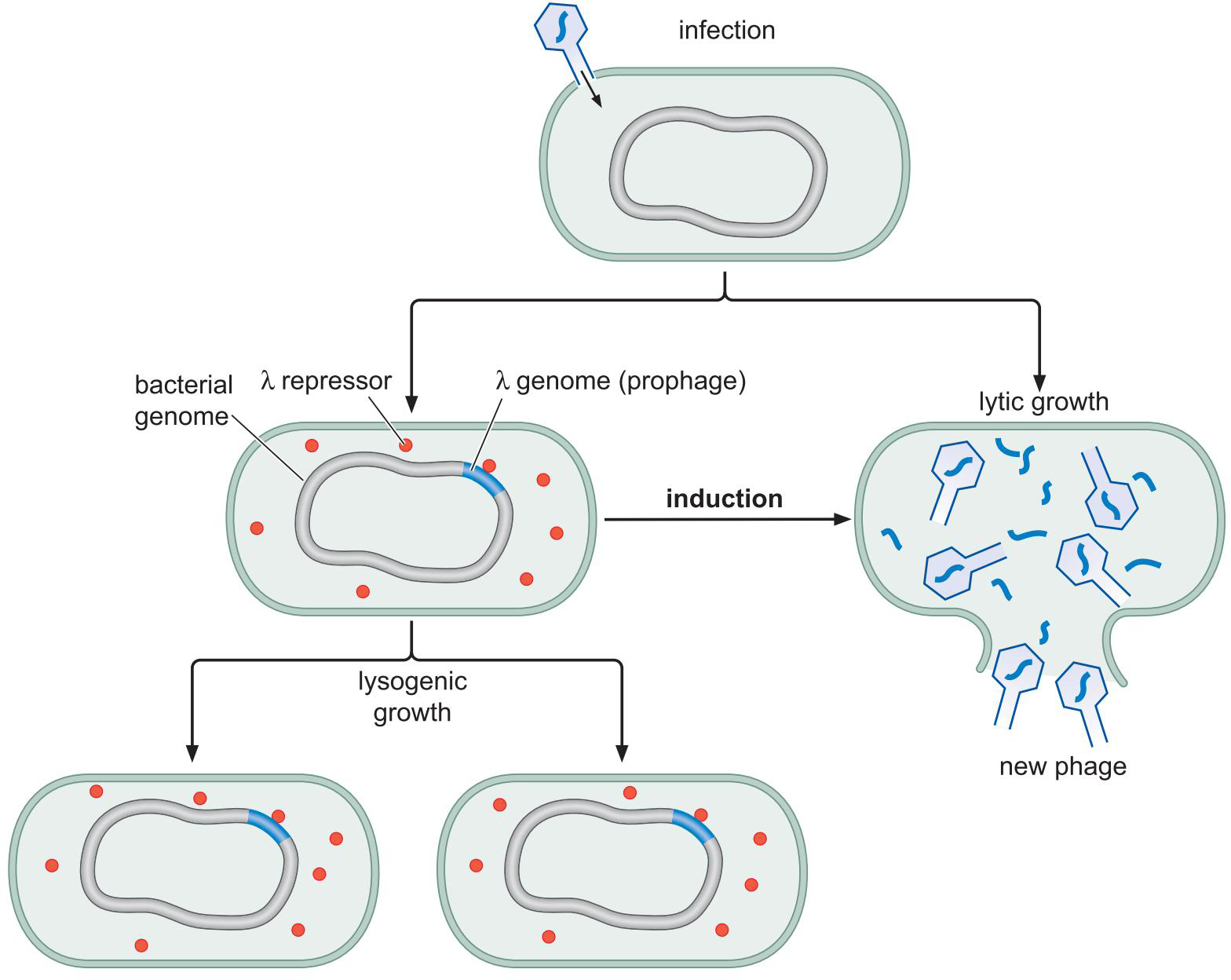
三、λ噬菌体的调控实例![]()
1、λ噬菌体的生长和诱导
- 裂解生长 lytically
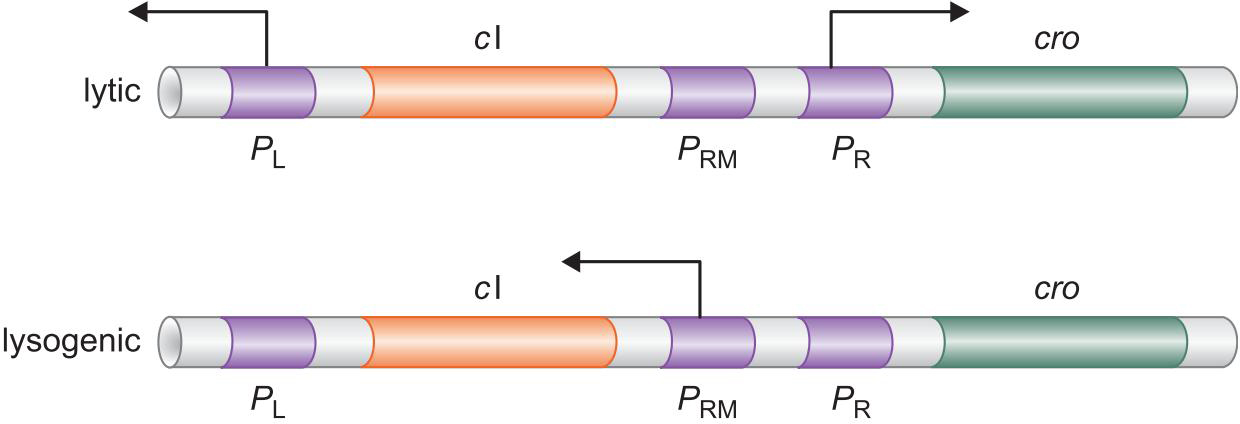
- PRM关闭;PR,PL开放
- 溶原生长 lysogenically
- PRM开放;PR,PL关闭
2、λ噬菌体的基因组
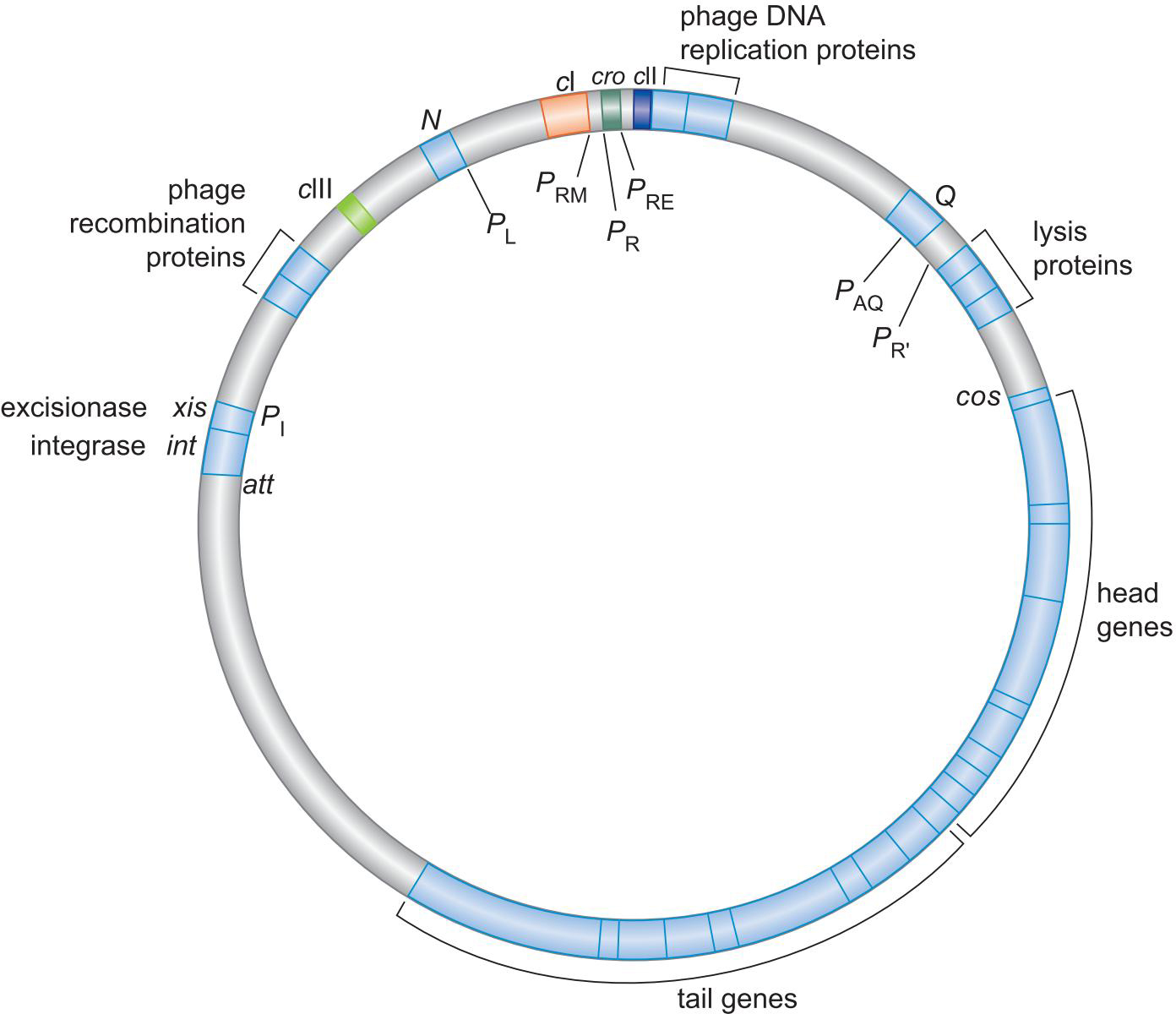
3.调控蛋白及结合位点
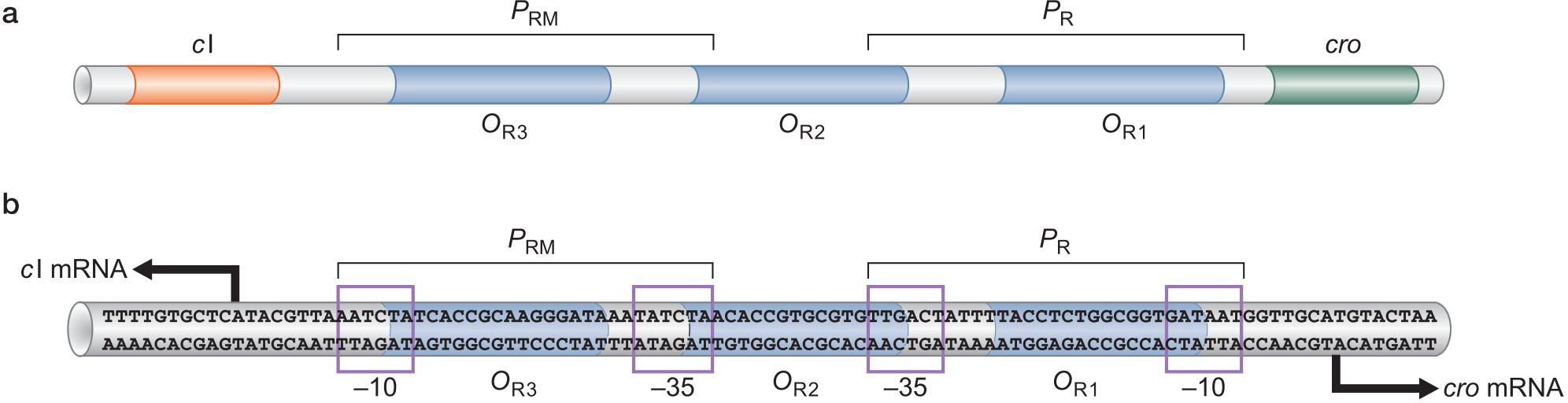
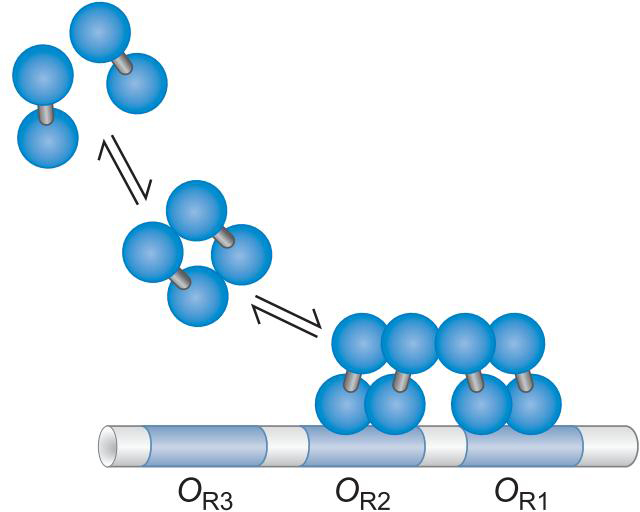
λ Repressor
- 与OR1亲和力强
![]()
- 通过协同结合,结合OR1 OR2
- λ repress 拥有抑制PR启动子的能力
- 占据聚合酶位点
- λ噬菌体可以激活PRM启动子
- 通过募集
Cro ,Control of repressor and other thing
- 与OR3亲和力强
- 抑制PRM启动子
- 占据位点
4、λ抑制因子 和 Cro 以不同模式结合控制溶原和裂解生长
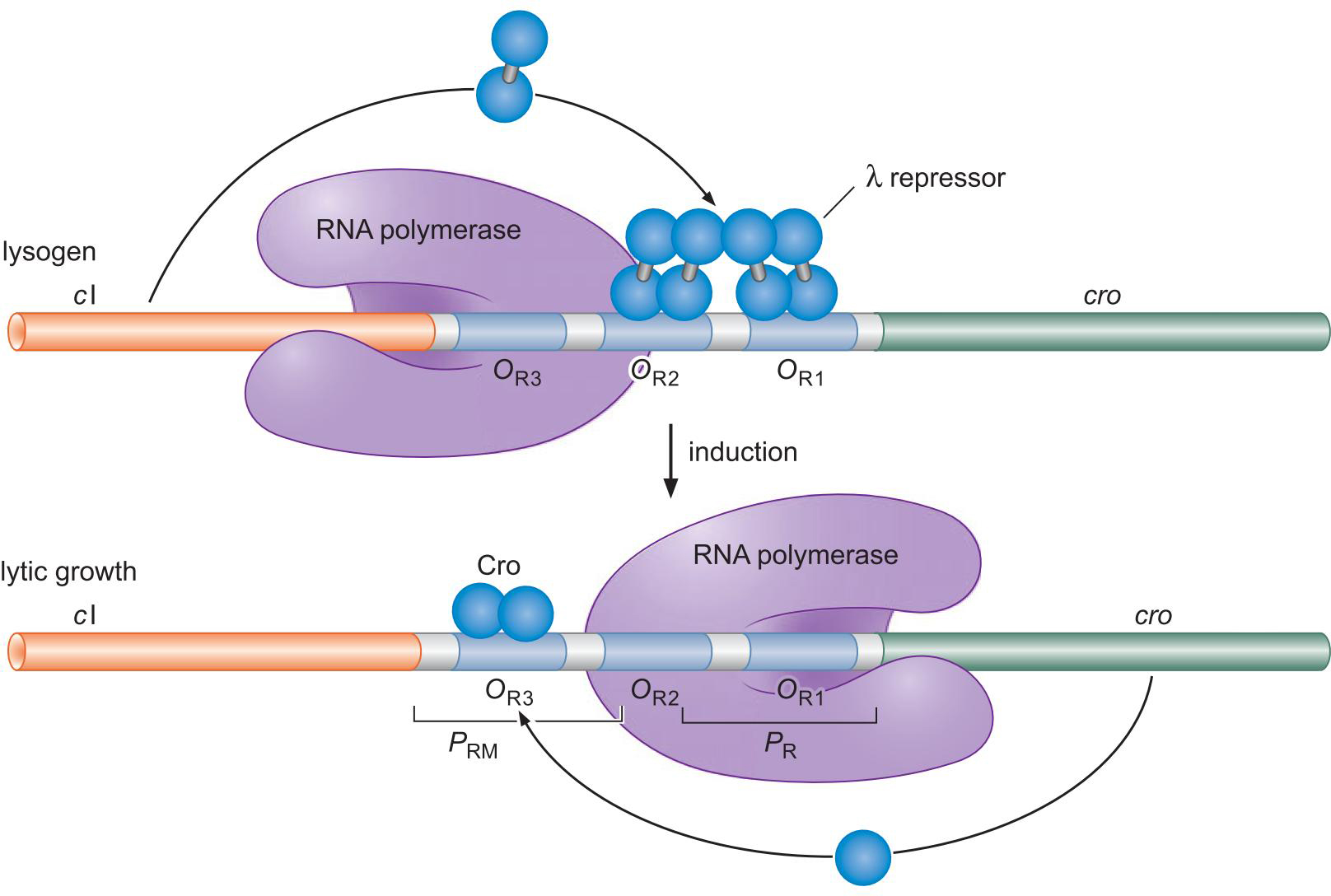
- 起初 λ repressor 抑制Cro转录,促进cl转录
- cl转录产物正反馈于此作用
- λ repressor 太多会阻碍OR3以负反馈
- 诱导后(噬菌体在危机环境逃离细胞)
- 表达的RecA切割 λ repressor,解除其作用
- Cro表达,抑制cl转录
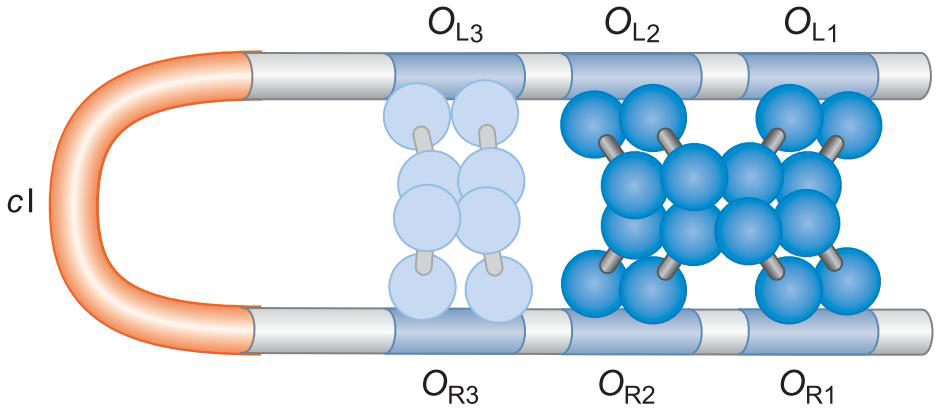
抑制因子的负自我调控需要远程相互作用
OR2-OL2,OR1-OL1的八聚体作用,形成环化
这样方便了OR3,OL3被λ repressor的结合,
这样严格的控制了λ repressor的表达在一定的窗口内
- repressor过少 难以抑制裂解
- repressor过多,阻碍了向裂解的转化
5、λ cII 另一种控制溶原、裂解的因子
- 抑制因子的合成由一个启动子的转录来确立
- 接着由另一启动子维持
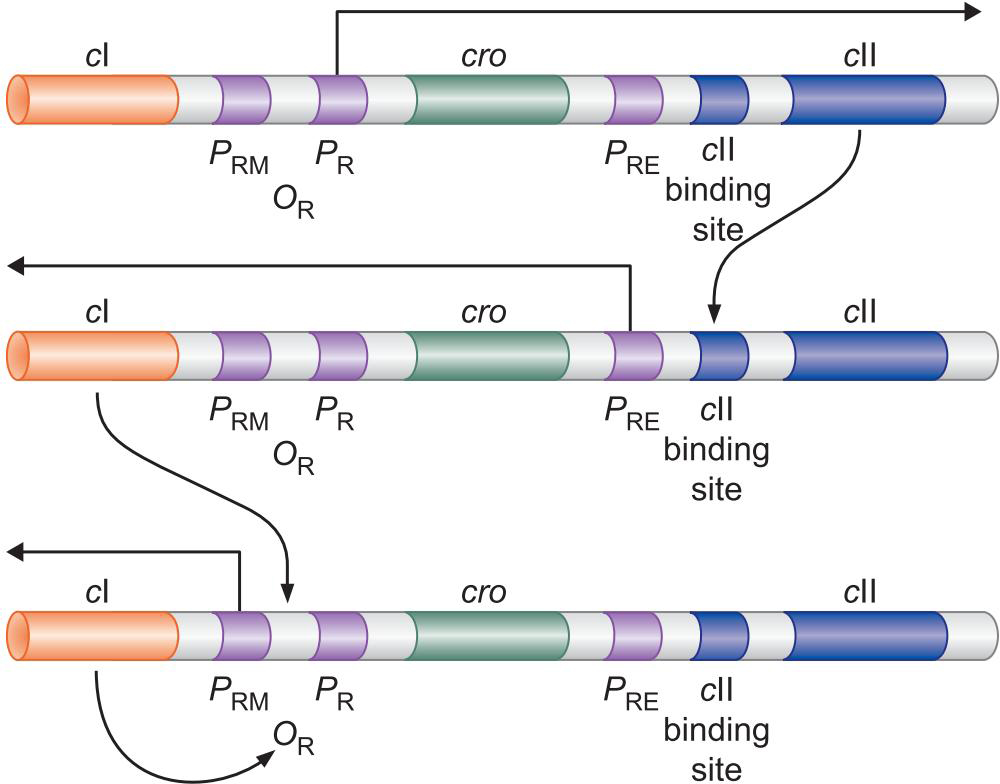
- PR,PL是强启动子,会结构性表达
- PRM是弱启动子,需要因子帮助
- 刚感染的噬菌体,PR,PL结构性表达
- 表达的cII 激活PRE启动子
- 表达出cl 生成的 λ repressor 关闭 PR,PL启动子
- 溶原状态
E.Coli 的生长条件控制C II 的稳定性,控制裂解、溶原的选择
- 一群健康生长的细菌中,FtsH使得cll降解
- 进入裂解,感染更多细菌
- 生长环境恶劣,cll作用
- 进入溶原,保持原有状态
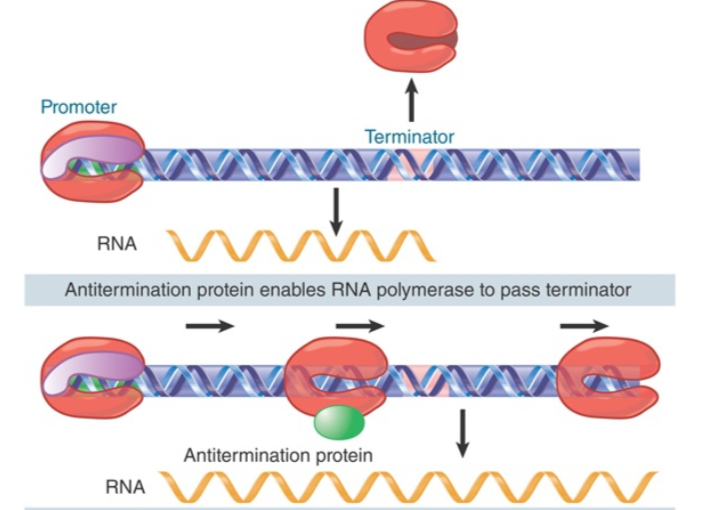
6、转录抗终止作用(antitermination)
- λ噬菌体侵入细菌后,整合进入细菌染色体,并且利用细菌的启动子
- λ噬菌体的基因位于细菌基因终止子下游
- 利用转录抗终止作用来转录噬菌体蛋白
- 细菌的rRNA基因转录也有抗终止,以防止在发夹处终止(见genes XII 17.22)
7、逆向调控:RNA合成和稳定性控制相互影响并且决定基因表达
真核生物的转录调控
一、
- 真核生物的转录调控更为复杂,除了原核拥有的调控方式外,还有
- 核小体及其修饰物
- 更多的调控因子和更密集的调控序列
- 转录系统结合位点:启动子
- 调控因子单一结合区域:调控因子结合位点
- 基因上包含所有调控因子结合位点的DNA片段:调控因子序列
- 增强子enhancer和绝缘子insulator
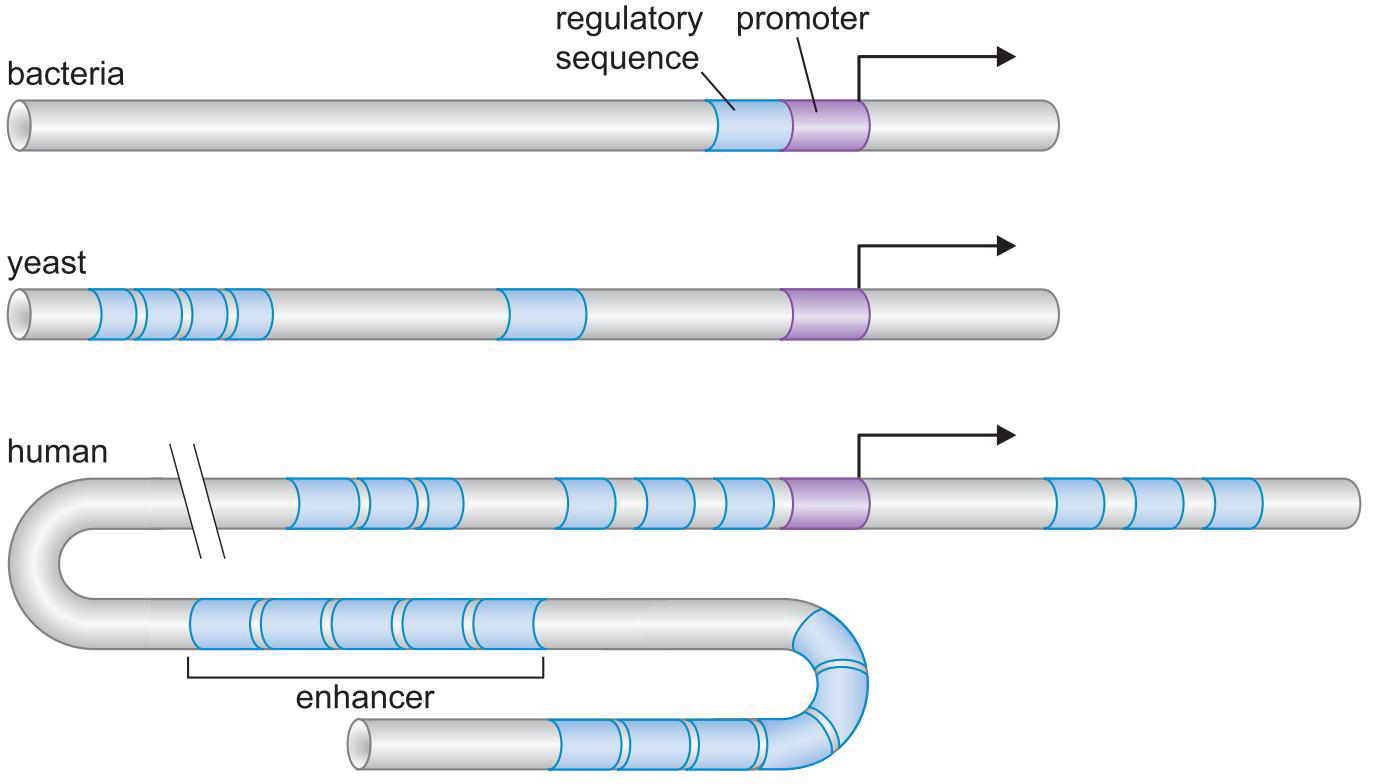
二、从酵母到哺乳动物转录的保守机制![]()
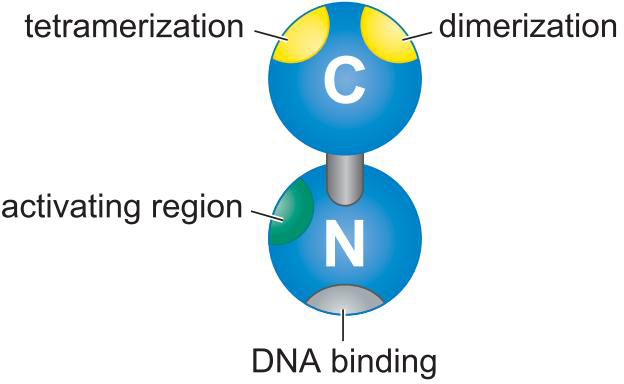
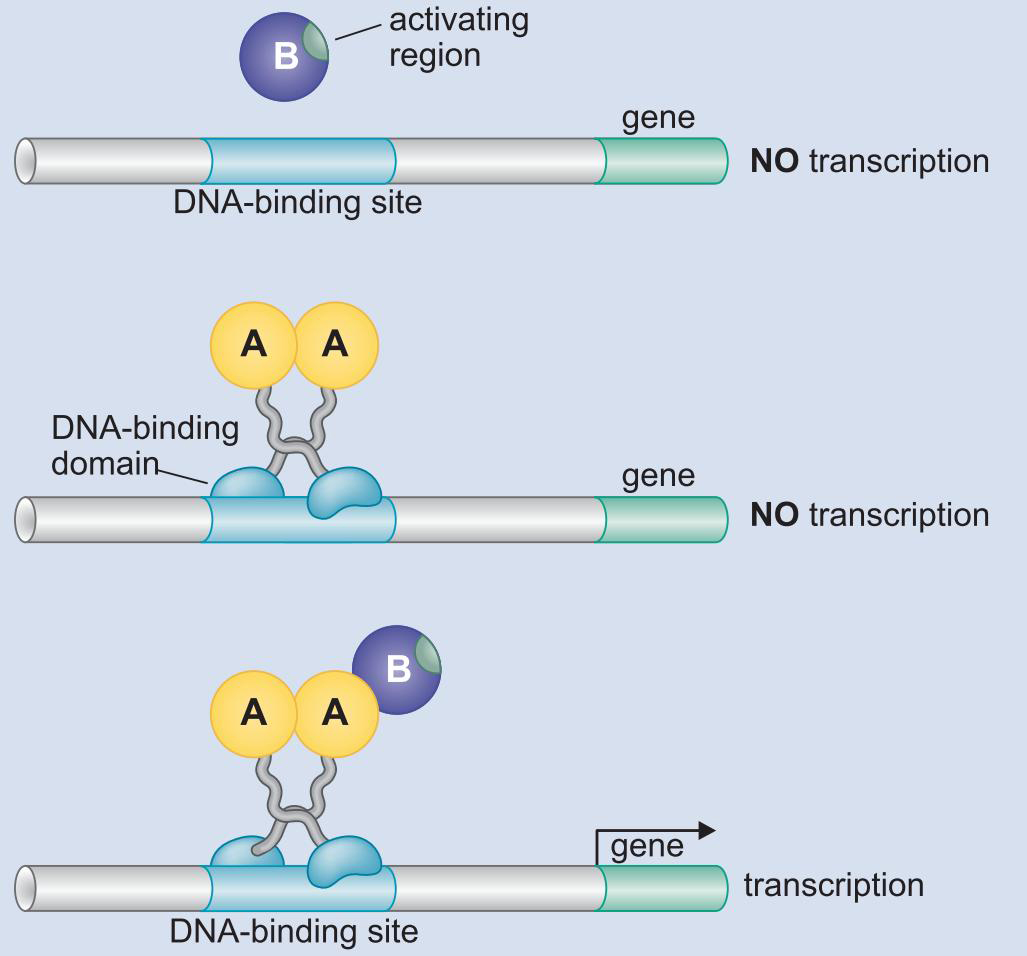
1、激活因子DNA结合与激活功能分离
- 酵母Gal4二聚体的结合域激活域相分离
- 与GAL1基因上游的四个UASG序列结合
- 域交换实验说明,结合域只要将激活域带到启动子,就能启动
![]()
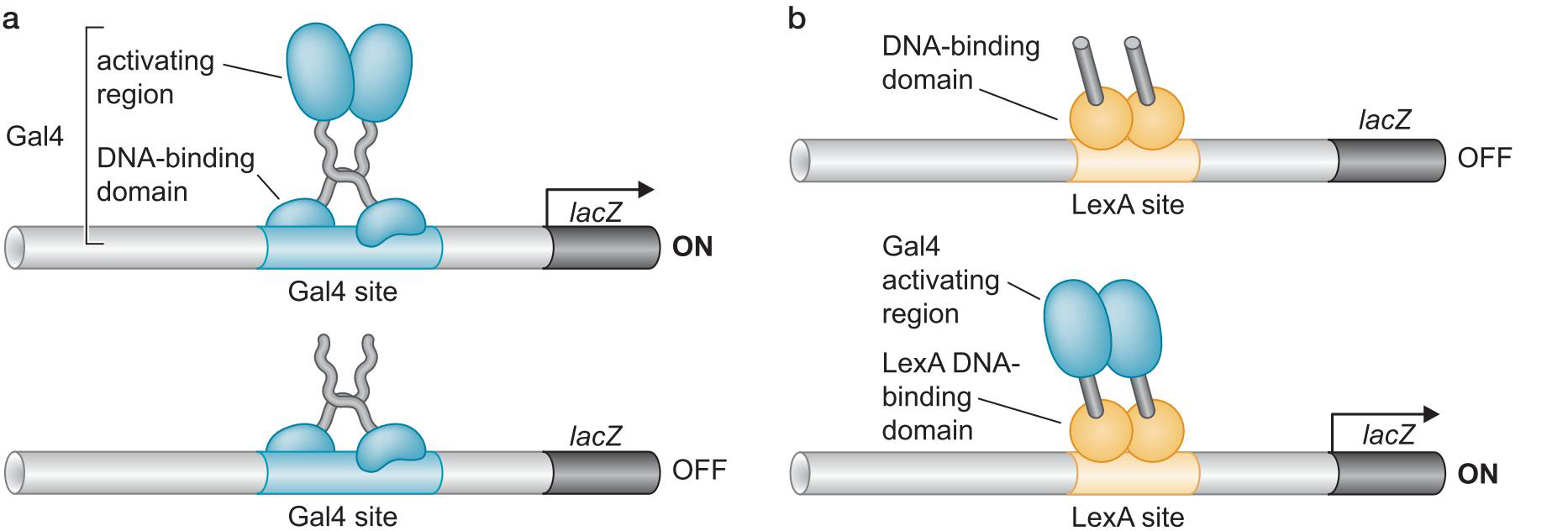
双杂交实验
2、结合域:识别原理与细菌大致相同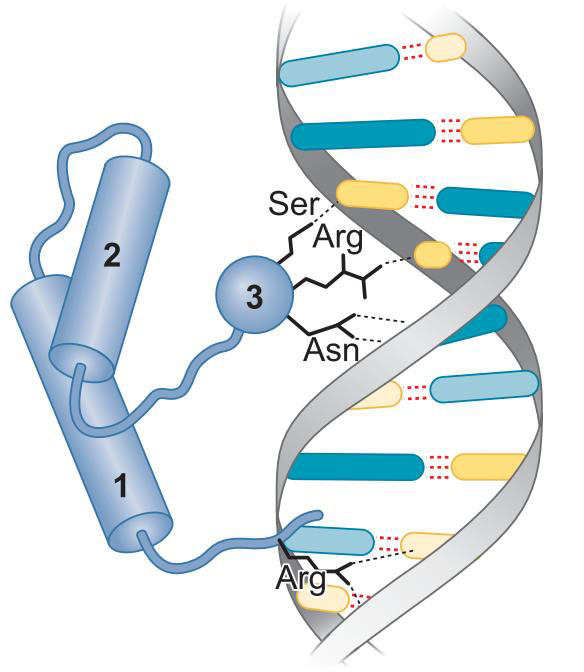
- 有和细菌类似的同型二聚体
- 有的使用异二聚体,以增加可使用的范围
- 有的使用单体
- 一搬不改变DNA构相
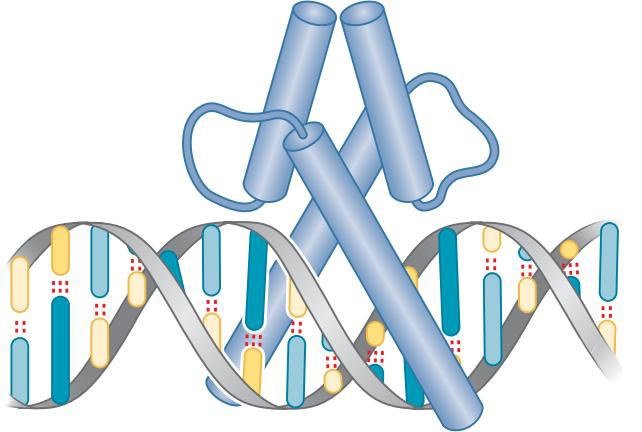
①同型结构域蛋白质(homeodomain)
- 结构细节不同物种差异很大
![]()
- 右图
- 3为识别螺旋
- 1中伸出一臂,与小沟特异性结合
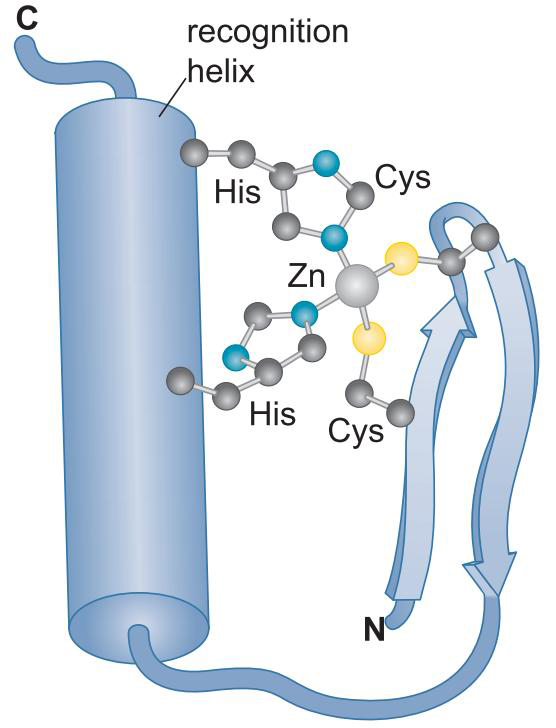
②含锌DNA结合域
- 锌原子与氨基酸残基作用,起到稳定作用
- 有些蛋白质有多个锌指结构,每个锌指以α螺旋嵌入大沟中,增加识别序列长度
③亮氨酸拉链结构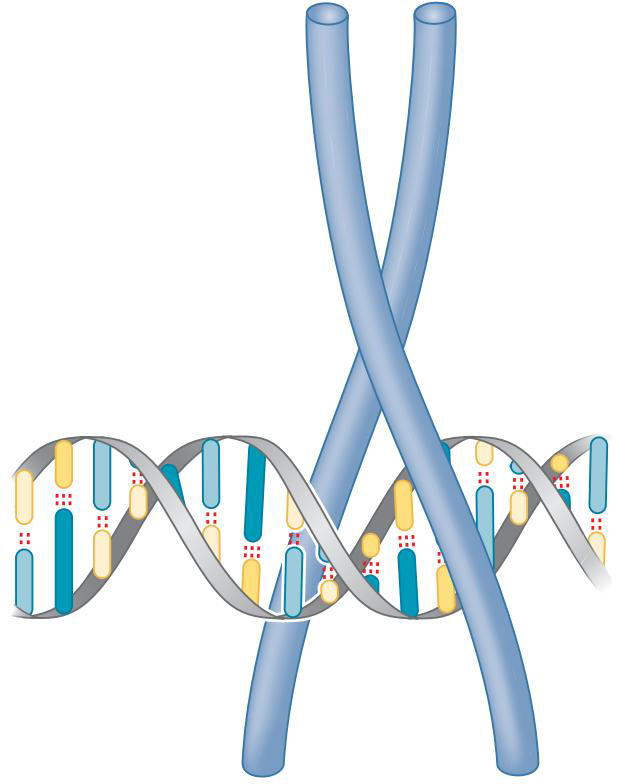
- 两个长的alpha螺旋形成钳形结构,将DNA夹于其中
- 每个α螺旋嵌入大沟一半的转折部分
- 二聚化由某一部位的疏水残基(如亮氨酸)疏水作用介导的
- 有亮氨酸拉链的蛋白质经常形成同型二聚体
④螺旋-环-螺旋蛋白
- 二聚体的每一个单体由大helix与小helix以非刚性的环分离
![]()
- 这两个环容许两结构靠近
⑤快速泳动蛋白
- 其高度保守肽链AT hooks与小沟作用
- 显著改变DNA构相
3、激活域的结构不确定性
- 激活域与靶点结合时会诱导成为螺旋结构
- 激活域由许多重复的具有弱小激活能力的小单元构成
- 缺乏整体上的结构
- 酸性特征模式
- 疏水残基
- p695
三、通过真核生物激活因子的募集结合基因的蛋白复合物
以募集为主,也有少数直接作用
- 募集核小体修饰成分,开启启动子
- 募集一般转录因子复合物(中介蛋白等)
- 募集刺激Pol II起始延伸的复合物(pTEFb/SEC)
1、激活因子募集转录装置到基因上
- 激活因子募集一个或多个复合体
- 其他没有募集的,则和以募集的结合,协同作用
- 大部分转录装置是在激活后才装载的
CHIP-Chip 和 CHIP-Seq是鉴别增强子的最佳方法
2、激活因子也募集核小体修饰物来帮助转录装置结合到启动子上
两种方式
- 增加组蛋白尾端化学基团(组蛋白乙酰转移酶)
- 改变组蛋白末端与核小体的相互作用,松弛了染色质结构
- 乙酰化的组蛋白易于与 TFIID 等的同源调节域(bromdomain)
结合
- 替换\重塑 核小体(SWI/SNP)
- 暴露核小体内部的结合位点
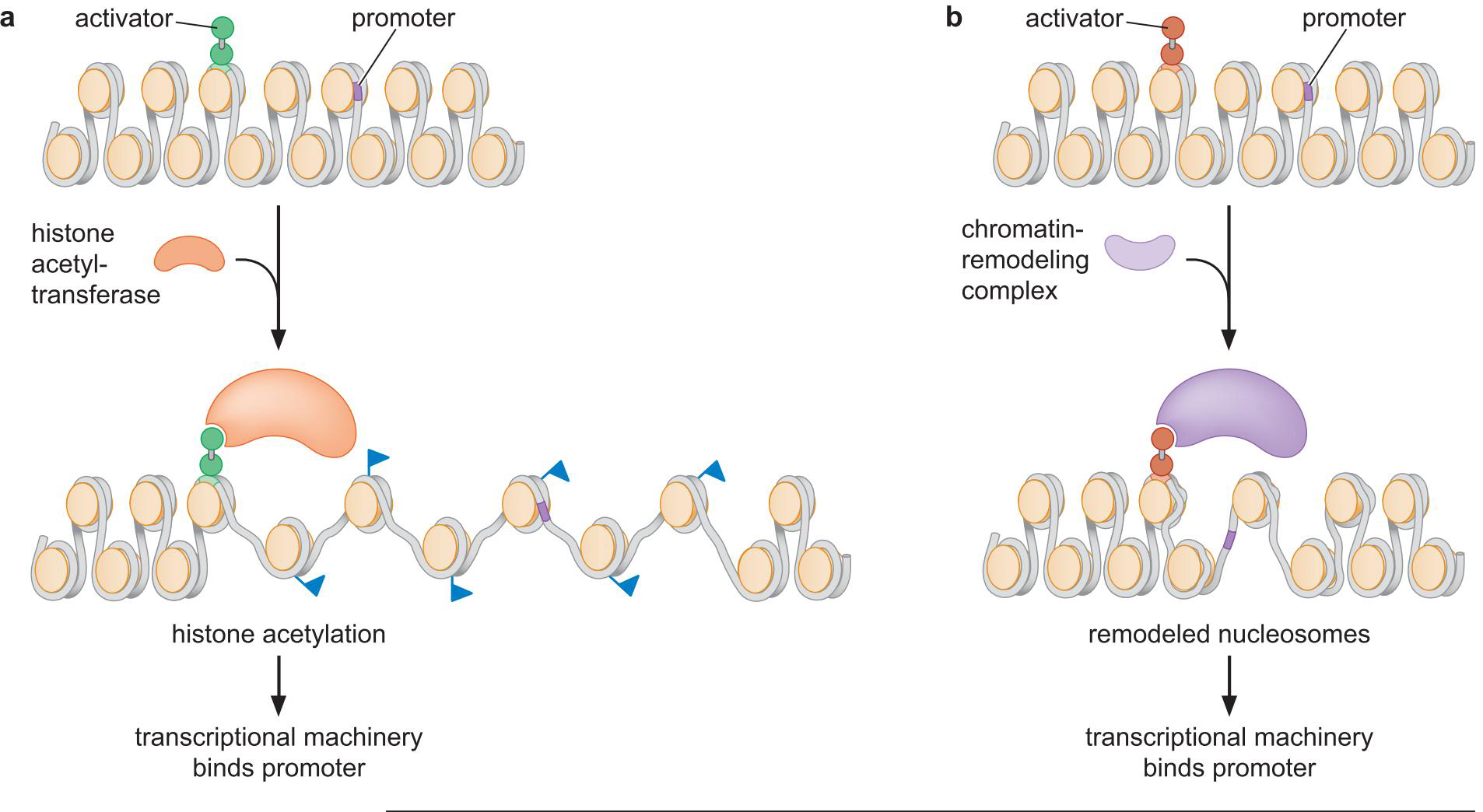
转录与特定的装置和修饰的关系
- 需要特定的组分和修饰
- 某些组分和修饰能提高效率
- 对组分和修饰的需求和特定环境有关
3、某些启动子上激活因子募集另一个因子来进行有效的起始和延伸
- 果蝇的热应激与转录抗终止:
- 转录在下游停滞
- 热应激:第二激活因子HSF募集P-TEF
- P-TEFb通过磷酸化CTD释放停滞的聚合酶
- 聚合酶暂停现象是普遍的:人的发育分化阶段
组蛋白修饰,转录延伸 和白血病
- 暂停和再激活有助于保持启动子少核小体并时刻准备快速诱导
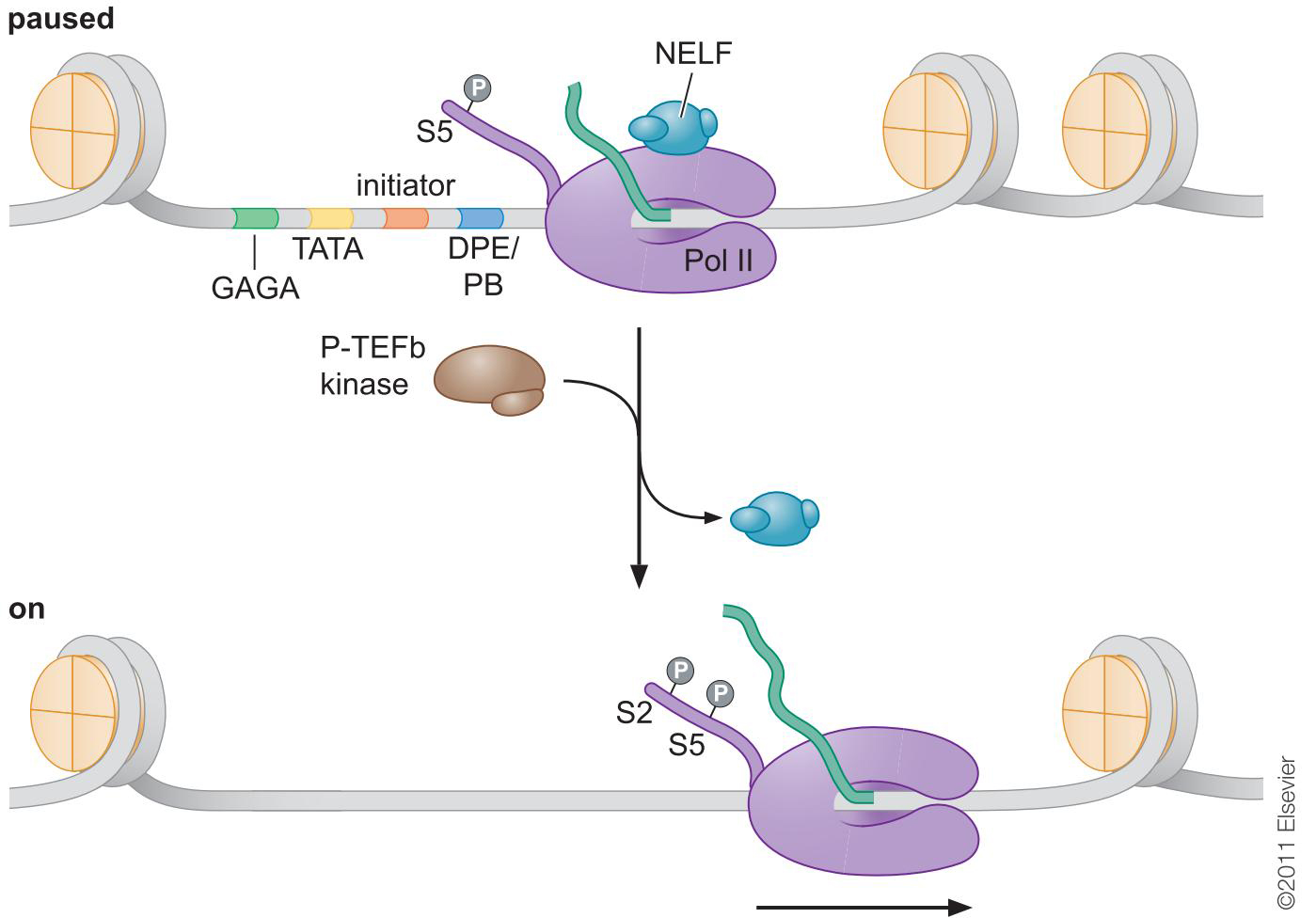
4、远距作用:环与绝缘子
原理
- 一种模型: Chip蛋白与DNA相互作用,DNA形成许多小环,使启动子离增强子更近
- 绝缘子控制激活因子的行动,使得适当的启动子被激活(或沉默)
- 绝缘子抑制染色质修饰的展开
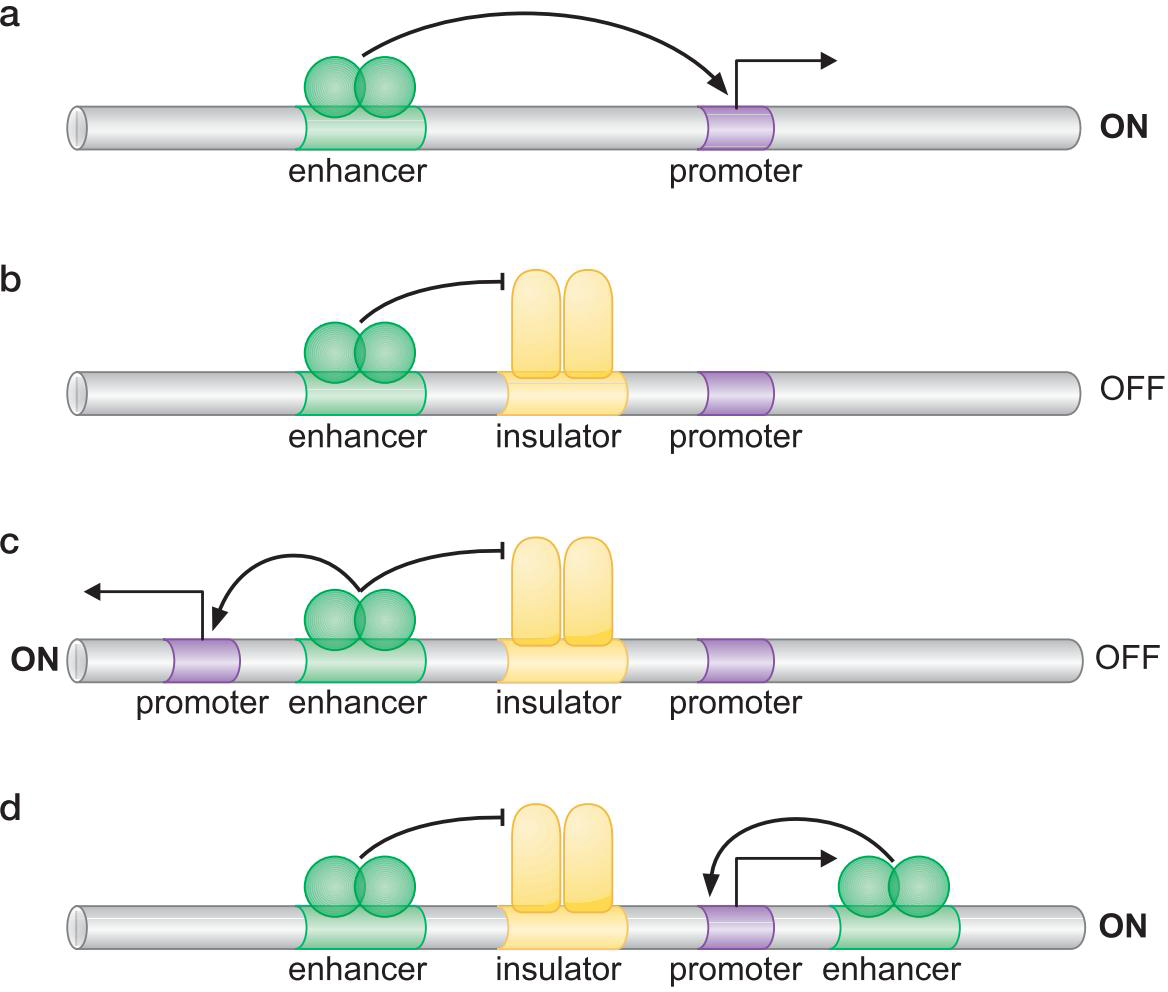
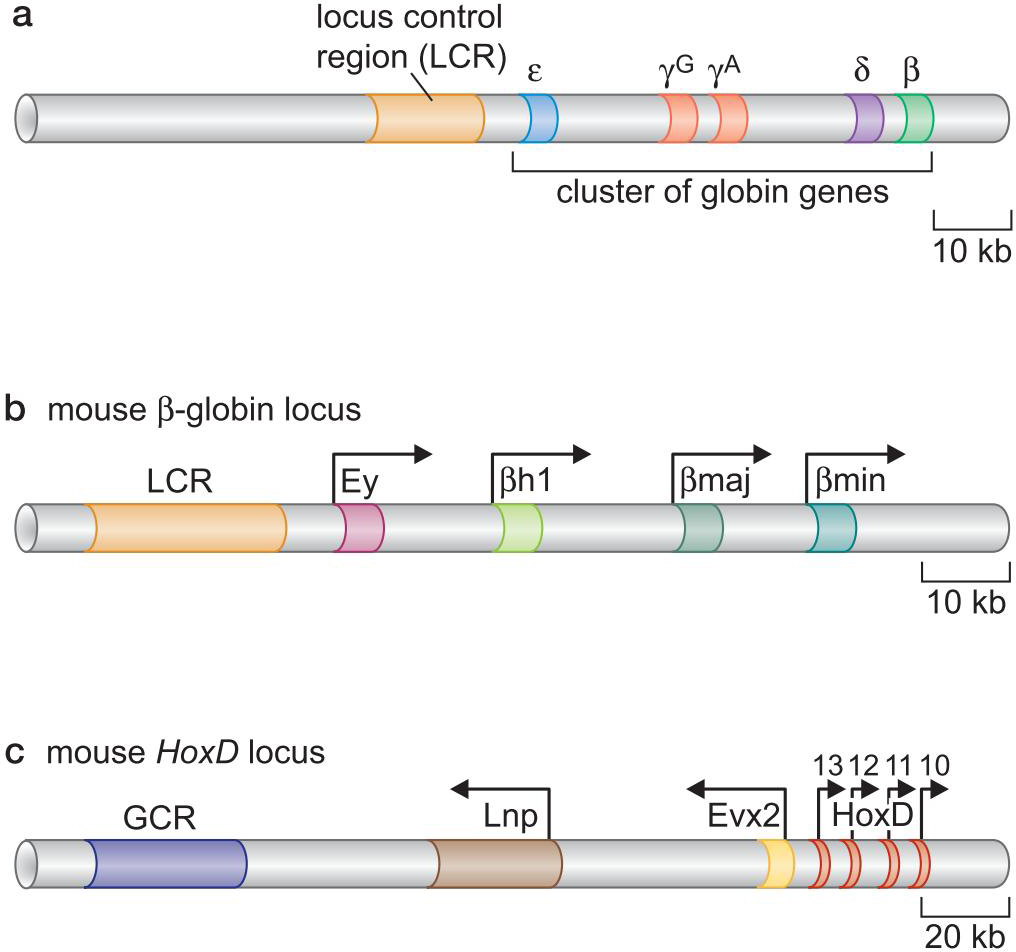
5、某些基因群的正确表达需要位点控制区域(locus control region)
- 转录装置被募集到LCR
- 随着转录的前行,打开染色质
- 释放局部控制元件
- 这些单个启动子随后产生每个基因所需的高水平表达
四、信号整合与组合控制![]()
1、激活因子协同作用促进信号整合
- 多个激活因子联合作用:协同作用
- 产生 1+1>2 的效果
- 协同的三个来源:
- 多个激活因子各募集转录装置的同一组分
- 中介蛋白的募集
- 募集不同组分
- 多个激活因子相互帮助与调控基因上游位点结合
- 协作结合,如右图
- 两个一起结合
- 在第三者的帮助下结合
- 第一个蛋白使染色质变构,促结合
- 多个激活因子各募集转录装置的同一组分
- 协同使得多个激活因子存在时,基因才能表达
2、信号整合的例子
① HO因子受两个调控因子的控制,一个募集核小体修饰物,一个募集中介蛋白
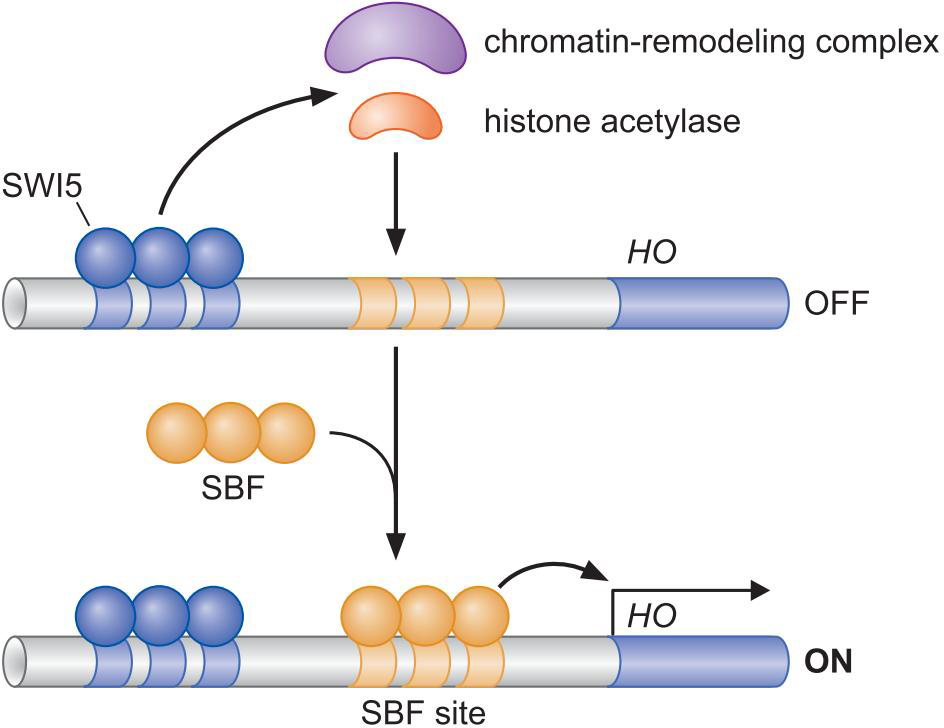
- SWI5相距1kb,募集核小体修饰物
- SBF结合,募集中介蛋白
②激活因子因子协同作用,共同与人类干扰素β基因结合
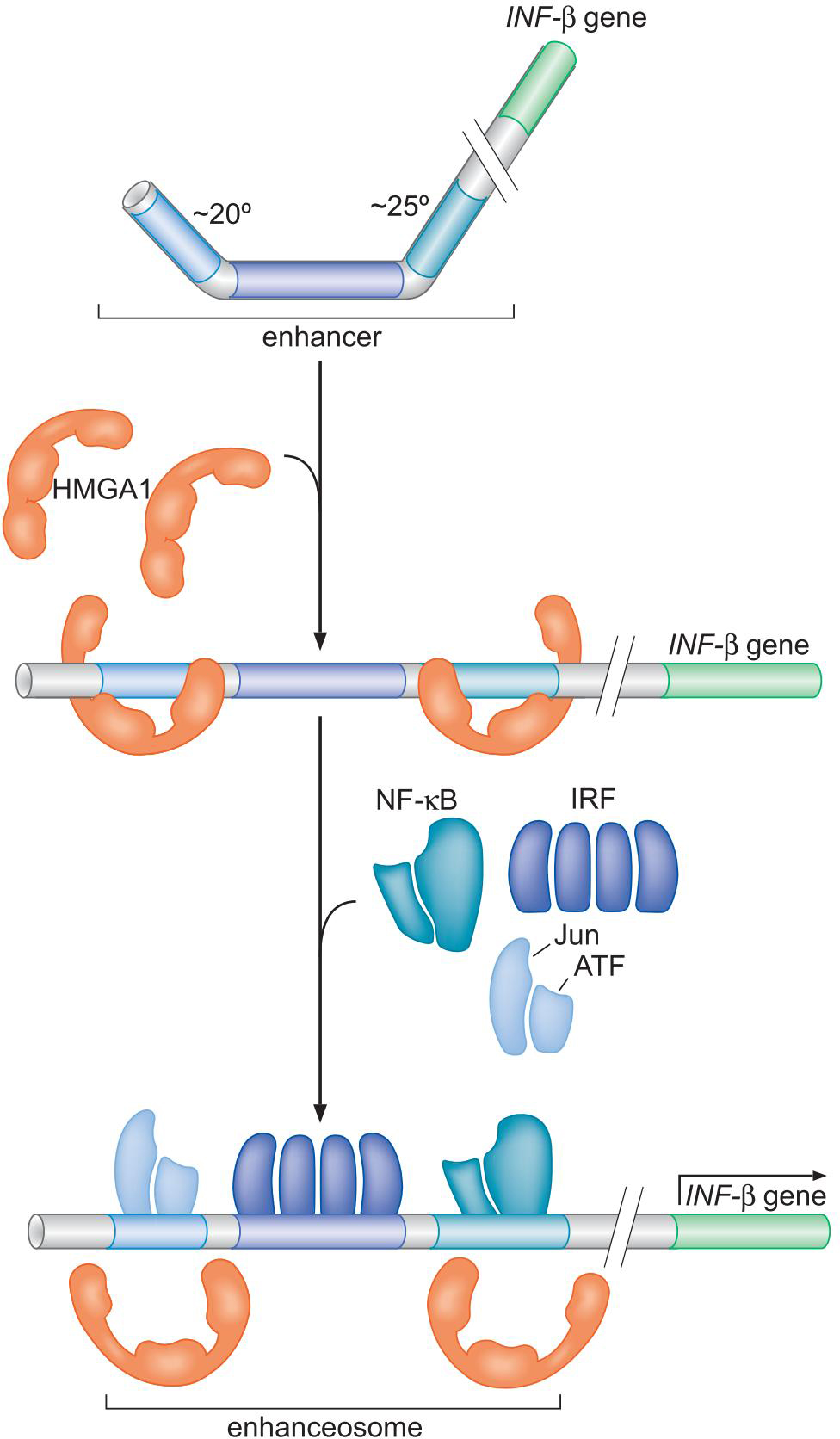
- HMGA1拉直染色体
- 四种蛋白协同地一个挨一个结合
- 募集CBP:组蛋白修饰活性
- 募集转录装置
3、组合控制是真核细胞复杂性与多样性的核心所在
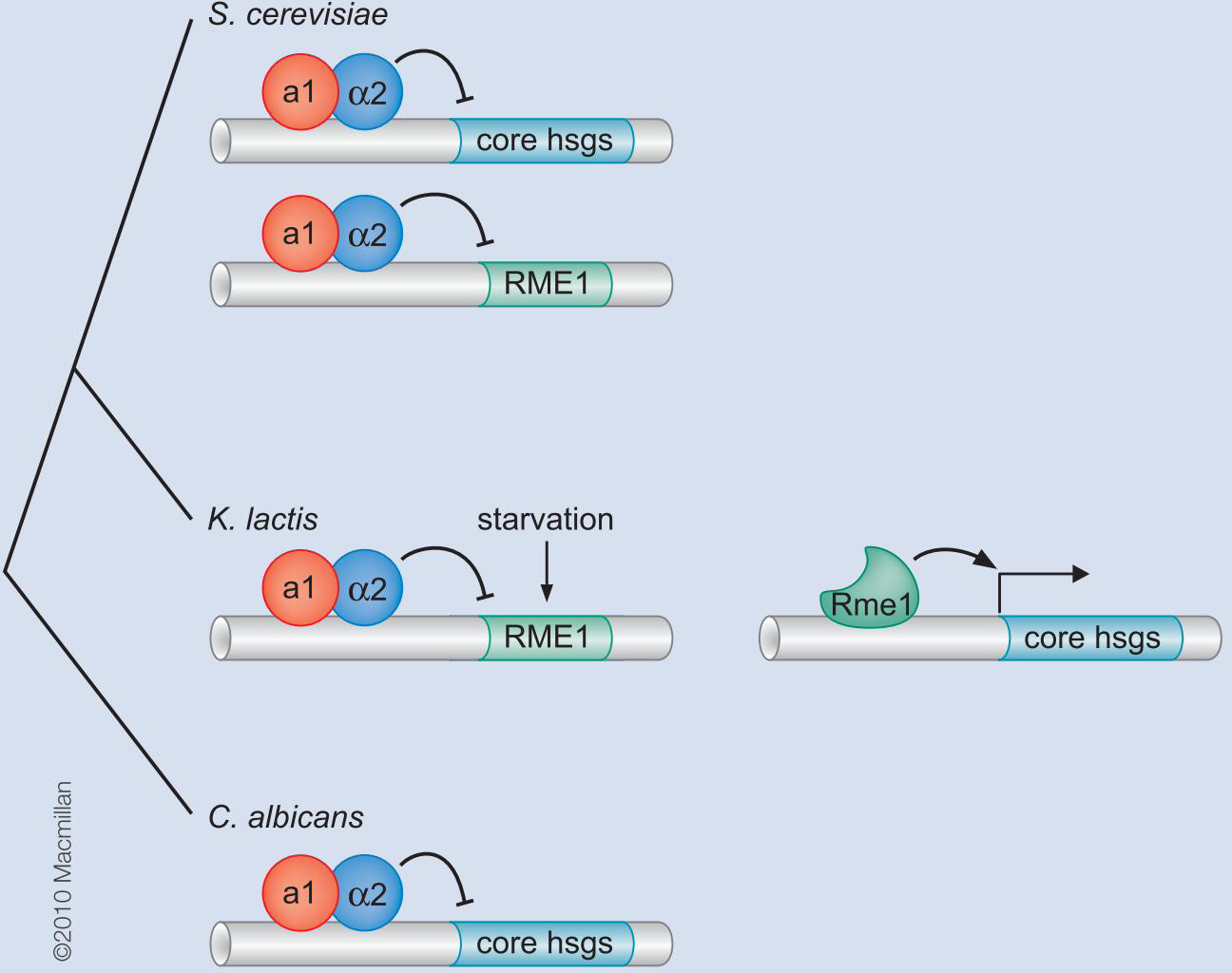
酿酒酵母S.cerevisiae交配型基因的组合控制
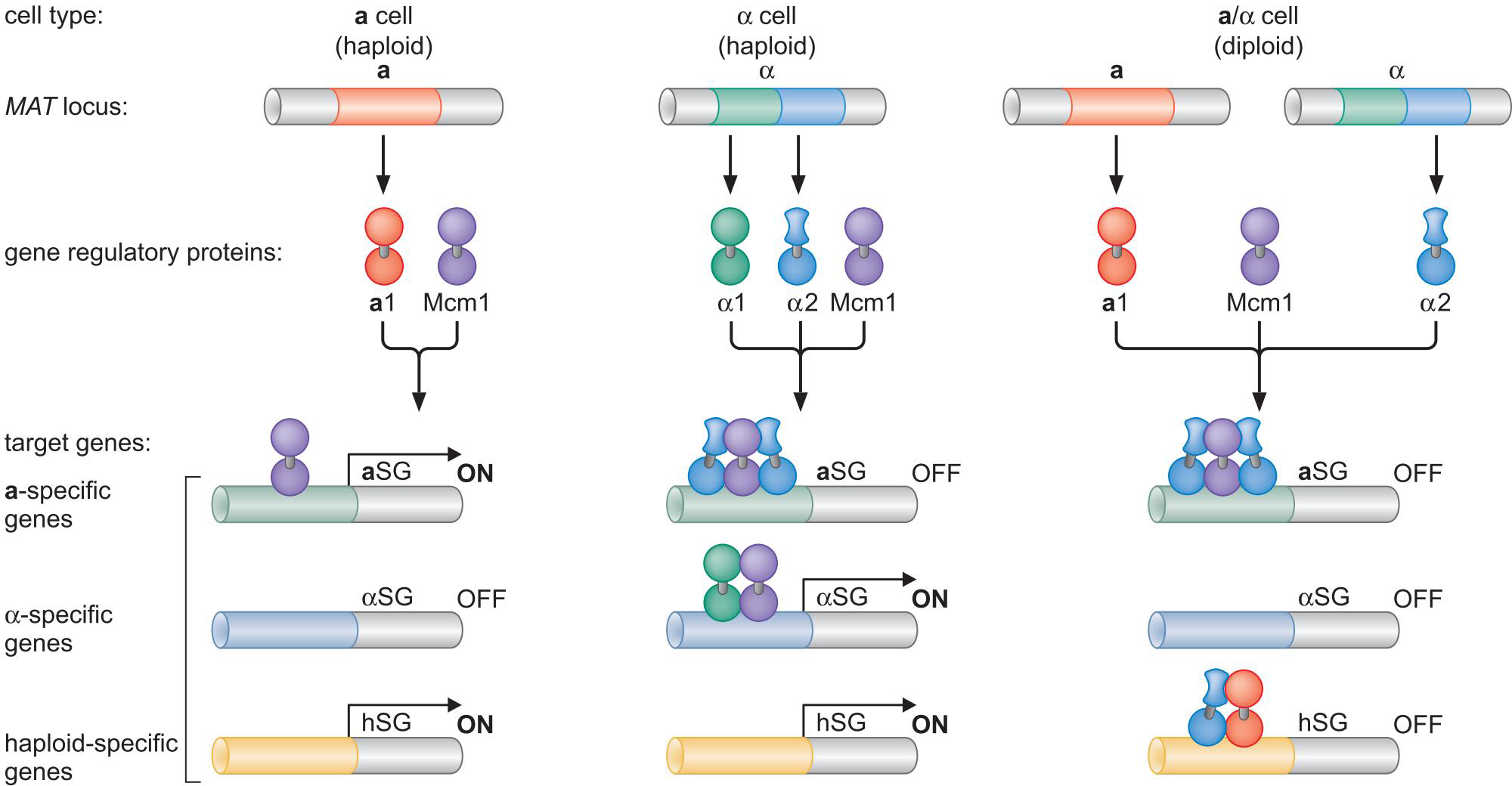
调控回路的可演化能力
乳酸酵母K.lactis 通过抑制RME消除对hsgs的激活
如此,把RME1插入到hsgs的调控回路中,增加了营养条件决定交配细胞类型的新的调控层次
五、转录抑制因子
- 核小体紧凑
- 组蛋白脱乙酰化
- 组蛋白尾部甲基化
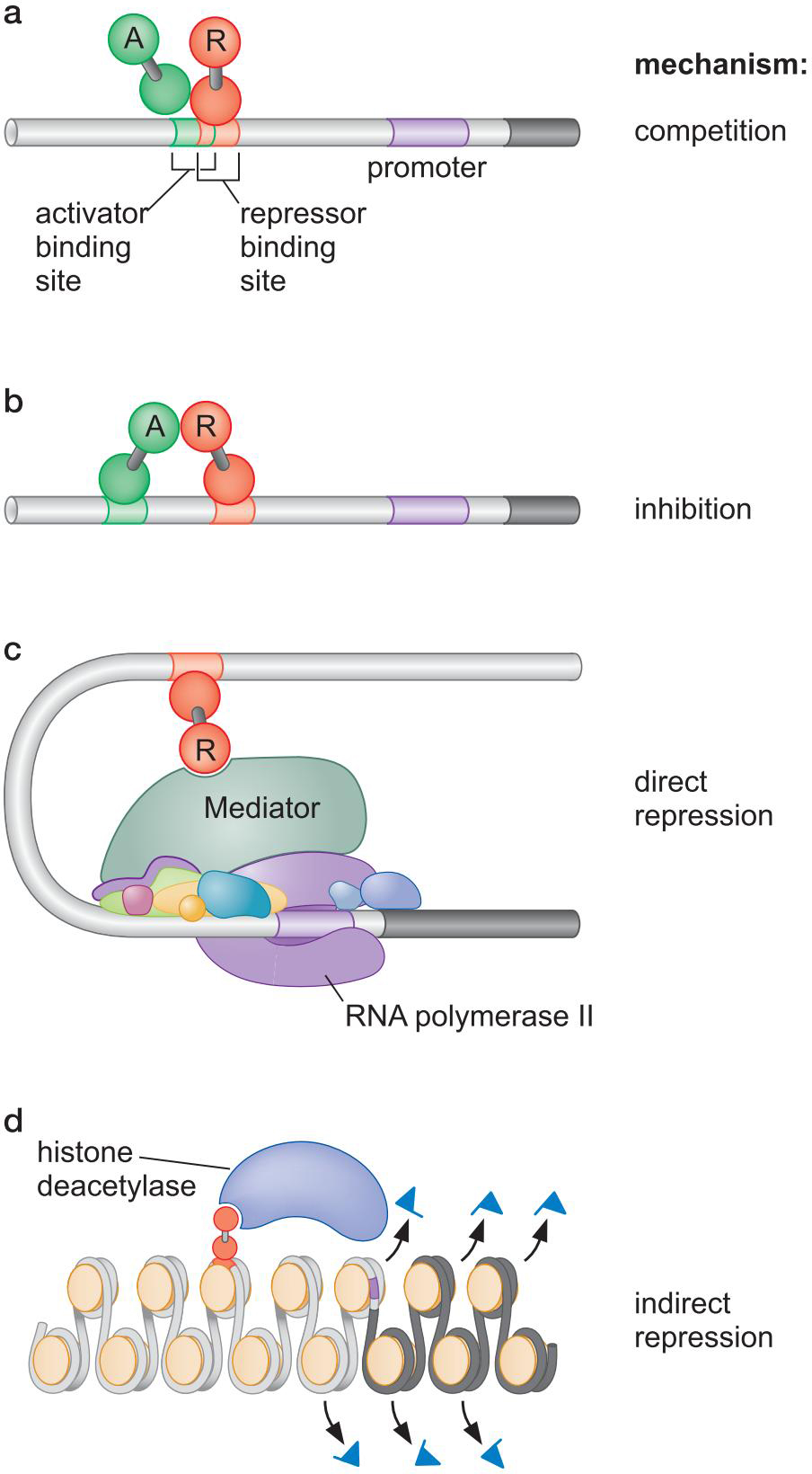
- 竞争结合位点
- 抑制激活域
- 直接限制转录装置
- 通过(去)修饰来抑制
六、信号转导与转录调控因子的控制
1、信号的转导方式
- 示例:
- STAT和Ras通路
- 引导下游MAPK通路的Ras通路
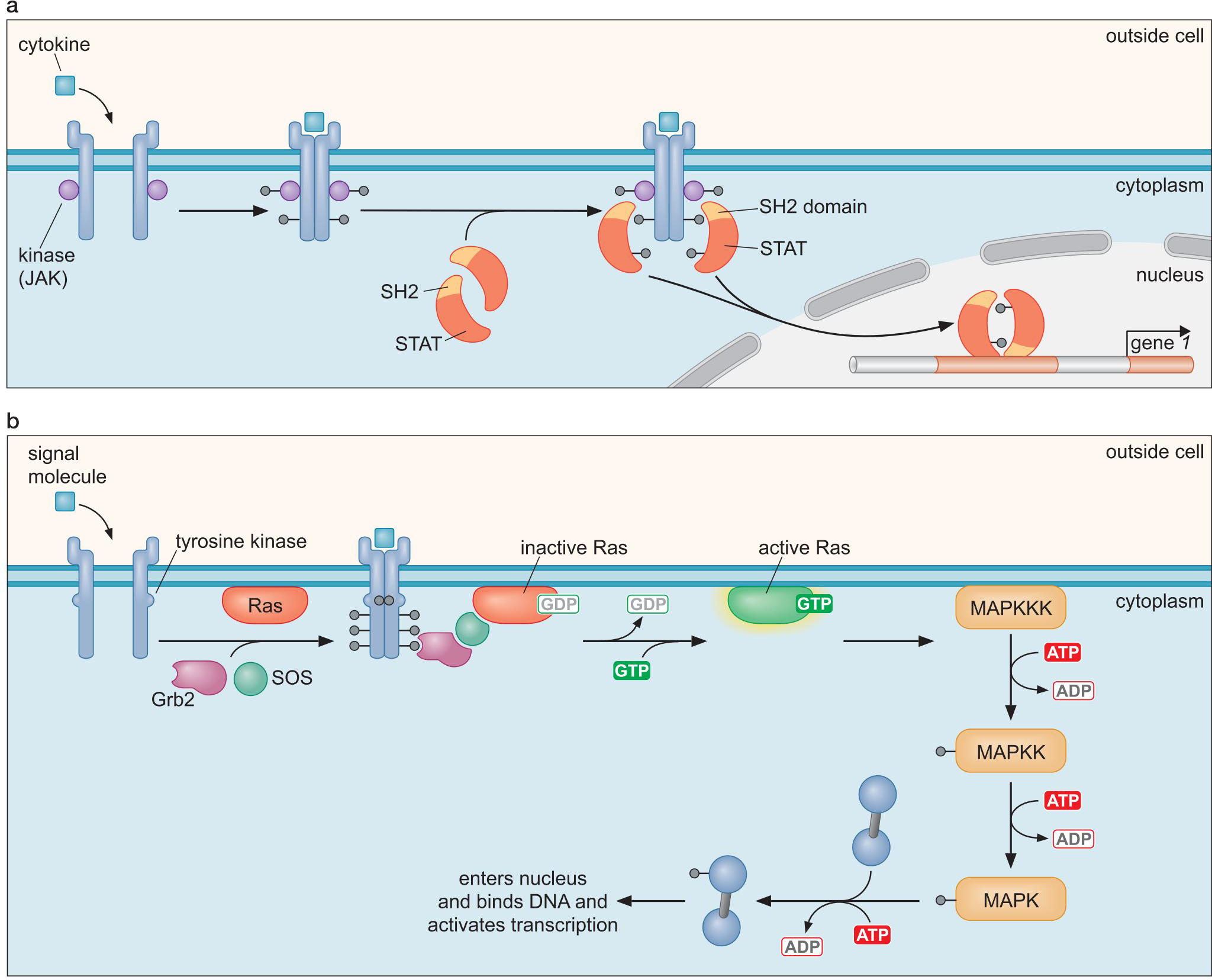
2、信号控制真核细胞转录调控因子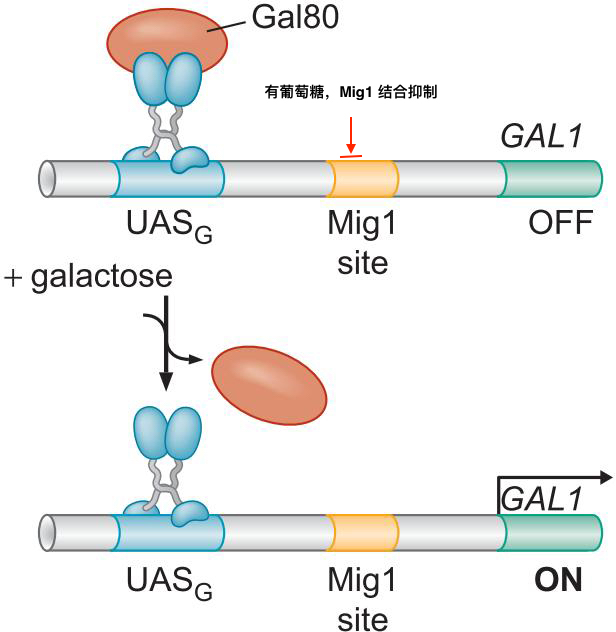
- 激活区的暴露
- 右图
- 控制运输入核
- 与抑制性蛋白相互作用
- 与细胞膜相互作用
- 改变构象,使得入核信号隐藏
七、组蛋白与DNA修饰导致的基因沉默(silencing)
- 是一种位置效应
- 沉默在大段的基因序列上可以扩散
- 最常见的沉默形式是异染色质
- 端粒
- 着丝粒
- 修饰改变染色质密度
- 甲基化沉默
- 抑制蛋白结合
- 甲基化后易于被抑制因子识别
1、酵母中,沉默由组蛋白的脱乙酰化和甲基化介导
- Rap1募集 Sir 复合体至端粒
- Sir2使临近核小体脱乙酰化
- 未被乙酰化的尾部随后和Sir3,Sir4结合,募集更多Sir复合体
- 是DNA结合蛋白赋予了整个过程的特异性,在某些例子中,是RNA分子充当了这个角色
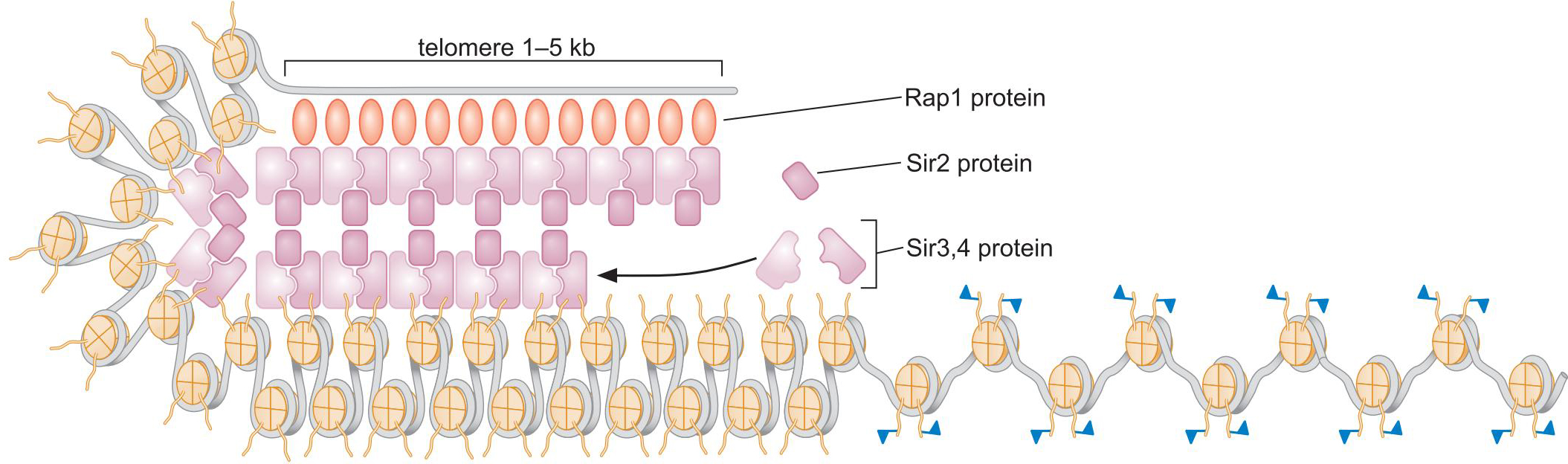
- 沉默区域扩散的节制:
- 绝缘子元件阻碍组蛋白修饰的扩散
- 其他种类的组蛋白修饰阻碍了Sir2的结合,终止了扩散
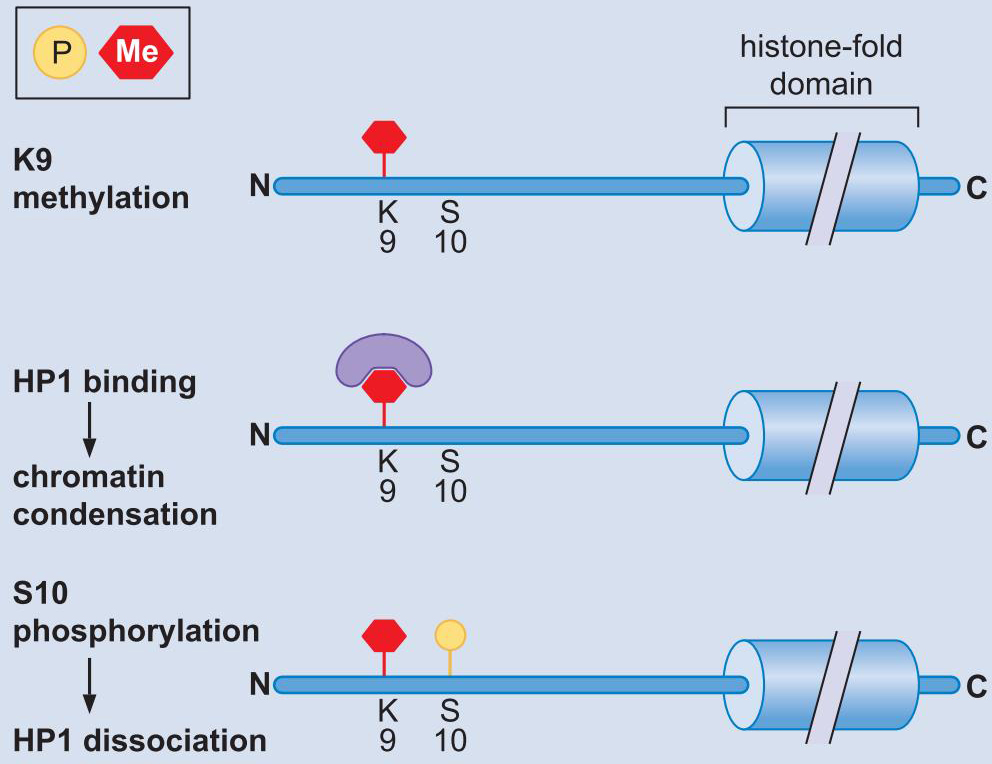
- H3尾甲基化
组蛋白密码
- 特定的基因座上复杂的组蛋白修饰产生高度特异的信息
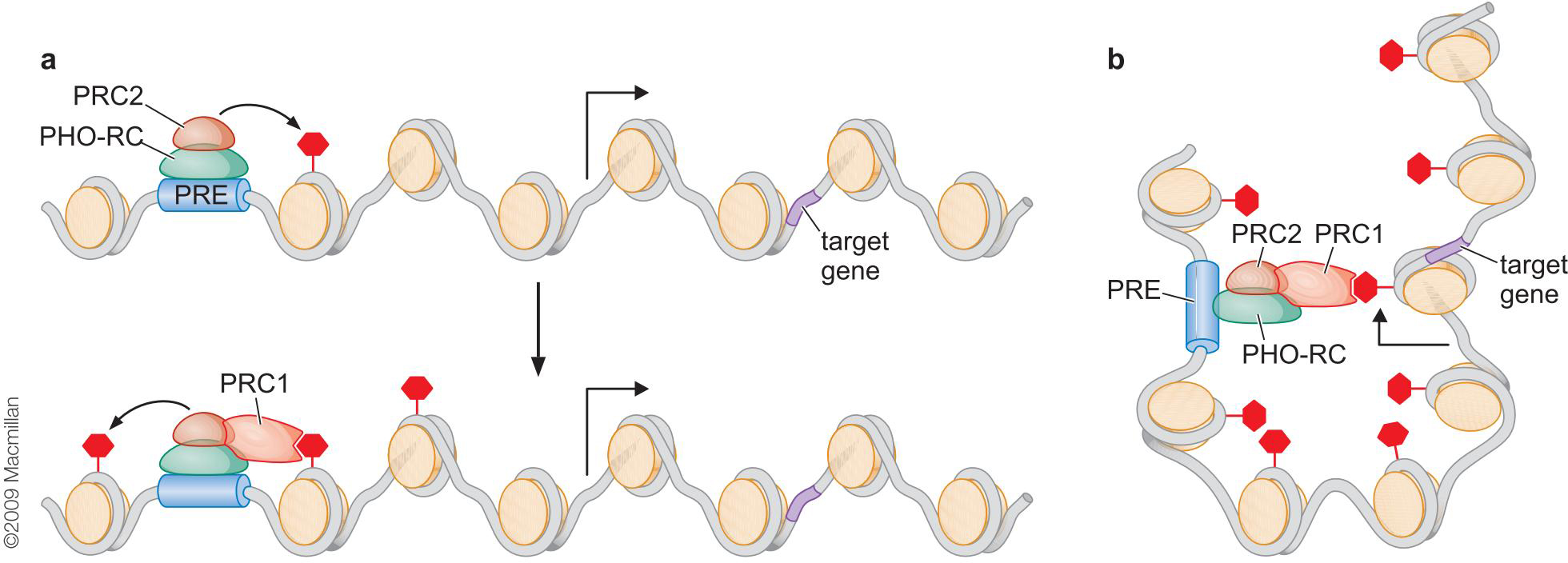
2、多梳通过调控组蛋白甲基化介导基因抑制
- PRC2与特异DNA结合蛋白形成Pho-RC抑制复合物,结合在DNA上
- PRC2的甲基转移酶活性,赖氨酸-27发生三甲基化
- PRC1的结合
- 核染色质压缩
3、哺乳动物细胞中DNA甲基化与沉默状态的基因相关 
- DNA甲基化
- DNA结合蛋白(MeCP2)识别
- DNA结合蛋白募集组蛋白脱乙酰酶,组蛋白甲基化酶
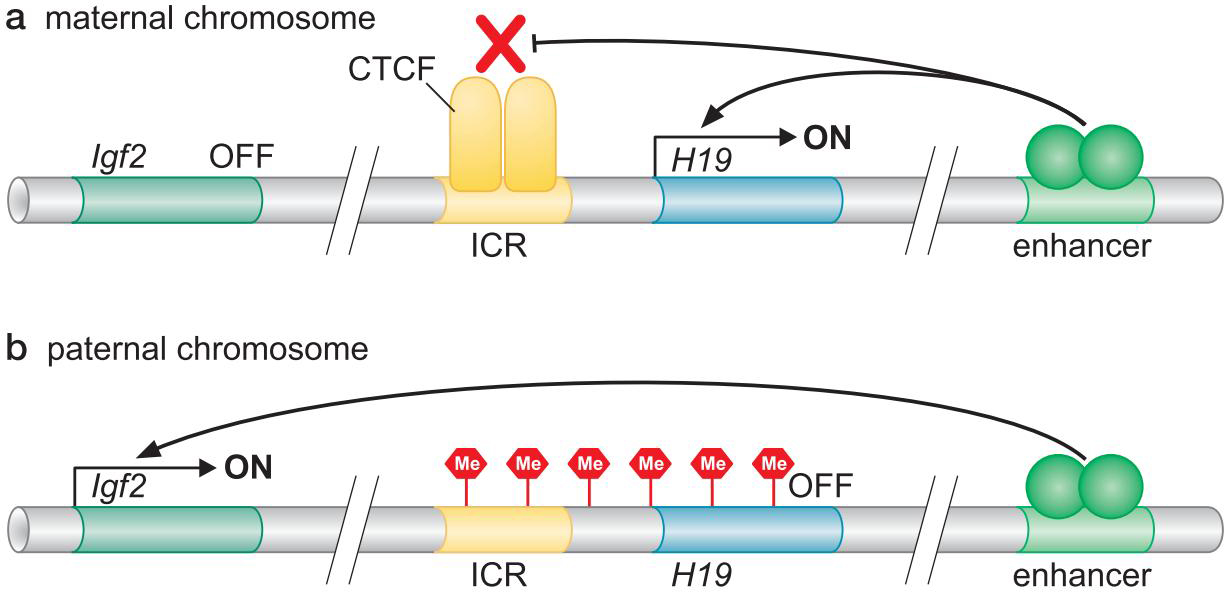
- 印迹(imprinting)
- 绝缘子元件的甲基化状态决定了CTCF能否结合,进而决定表达什么基因
八、基因的表观遗传调控
- 基因表达模式的继承:基因表达的某些状态通过细胞分裂得以继承,即使起始信号不再存在
- 与之相反的是有信号才表达的:lac、GAL
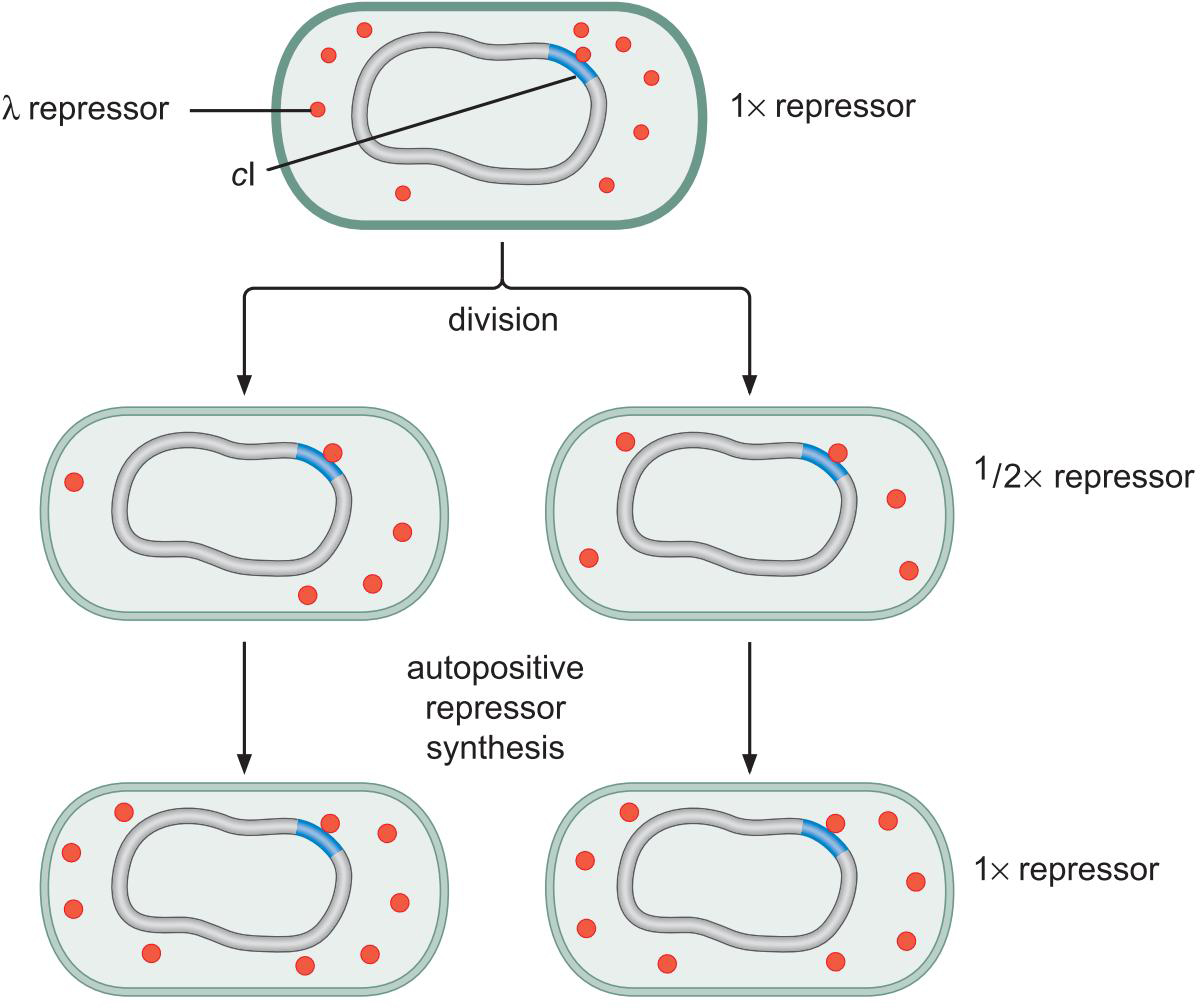
①抑制因子蛋白随细胞分裂而去到两个细胞,这些抑制因子蛋白足以刺激再合成补充
②维持甲基化酶对甲基化的维持
维持甲基化酶识别子代半甲基化位点,修饰
③核小体修饰理论
复制获得子代半甲基化的核小体,募集修饰蛋白,变成全甲基化
复习题(自己):
- 在转录起始处发生的调控类型,并举例
- 调控蛋白如何识别DNA
- 选择性的σ因子选择性启动的实例和意义
- lac操纵子的机理与cap的结构
- 转录因子旁路实验
- 激活因子启动子的特征
- 噬菌体控制感染后裂解/溶原状态的选择,保持与转换的机理
- 与小沟作用的蛋白有哪些
- TBP,LEF-1,高速泳动蛋白
posted on 2018-10-17 11:03 iojafekniewg 阅读(4908) 评论(0) 收藏 举报





 浙公网安备 33010602011771号
浙公网安备 33010602011771号