Chapter6 胞内信号网络
一、一条从细胞表面到细胞核的通路
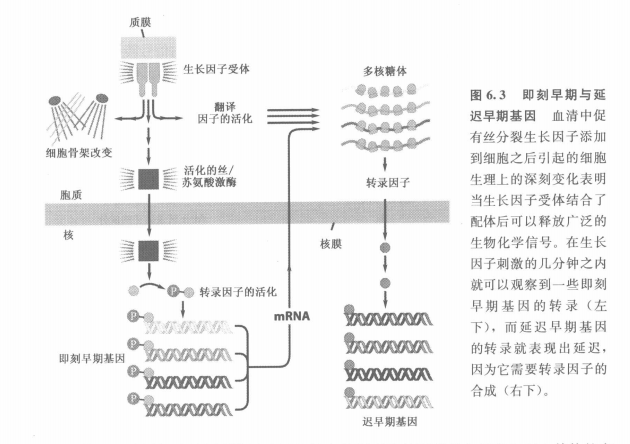
二、Ras蛋白处于复杂信号级联的中心位置
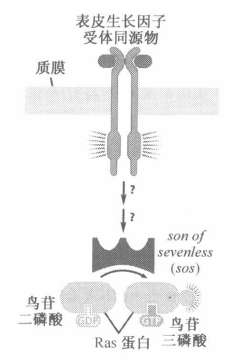
胞外信号→酪氨酸激酶受体→Shc→Grb→Sos→Ras
三、酪氨酸的磷酸化控制着许多胞内信号蛋白的定位与活动
Src蛋白的同源结构域
- SH1:催化
- SH2:受体,识别特异的磷酸化多肽
- 还可以与一个伴侣蛋白相结合(一些酶)
- 这样使得这些蛋白能够依靠SH2二锚定在一些位点:特异磷酸化酪氨酸的位点
- SH2这样可以与伴侣蛋白结合的结构域可以与别的蛋白组合,组合后的蛋白可以识别特异的结构(如磷酸化的酪氨酸残基),从而这些蛋白被募集到一些位点(如膜上的生长因子受体旁)
- Ras-GAP蛋白被募集到膜上,被激活后,与邻近的,锚定于膜上的Ras蛋白作用,开启下游通路
- PIP3K被募集到膜附件,磷酸化肌醇磷脂
- PLC-γ 定位于质膜附近后将膜连接磷脂PIP2切成两段,作为下游信号
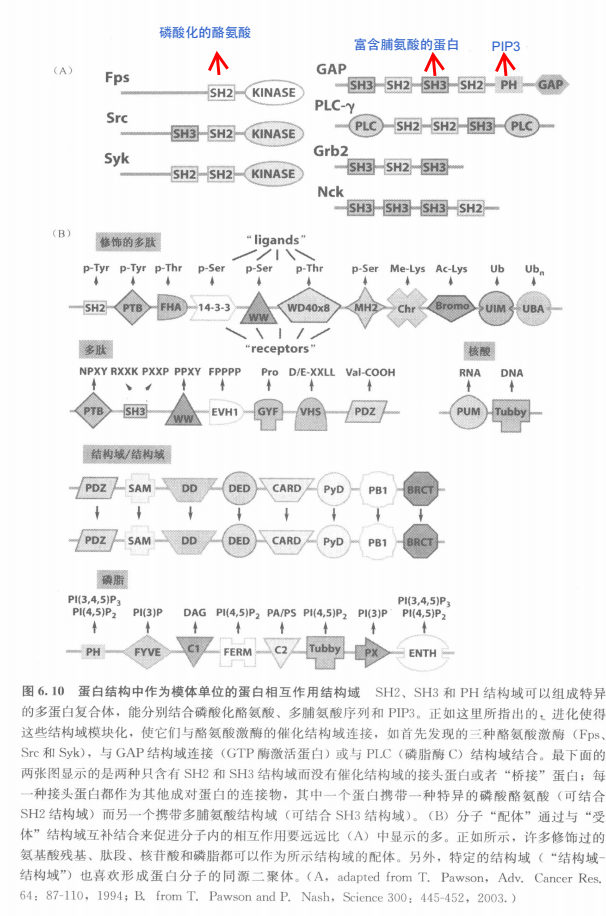
- 存在一种磷酸化酪氨酸磷酸酶PTP可以除去酪氨酸上面的磷酸,从而关闭下一步的受体激活
- 这种酶的缺乏与许多白血病有关
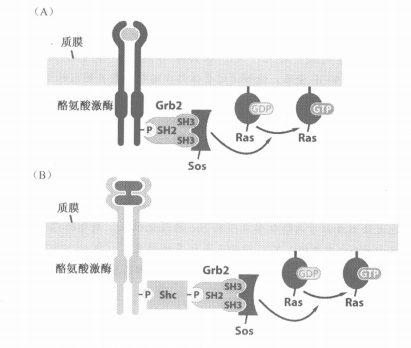
四、Ras被激活的模型
- 由Grb2分子桥接
- SH2结合受体的磷酸化酪氨酸残基
- SH3结合富含脯氨酸的Sos
- Sos进而促进Ras的GDP替换为GTP
- 另一种通路还有Shc的中介
五、Ras下游三条重要的信号通路
(1)激酶级联通路
MAPK通路
- Ras活化
- 通过效应环结合Raf
- Raf磷酸化MEK(可以磷酸化Ser/Thr、Trp,双特异激酶)
- MEK磷酸化Erk1,Erk2(胞外调控激酶)
- Erk进入核内:(直接或间接)激活转录因子,激活染色质相关蛋白
- 早期、延时早期基因表达
- 其中FOS、Jun这两种转录因子激活的早期基因产物相互结合形成高度活化二聚体转录因子AP-1

这条通路使得细胞
- 不再锚定
- 失去接触抑制
- 形态改变
黑色素瘤中Ras下游通路活化与B-Raf有关,而不是Ras
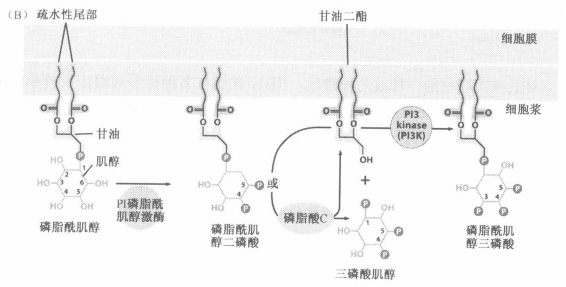
(2) 调控肌醇脂类(PIP3)和Akt/PKB激酶
- Ras通过与PI3K作用,将PIP2 磷酸化为 PIP3
- PI → PIP2 ↔ PIP3 → Akt/PKB :在膜上作用
- PIP2 → DAG(激活PKC) + IP3(第二信使:钙库释放):游离在细胞内部
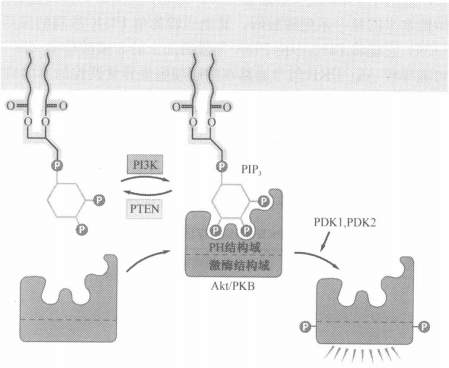
- Akt/PKB结合PIP3而激活
- PTEN可以除去PIP3的一个磷酸而使Akt/PKB脱落
- Akt/PKB的作用
- 阻止细胞启动凋亡程序
- 刺激细胞增殖
- 作用于细胞周期蛋白
- 刺激细胞生长
- 激活mTOR激酶,促进蛋白转录翻译
- 影响细胞迁移
- 细胞中的PIP3浓度受到Ras与PTEN作用的调控
-
- PI3K可以通过SH2结构域被募集至膜上生长因子受体附近,从而磷酸化膜磷脂肌醇
- PI3K还有与Ras结合的结构域和与激酶结构域
(3)通过Ras同源物Ral进行调控
- Ral的活化由Ral-GEF介导
- Ral-GEF由一个和Ras结合的口袋,结合了Ras后,Ral-GEF被激活
- Ral被激活:与细胞迁移,侵袭有关
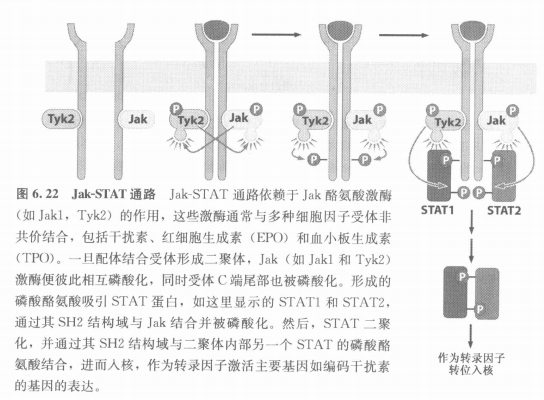
六、介导信号直接从膜传导到细胞核的Jak-STAT通路
- 干扰素INF、红细胞生成素EPO、血小板生成素TPO
- Jak非共价结合在受体上
- 活化的Jak类酶磷酸化受体尾部的酪氨酸,募集STAT
- Jak将STAT的tyr磷酸化,磷酸化后的STAT可以自身形成二聚体
- 二聚体STAT迁移入核:
- 激活myc
- 细胞周期蛋白D2、D3
- 抗凋亡蛋白
- STAT还可以不依赖于Jak及胞外信号而二聚化:
- 突变产生半胱氨酸残基导致自发二聚化
- 被Src蛋白激活,Src在肿瘤细胞中本来就是组成型激活的
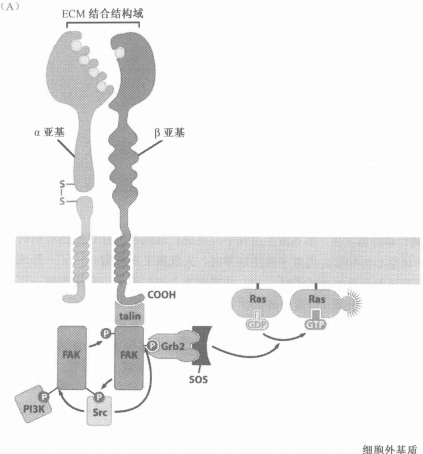
七、与生长因子受体信号趋同的细胞黏着受体信号
- 连整蛋白(integrin)在外感受胞外信号,内使FAK被磷酸化
- 募集下游蛋白:Src、 PI3K、 Grb2→Ras
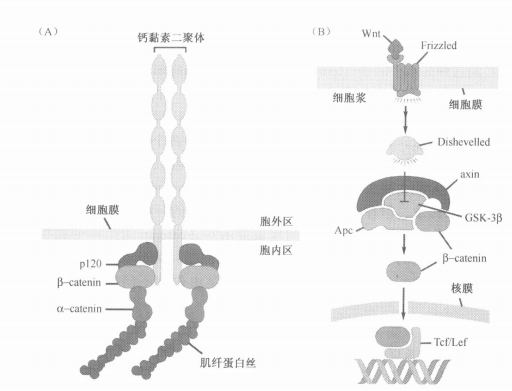
八、促进细胞增殖的Wnt-β-catenin通路
- β-catenin的三处:
- 形成E-cadherin,连接在细胞骨架上
- 存在于细胞质中
- 在细胞核中促进重要基因转录
- Wnt除了可以保护β-catenin免受降解
- 还能保护细胞周期蛋白cyclin D1免受降解
- Wnt还能作为一种强的丝裂原促进素
- 是保持细胞干性的物质
九、G蛋白藕联受体由促进细胞正常增殖和恶性增殖的双重作用
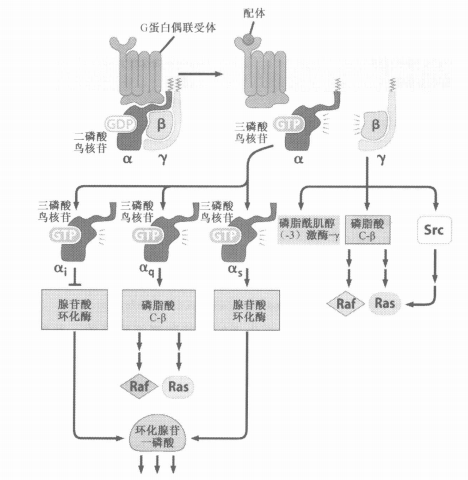
- 小细胞肺癌中G蛋白偶联受体接受自分泌的信号分子
- 一种甲状腺癌中点突变导致TSH受体不依赖胞外信号而活化
- 还有的G蛋白受体由于点突变失去了Gα亚基自身ATP酶活性
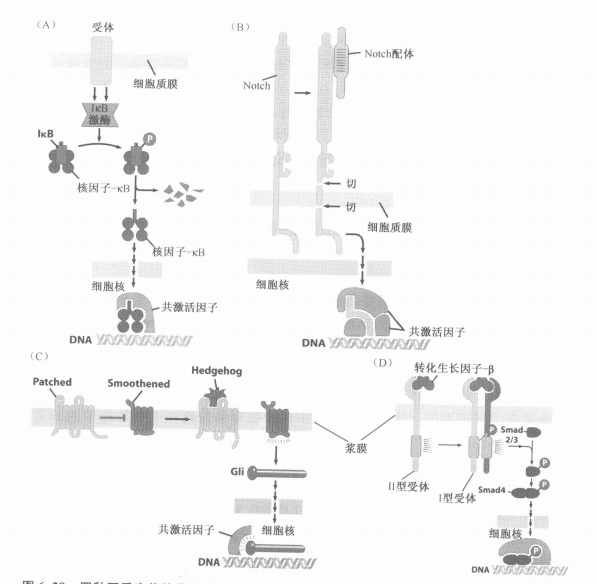
十、其他四种在细胞增殖中发挥作用的信号通路
- Nuclear Factor-κB
- Notch
- Patch
- TGF-β
posted on 2018-11-26 21:39 iojafekniewg 阅读(822) 评论(0) 收藏 举报


 浙公网安备 33010602011771号
浙公网安备 33010602011771号