ENVI下植被指数模型详解
植被指数(VI)是两个或多个波长范围内的地物反射率组合运算,以增强植被某一特性或者细节。所有的植被指数要求从高精度的多光谱或者高光谱反射率数据中计算。未经过大气校正的辐射亮度或者无量纲的DN值数据不适合计算植被指数。
目前,在科学文献中发布了超过150种植被指数模型,这些植被指数中只有极少数是经过系统的实践检验。
在ENVI中,根据对植被波谱特征产生重要影响的主要化学成份:色素(Pigments)、水分(Water)、碳(Carbon)、氮(Nitrogen),总结了7大类实用性较强的植被指数,即:宽带绿度、窄带绿度、光利用率、冠层氮、干旱或碳衰减、叶色素、冠层水分含量。这些植被指数可以简单度量绿色植被的数量和生长状况、叶绿素含量、叶子表面冠层、叶聚丛、冠层结构、植被在光合作用中对入射光的利用效率、测量植被冠层中氮的相对含量、估算纤维素和木质素干燥状态的碳含量、度量植被中与胁迫性相关的色素、植被冠层中水分含量等。
下面是7大类27种植被指数的说明,这些植被指数都是经过严格生物条件下测试的。
1宽带绿度——Broadband Greenness (5种)
宽带绿度指数可以简单度量绿色植被的数量和生长状况,它对植物的叶绿素含量、叶子表面冠层、冠层结构比较敏感,这些都是植被光合作用的主要物质,与光合有效辐射(fAPAR)也有关系。宽带绿度指数常用于植被物候发育的研究,土地利用和气候影响评估,植被生产力建模等。
宽带绿度指数选择的波段范围在可见光和近红外,一般的多光谱都包含这些波段。下面的公式中规定波段的中心波长:ρNIR = 800 nm,ρRED = 680 nm,ρBLUE = 450 nm。
- 归一化植被指数(Normalized Difference Vegetation Index——NDVI)
NDVI众所周知的一种植被指数,在LAI值很高,即植被茂密时其灵敏度会降低。其计算公式为:
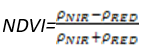 (式1)
(式1)
值的范围是-1~1,一般绿色植被区的范围是0.2~0.8。
- 比值植被指数(Simple Ratio Index——SR)
SR指数也是众所周知的一种植被指数,在LAI值很高,即植被茂密时其灵敏度会降低。其计算公式为:
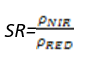 (式2)
(式2)
值的范围是0~30+,一般绿色植被区的范围是2~8。
- 增强植被指数(Enhanced Vegetation Index——EVI)
EVI通过加入蓝色波段以增强植被信号,矫正土壤背景和气溶胶散射的影响。EVI常用于LAI值高,即植被茂密区。其计算公式为:
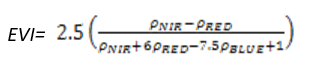 (式3)
(式3)
值的范围是-1~1,一般绿色植被区的范围是0.2~0.8。
- 大气阻抗植被指数(Atmospherically Resistant Vegetation Index——ARVI)
ARVI是NDVI的改进,它使用蓝色波段矫正大气散射的影响(如气溶胶),ARVI常用于大气气溶胶浓度很高的区域,如烟尘污染的热带地区或原始刀耕火种地区。其计算公式为:
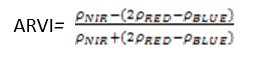 (式4)
(式4)
值的范围是-1~1,一般绿色植被区的范围是0.2~0.8。
- 绿度总和指数(Sum Green Index——SG)
SG指数是用于探测绿色植被变化最简单的植被指数。由于在可见光范围内,绿色植被对光强吸收,SG指数对稀疏植被的小变化非常敏感。SG指数是500 nm ~600 nm范围内平均波谱反射率。
总和最后会被转化回反射率。值的范围是0~50+,一般植被区域是10~25。
2窄带绿度——Narrowband Greenness (7种)
窄带绿度指数对叶绿素含量、叶子表面冠层、叶聚丛、冠层结构非常敏感。它使用了红色与近红外区域部分——红边,红边是介于690 nm ~ 740 nm之间区域,包括吸收与散射。它比宽带绿度指数更加灵敏,特别是对于茂密植被。
- 红边归一化植被指数(Red Edge Normalized Difference Vegetation Index——NDVI 705)
NDVI 705是NDVI的改进型,它对叶冠层的微小变化、林窗片断和衰老非常灵敏。它可用于精细农业、森林监测、植被胁迫性探测等。其计算公式为[7] [8]:
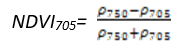 (式5)
(式5)
值的范围是-1~1,一般绿色植被区的范围是0.2~0.9。
- 改进红边比值植被指数(Modified Red Edge Simple Ratio Index——mSR 705)
mSR 705改正了叶片的镜面反射效应,可它可用于精细农业、森林监测、植被胁迫性探测等。其计算公式为[6]:
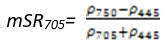 (式6)
(式6)
值的范围是0~30,一般绿色植被区的范围是2~8。
- 改进红边归一化植被指数(Modified Red Edge Normalized Difference Vegetation Index——mNDVI 705)
mNDVI 705是NDVI 705的改进型,它考虑了叶片的镜面反射效应。它对叶冠层的微小变化、林窗片断和衰老非常灵敏。它可用于精细农业、森林监测、植被胁迫性探测等。
其计算公式为:
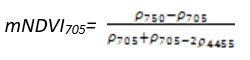 (式7)
(式7)
值的范围是-1~1,一般绿色植被区的范围是0.2~0.7。
- Vogelmann 红边指数1(Vogelmann Red Edge Index 1——VOG1)
VOG1指数对叶绿素浓度、叶冠层和水分含量的综合非常敏感。它可应用于植物物候变化研究、精细农业和植被生产力建模。其计算公式为:
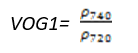 (式8)
(式8)
值的范围是0~20,一般绿色植被区的范围是4~8。
- Vogelmann 红边指数2(Vogelmann Red Edge Index 2——VOG2)
VOG2指数对叶绿素浓度、叶冠层和水分含量的综合非常敏感。它可应用于植物物候变化研究、精细农业和植被生产力建模。其计算公式为:
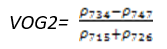 (式9)
(式9)
值的范围是0~20,一般绿色植被区的范围是4~8。
- Vogelmann 红边指数3(Vogelmann Red Edge Index 3——VOG3)
VOG3指数对叶绿素浓度、叶冠层和水分含量的综合非常敏感。它可应用于植物物候变化研究、精细农业和植被生产力建模。其计算公式为:
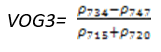 (式10)
(式10)
值的范围是0~20,一般绿色植被区的范围是4~8。
- 红边位置指数(Red Edge Position Index——REP)
REP指数对植被叶绿素浓度变化、叶绿素浓度增加使得吸收特征变宽及红边向长波段方向移动非常敏感。红边位置在690 nm ~ 740 nm范围内急剧倾斜波长范围,一般植被在700nm~730nm。
REP指数的结果输出是在0.69微米~0.74微米光谱范围内,植被红边区域内的反射率的最大导数的波长。常用于农作物监测和估产,生态系统干扰探测,光合作用模型,和由气候或其他因素产生的冠层胁迫性。
3光利用率——Light Use Efficiency (3种)
光利用率指数是用来度量植被在光合作用中对入射光的利用效率。光的利用效率直接与碳吸收效率、植被生长速度和光合有效辐射(fAPAR)有很大的关系。
- 光化学植被指数(Photochemical Reflectance Index——PRI)
PRI对活植物的类胡萝卜素(尤其黄色色素)变化非常敏感,类胡萝卜素可标识光合作用光的利用率,或者碳吸收效率。可用于研究植被生产力和胁迫性,常绿灌木植被的健康,森林以及农作物的衰老。其计算公式为:
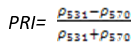 (式11)
(式11)
值的范围是-1~1,一般绿色植被区的范围是-0.2~0.2。
- 结构不敏感色素指数(Structure Insensitive Pigment Index——SIPI)
SIPI用来最大限度地提高类胡萝卜素(例如α-胡萝卜素和β-胡萝卜素)与叶绿素比率在冠层结构(如叶面积指数)减少时的敏感度,SIPI的增加标识冠层胁迫性的增加。可用于植被健康监测、植物生理胁迫性检测和作物生产和产量分析。其计算公式为:
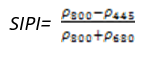 (式12)
(式12)
值的范围是0~2,一般绿色植被区的范围是0.8~1.8。
- 红绿比值指数(Red Green Ratio Index——RG)
RG比值指数指示由于花青素代替叶绿素而引起叶片变红的相关表达式。可估算植被冠层发展过程,它还是叶片生产力与胁迫性的指示器,甚至可标识一些冠层的开花。应用于植物生长周期(物候)研究,冠层胁迫性检测和作物估产。
RG比值指数结果输出是红色范围内所有波段均值除以与绿色范围内所有波段均值。值的范围是0.1~8,一般绿色植被区的范围是0.7~3。
3.4冠层氮——Canopy Nitrogen (1种)
冠层氮指数提供一种用遥感度量氮浓度的方法。氮是叶绿素的重要组成部分,具有高浓度氮的植被生长速度较快,冠层氮指数使用短波红外测量植被冠层中氮的相对含量。
归一化氮指数(Normalized Difference Nitrogen Index——NDNI)
NDNI是用于估算植被冠层中氮的相对含量。在1510nm的反射率主要取决于叶片氮的含量,以及冠层总体叶生物量。结合叶片氮含量和冠层叶生物量在1520nm范围内预测叶片氮的含量,在1680nm波长范围作为参考反射率,冠层叶生物量这个波长范围具有与1520nm波长范围类似的反射特性,而且1680nm波长范围内没有氮吸收影响。NDNI在植被还是绿色以及覆盖浓密时候,对氮含量的变化非常敏感,它用于精细农业、生态系统分析和森林管理。其计算公式为:
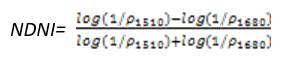 (式13)
(式13)
值的范围是0~1,一般绿色植被区的范围是0.02~0.1。
3.5干旱或碳衰减——Dry or Senescent Carbon (3种)
干旱或碳衰减指数是用来估算纤维素和木质素干燥状态的碳含量。干碳分子大量存在于木质材料和衰老、死亡、或休眠的植被,可以使用这些指数可以做植被着火性分析和检测森林的枯枝落叶层。干旱或碳衰减指数是基于纤维素和木质素在短波红外波段吸收特性而计算。
- 归一化木质素指数(Normalized Difference Lignin Index——NDLI)
NDLI是用来估算植被冠层木质素的相对含量,应用生态系统分析和检测森林的枯枝落叶层。其计算公式为:
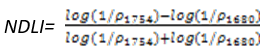 (式14)
(式14)
值的范围是0~1,一般绿色植被区的范围是0.005~0.05。
- 纤维素吸收指数(Cellulose Absorption Index——CAI)
CAI可以指示地表含有干燥植被,纤维素在2000 nm~ 2200 nm范围内吸收特征非常敏感。应用于农作物残留监测,植物冠层衰老,生态系统中的着火条件和放牧管理。其计算公式为:
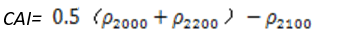 (式15)
(式15)
值的范围是-3~4+,一般绿色植被区的范围是-2~4。
- 植被衰减指数(Plant Senescence Reflectance Index——PSRI)
PSRI用来最大限度地提高类胡萝卜素(例如α-胡萝卜素和β-胡萝卜素)与叶绿素比率的灵敏度,PSRI的增加预示冠层胁迫性的增加、植被衰老的开始和植物果实的成熟。可用于植被健康监测、植物生理胁迫性检测和作物生产和产量分析。其计算公式为:
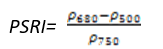 (式16)
(式16)
值的范围是-1~1,一般绿色植被区的范围是-0.1~0.2。
3.6叶色素——Leaf Pigments (4种)
叶色素指数用于度量植被中与胁迫性相关的色素。胁迫性相关的色素包括类胡萝卜素和花青素,这些色素大量存在衰减植被中,这些指数不能度量叶绿素。叶色素指数应用于农作物监测、生态系统研究、冠层胁迫性分析和精细农业。叶色素指数要求反射率数据范围在0~1。
- 类胡萝卜素反射指数1(Carotenoid Reflectance Index 1——CRI1)
CRI1对叶片中的类胡萝卜素非常敏感,高的CRI1值意味类胡萝卜素含量相比叶绿素含量多。其计算公式为:
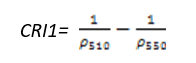 (式17)
(式17)
值的范围是0~15+,一般绿色植被区的范围是1~12。
- 类胡萝卜素反射指数2(Carotenoid Reflectance Index 2——CRI2)
CRI2是CRI1的改进型,在类胡萝卜素浓度高时更加有效,高的CRI2值意味类胡萝卜素含量相比叶绿素含量多。其计算公式为:
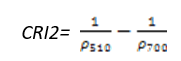 (式18)
(式18)
值的范围是0~15+,一般绿色植被区的范围是1~11。
- 花青素反射指数1(Anthocyanin Reflectance Index 1——ARI1)
ARI1对叶片中的花青素非常敏感,ARI1值越大表明植被冠层增长或者死亡。其计算公式为:
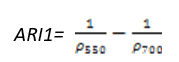 (式19)
(式19)
值的范围是0~0.2+,一般绿色植被区的范围是0.001~0.1。
- 花青素反射指数2(Anthocyanin Reflectance Index 2——ARI2)
ARI2对叶片中的花青素非常敏感,ARI2值越大表明植被冠层增长或者死亡。ARI2 是ARI1的改进,当花青素浓度高时更加有效。其计算公式为:
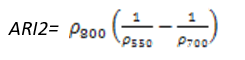 (式20)
(式20)
值的范围是0~0.2+,一般绿色植被区的范围是0.001~0.1。
3.7冠层水分含量——Canopy Water Content (4种)
冠层水分含量指数用于度量植被冠层中水分含量。水分含量是一个重要的植物指标,较高的水含量表明健康植被、生长快及不易着火。冠层水分含量指数基于水在近红外和短波红外范围内的吸收特征,以及光在近红外范围的穿透性,综合起来度量总的水柱含量。
- 水波段指数(Water Band Index——WBI)
WBI对冠层水分状态的变化非常敏感,随着植被冠层水分的增加,970nm附近吸收强度相比900nm处有所增强。应用包括冠层胁迫性分析,生产力预测与建模,着火威胁条件分析,农作物管理,以及生态系统生理机能研究。其计算公式为:
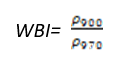 (式21)
(式21)
一般绿色植被区的范围是0.8~1.2。
- 归一化水指数(Normalized Difference Water Index——NDWI)
NDWI对冠层水分含量的变化非常敏感,因为在857 nm 和 1241 nm具有相似的反射率,但是又不同于液态水的吸收特性。应用于冠层胁迫性分析,在浓密叶型植被的叶面积指数的研究,植被生产力模型,着火性研究。其计算公式为:
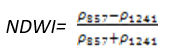 (式22)
(式22)
值的范围是-1~1,一般绿色植被区的范围是-0.1~0.4。
- 水分胁迫指数(Moisture Stress Index——MSI)
MSI对叶片水分含量的增加非常敏感。当叶片水分含量的增加,在1599nm处的吸收强度也增加,而在819nm处的吸收强度没有影响。应用于冠层胁迫性分析,生产力预测与建模,着火威胁条件分析,以及生态系统生理机能研究。与其他水指数相反,MSI值越大,水分胁迫性越严重和水分含量越少。其计算公式为:
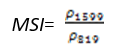 (式23)
(式23)
值的范围是0~3+,一般绿色植被区的范围是0.4~2。
- 归一化红外指数(Normalized Difference Infrared Index——NDII)
NDII对农作物冠层的水分含量变化非常敏感,NDII的值越大表示水分含量越多。应用于农作物管理,森林冠层监测,植被胁迫性探测。其计算公式为:
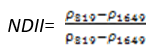 (式24)
(式24)
值的范围是-1~1,一般绿色植被区的范围是0.02~0.6。
References
Ceccato, P., S. Flasse, S. Tarantola, S. Jacquemoud, and J.M. Gregoire, 2001. Detecting Vegetation Leaf Water Content Using Reflectance in the Optical Domain. Remote Sensing of Environment 77:22-33.
Champagne, C., E. Pattey, A. Bannari, and I.B. Stratchan, 2001. Mapping Crop Water Status: Issues of Scale in the Detection of Crop Water Stress Using Hyperspectral Indices. Proceedings of the 8th International Symposium on Physical Measurements and Signatures in Remote Sensing, Aussois, France. Pp.79-84.
Datt, B., 1999. A New Reflectance Index for Remote Sensing of Chlorophyll Content in Higher Plants: Tests Using Eucalyptus Leaves. Journal of Plant Physiology 154:30-36.
Daughtry, C.S.T., 2001. Discriminating Crop Residues from Soil by Short-Wave Infrared Reflectance. Agronomy Journal 93:125-131.
Daughtry, C.S.T., E.R. Hunt Jr., and J.E. McMurtrey III. 2004. Assessing Crop Residue Cover Using Shortwave Infrared Reflectance. Remote Sensing of Environment 90:126-134.
Fourty, T., F. Baret, S. Jacquemoud, G. Schmuck, and J. Verdebout, 1996. Leaf Optical Properties with Explicit Description of Its Biochemical Composition: Direct and Inverse Problems. Remote Sensing of Environment 56:104-117.
Gamon, J.A. and J.S. Surfus, 1999. Assessing Leaf Pigment Content and Activity With a Reflectometer. New Phytologist 143:105-117.
Gamon, J.A., J. Penuelas, and C.B. Field, 1992. A Narrow-Waveband Spectral Index That Tracks Diurnal Changes in Photosynthetic Efficiency. Remote Sensing of Environment 41:35-44.
Gamon, J.A., L. Serrano, and J.S. Surfus, 1997. The Photochemical Reflectance Index: An Optical Indicator of Photosynthetic Radiation Use Efficiency Across Species, Functional Types and Nutrient Levels. Oecologia 112:492-501.
Gao, B.C., 1995. Normalized Difference Water Index for Remote Sensing of Vegetation Liquid Water from Space. Proceedings of SPIE 2480: 225-236.
Gitelson, A.A. and M.N. Merzlyak, 1994. Spectral Reflectance Changes Associated with Autumn Senescence of Aesculus Hippocastanum L. and Acer Platanoides L. Leaves. Spectral Features and Relation to Chlorophyll Estimation. Journal of Plant Physiology 143:286-292.
Gitelson, A.A., M.N. Merzlyak, and O.B. Chivkunova, 2001. Optical Properties and Nondestructive Estimation of Anthocyanin Content in Plant Leaves. Photochemistry and Photobiology 71:38-45.
Gitelson, A.A., Y. Zur, O.B. Chivkunova, and M.N. Merzlyak, 2002. Assessing Carotenoid Content in Plant Leaves with Reflectance Spectroscopy. Photochemistry and Photobiology 75:272-281.
Hardisky, M.A., V. Klemas, and R.M. Smart, 1983. The Influences of Soil Salinity, Growth Form, and Leaf Moisture on the Spectral Reflectance of Spartina Alterniflora Canopies. Photogrammetric Engineering and Remote Sensing 49:77-83.
Huete, A.R., H. Liu, K. Batchily, and W. van Leeuwen, 1997. A Comparison of Vegetation Indices Over a Global Set of TM Images for EOS-MODIS. Remote Sensing of Environment 59(3):440-451.
Hunt Jr., E.R. and B.N. Rock, 1989. Detection of Changes in Leaf Water Content Using Near- And Middle-Infrared Reflectances. Remote Sensing of Environment 30:43-54.
Jackson, R.D., P.N. Slater, and P.J. Pinter, 1983. Discrimination of Growth and Water Stress in Wheat by Various Vegetation Indices Through Clear and Turbid Atmospheres. Remote Sensing of the Environment 15:187-208.
Jackson, T.L., D. Chen, M. Cosh, F. Li, M. Anderson, C. Walthall, P. Doriaswamy, and E.R. Hunt, 2004. Vegetation Water Content Mapping Using Landsat Data Derived Normalized Difference Water Index for Corn and Soybeans. Remote Sensing of Environment 92:475-482.
Kaufman, Y.J. and D. Tanre, 1996. Strategy for Direct and Indirect Methods for Correcting the Aerosol Effect on Remote Sensing: from AVHRR to EOS-MODIS. Remote Sensing of Environment 55:65-79.
Melillo, J.M., J.D. Aber, and J.F. Muratore, 1982. Nitrogen and Lignin Control of Hardwood Leaf Litter Decomposition Dynamics. Ecology 63:621-626.
Merzlyak, J.R., A.A. Gitelson, O.B. Chivkunova, and V.Y. Rakitin, 1999. Non-destructive Optical Detection of Pigment Changes During Leaf Senescence and Fruit Ripening. Physiologia Plantarum 106:135-141.
Penuelas, J., F. Baret, and I. Filella, 1995. Semi-Empirical Indices to Assess Carotenoids/Chlorophyll-a Ratio from Leaf Spectral Reflectance. Photosynthetica 31:221-230.
Penuelas, J., I. Filella, C. Biel, L. Serrano, and R. Save, 1995. The Reflectance at the 950-970 Region as an Indicator of Plant Water Status. International Journal of Remote Sensing 14:1887-1905.
Rouse, J.W., R.H. Haas, J.A. Schell, and D.W. Deering, 1973. Monitoring Vegetation Systems in the Great Plains with ERTS. Third ERTS Symposium, NASA SP-351 I: 309-317.
Sellers, P.J., 1985. Canopy Reflectance, Photosynthesis and Transpiration. International Journal of Remote Sensing 6:1335-1372.
Serrano, L., J. Penuelas, and S.L. Ustin, 2002. Remote Sensing of Nitrogen and Lignin in Mediterranean Vegetation from AVIRIS Data: Decomposing Biochemical from Structural Signals. Remote Sensing of Environment 81:355-364.
Sims, D.A. and J.A. Gamon, 2002. Relationships Between Leaf Pigment Content and Spectral Reflectance Across a Wide Range of Species, Leaf Structures and Developmental Stages. Remote Sensing of Environment 81:337-354.
Tucker, C.J., 1979. Red and Photographic Infrared Linear Combinations for Monitoring Vegetation. Remote Sensing of the Environment 8:127-150.
Vogelmann, J.E., B.N. Rock, and D.M. Moss, 1993. Red Edge Spectral Measurements from Sugar Maple Leaves. International Journal of Remote Sensing 14:1563-1575.


