单细胞测序 doublet 二聚体
Doublets及其形成的原因
单细胞测序期望每个 barcode 标签下只有一个真实的细胞,但是实际数据中会有两个或多个细胞共用一个 barcode 的情况,业内称之为 doublets 或 multiplets(后面统称为 doublets)。Doublets 形成的原因主要是高通量单细胞测序一般使用液滴微流控(droplet microfluidic)或纳米孔(nanowell)技术,细胞被液滴或纳米孔捕获的概率遵循泊松分布规律,doublets 填充液滴的概率会随着输入细胞浓度升高而增加。此外,使用磁珠分选细胞,操作不当也会增加 doublets 形成的概率。
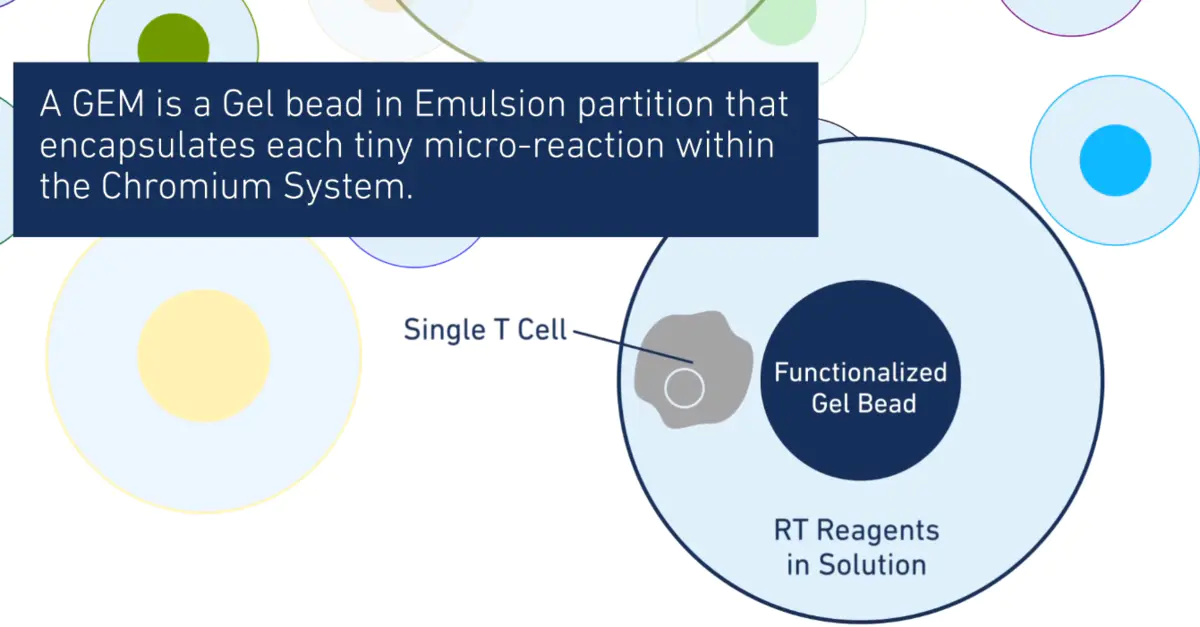
一般而言,每个GEMs(Gel Bead in emulsion)会形成如上图一般的结构,即一个细胞一个gel beads。但有时候也会出现一个GEM里有0或多个细胞(empty droplet or doublet),对于这种GEMs则需要通过我们在后续分析中识别出来并进行排除。
针对现有几种检测单细胞测序doublet的工具的评估文章,系统比较了常见的例如Scrublet、DoubletFinder等工具在检测准确性、计算效率等方面的优劣,以及比较了使用不同方法去除doublet后对下游DE分析、轨迹分析的影响。
现有的检测方法,基本都会先构造出虚拟doublet,然后将候选droplet与这些虚拟doublet比较,很相似的那些就定义为doublet。这里的虚拟doublet是通过随机组合两个(类)细胞的表达值得到的虚拟的doublet,可以作为检测时的参照。
在现有的9种方法中(Scrublet、doubletCells、cxds、bcds、Hybrid、DoubletDetection、DoubletFinder、Solo、DoubletDecon),文章的结论是DoubletFinder的准确率最高。
单细胞实验的输入材料通常是生物组织样品。
第一步,单细胞解离:消化组织产生单细胞悬液。为了分别分析每个细胞中的mRNA,必须分离单细胞。根据实验方案不同,单细胞分离的方式也有所不同。
基于平板的技术将细胞分到到板上的孔中。
基于液滴的方法则依赖于微流体液滴捕获单个细胞。
在这两种情况下,都可能出现一些问题,如多个细胞一起被捕获(doublets or multiplets)、非活细胞被捕获或根本没有细胞被捕获(空液滴/孔)。基于液滴的方法需要通过低的输入细胞浓度来保持低的doublets率,因此空液滴是特别常见的 (生信宝典注:一般beads和细胞的输入比例是20:1)。
每个孔或液滴均包含必要的试剂以裂解细胞膜并进行文库构建 (生信宝典注:植物单细胞就要注意了,需要提前去除细胞壁)。文库构建包括捕获细胞内mRNA、反转录为cDNA分子并进行扩增等过程。因为文库构建时每个细胞是独立的,所以每个细胞的mRNA也就特异的标记了孔特异性或液滴特异性细胞barcode。此外,许多实验方案还使用唯一分子标识符(UMI)标记捕获的RNA分子。一般在测序之前需要先扩增细胞cDNA以增加其被检测的可能性。但微量扩增更容易引入PCR偏好性。UMI使我们能够区分测到的reads是来源于mRNA分子的不同扩增拷贝还是来源于独立的mRNA分子,从而可以进行更准确的定量。
每个细胞单独构建的cDNA文库都带有cell barcode和/或UMI(取决于protocol),后续将这些文库混合在一起测序。测序产生的reads数据进行质量控制 ,根据其barcodes序列分组(demultiplexing),并且进行后续比对定量。对基于UMI的protocols,reads的数据可以进一步demultiplexed以得到捕获的mRNA分子的计数(count data)。也就是本套流程的起始输入数据。
REF
http://wap.sciencenet.cn/blog-118204-1220240.html?mobile=1
https://cloud.tencent.com/developer/article/1825672 (示例代码)
https://www.jianshu.com/p/ef88433709bd
https://blog.csdn.net/qq_38774801/article/details/112006700
https://blog.csdn.net/weixin_40561293/article/details/108962352


 浙公网安备 33010602011771号
浙公网安备 33010602011771号