四个量子数
像电子这样的微观粒子,要描述其运动状态,需要使用波函数,而这个波函数是通过求解薛定谔方程得到的。
每个波函数都会涉及到一些量子数,如果只考虑电子的轨道运动,引入3个量子数就够用了
即:n (主量子数), l(角量子数),m(磁量子数)
如果要考虑电子的自旋运动,还要使用电子的自旋波函数,还要额外引入电子的自旋量子数ms
主量子数 n
n=1,2,3,4,5,6......正整数
对应K,L,M,N,O,P....电子层
n是决定轨道(或电子)能量的主要量子数
n越大,电子离核平均距离越远,能量越高。
角量子数 l (也称副量子数) 决定电子角动量的大小
l=0,1,2,3,4,5......(n-1)
对应着s,p,d,f,g....电子亚层
l受n限制
n=1时,l=0; 1s亚层
n=2时,l=0,1; 对应2s,2p亚层
n=3时,l=0,1,2; 对应3s,3p,3d亚层
n=4时,l=0,1,2,3; 对应4s,4p,4d,4f亚层.
磁量子数m(决定角动量在Z轴投影的大小)
m=0,±1,±2,±3.......±l;
m决定原子轨道在核外的空间取向
l=0,m=0; s型轨道,只一个取向
l=1,m=0,±1;代表pz,px,py3个轨道
l=2,m=0,±1,±2;代表d亚层有dz2,dxz,dyz,dxy,dx2-y2 5个取向的轨道

自旋 量子数
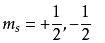
Ψn,l,m------------原子的单电子波函数,又称原子轨道波函数
例: n=1,l=0,m=0
Ψ1,0,0=Ψ1s, 即1s轨道;
Ψ2,0,0=Ψ2s, 即2s轨道;
Ψ2,1,0=Ψ2pz, 即2pz轨道;
Ψ3,2,0=Ψ3dz2, 即3dz2轨道。


