01-3 动力学基础:Arrhenius定律
Arrhenius定律
引子
上节在质量作用定律中化学反应速率公式有提到k,也就是化学反应速率系数,这节主要来研究k,k通过阿伦乌尼斯公式进行定义。
定义

活化能
- 定义:使普通分子(平均能量)变为活化分子所需的能量
- 不同的反应,活化能不同
- 活化能越低,达到该水平的活化分子越多,反应速率越大
- 普通化学反应的活化能在40~400kJ/mol 范围内,E>400kJ/mol可以认为不起反应
麦克斯韦尔-波尔兹曼分子能量分布定律
- 定义:动能超过活化能的分子在分子总数中的份额,根据速度分布计算,近似等于exp(-E/RT)
频率因子
从分子运动论来说,\(k_0\)是反应物质分子碰撞总次数的特性,分子碰撞总次数和分子运动速度成正比,而速度正比于\(T^{0.5}\),因此\(k_0\infty const·T^{0.5}\),但是从实验数据来看,通常把总包反应的\(k_0\)视作一定范围内的常数。
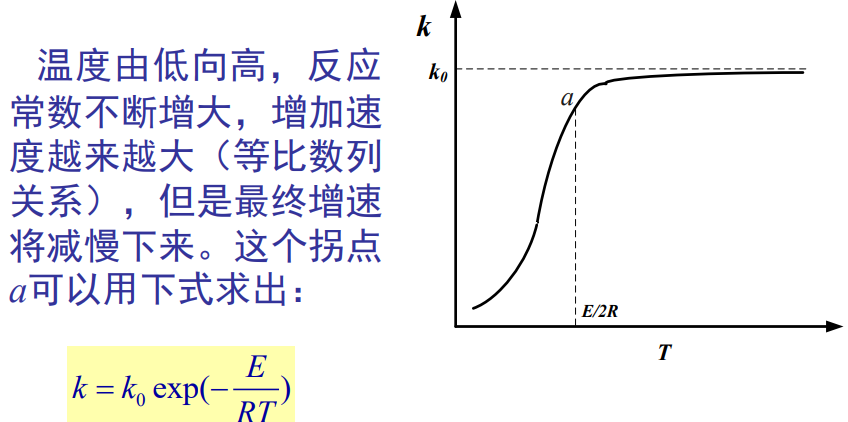
反应常数和T的变化关系



 浙公网安备 33010602011771号
浙公网安备 33010602011771号