寒假笔记本6:单盐
观前提示:
- 本文所指的强酸主要指高锰酸、盐酸(氢氯酸)、硫酸、硝酸、高氯酸、硒酸、氢溴酸、氢碘酸、氯酸
- 本文所指的强碱主要指钠钾铷铯钫、钙锶钡镭等的氢氧化物
- “_酸_碱”描述的是这个盐里面阴离子和阳离子的强与弱
盐分为单盐和合盐,单盐分为正盐、酸式盐、碱式盐。
\(\rm Part\ I.\ 正盐\)
正盐就是在酸跟碱完全中和生成的盐中,不会有酸中的氢离子,也不会有碱中的氢氧根离子,只有金属阳离子和酸根离子的盐。,简单的说,就是既不含能电离的氢离子,又不含氢氧根离子的盐。
例如:
\[\rm HCl + NaOH\xlongequal{\ \ \ \ \ \ \ \ }\color{blue}{NaCl}+H_2O \\
\rm H_2SO_4+Cu(OH)_2 \xlongequal{\ \ \ \ \ \ \ \ } \color{blue}{CuSO_4}+2H_2O \\
\rm H_2SO_4+2NaOH\xlongequal{\ \ \ \ \ \ \ \ }\color{blue}{Na_2SO_4}+2H_2O \\
\]
正盐分为如下几类:
- 强酸强碱盐
这一类盐不发生水解,代表有氯化钠\(\rm NaCl\),硫酸钠\(\rm Na_2SO_4\),硝酸钾\(\rm KNO_3\)等。 - 强酸弱碱盐
这一类盐的金属离子在水解时金属(或铵根)离子会消耗一部分氢氧根离子,溶液呈现出弱酸性。代表有硫酸铜\(\rm CuSO_4\),氯化铁\(\rm FeCl_3\),氯化铵\(\rm NH_4Cl\),氯化铝\(\rm AlCl_3\),硫酸铁\(\rm Fe_2(SO_4)_3\)等。 - 强碱弱酸盐
这一类盐在电离时绝大部分呈现出碱性,当然,亚硫酸氢钠\(\rm NaHSO_3\)除外,它呈现出酸性。
代表物质:碳酸钠\(\rm Na_2CO_3\),磷酸钠\(\rm Na_3PO_4\)等。 - 弱酸弱碱盐
代表:碳酸铵\(\rm (NH_4)_2CO_3\),硫化铜\(\rm CuS\)。
\(\rm Part\ II.\ 酸式盐\)
酸式盐主要指阴离子中含有水中可电离的氢离子的盐。它们的酸根要么是强酸、中强酸根,要么是“某H酸”根。
产生方法主要是两种:
- 多元弱酸与少量碱反应,如:\(\rm H_2S+NaOH\xlongequal{\ \ \ \ \ \ \ \ }NaHS+H_2O\)。如果碱的量较大会生成正盐。
- 弱酸正盐与对应的弱酸反应。通入相应的气体或加入过量相应的酸可以把正盐全部转化为酸式盐,这是制取酸式盐的最佳方法。如:\(\rm CaCO_3+H_2O+CO_2\xlongequal{\ \ \ \ \ \ \ \ }Ca(HCO_3)_2\).
酸式盐都可以与碱反应,抱歉也可以与酸反应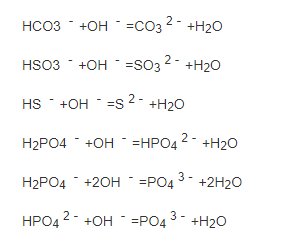
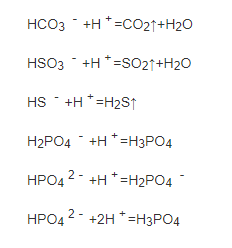
\(\rm Part\ III.\ 碱式盐\)
碱式盐的定义是电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子(或铵根离子)的盐,或者说是是含有羟基或氧基的盐。一般的构成是\(\rm Metal\ +\ OH^-\ +\ acid^{-x}\)(金属+氢氧根+酸根),例如碱式碳酸铜\(\rm Cu_2(OH)_2CO_3\),羟基磷灰石\(\rm Ca_5(PO_4)_3·(OH)\)等。
产生条件三选一:
- \(\rm IV\ A\ or\ V\ A\)族的低价金属离子的盐和\(\rm II\ B\)族的盐水解,如:
\[\rm SbCl_3+H_2O\xlongequal{\ \ \ \ \ \ \ \ }SbOCl\downarrow+2HCl \\ \rm ZnCl_2+H_2O\xlongequal{\ \ \ \ \ \ \ \ }Zn(OH)Cl+HCl
\]
实验室制备的时候必须加上相应的酸抑制水解。
2. 含结晶的水合物热分解,如:\(\rm ZnCl_2·H_2O\xlongequal[\ \ \ \ \ \ \ \ ]{高温}Zn(OH)Cl+HCl\)
3. 两性氧化物和其他物质反应,如:\(\rm 2ZnO+H_2O+CO_2\xlongequal{\ \ \ \ \ \ \ \ }Zn_2(OH)_2CO_3\)


 浙公网安备 33010602011771号
浙公网安备 33010602011771号