SDTM - DM
是人类临床试验受试者的父域
假设:
1. 不同公司用不同方法区分Site和Sponsor。但CDISC标准推荐必须收集SITEID,INVNAM和INVID是permissible。
2. 在一个实验中,SUBJID用来唯一区分一个人;如果一个人参加多个试验,USUBJID用来唯一区分一个人。注意是识别一个人,而不是一条记录。
DM要求每个受试者一条记录。

3. 注意个人信息的收集要符合法规指导,像BRTHDTC。
4.1 ARMCD ACTARMCD都是来自TA的ARMCD ACTARMCD(例外:如果是多阶段治疗且受试者没完成所有阶段治疗,可以和TA不一致)。如果ARMCD ACTARMCD为空,则需要ARMNRS需要说明为空原因。
对于多阶段治疗,推荐ARM ACTARM是由反映出指定的各阶段治疗(顺序和内容)。
4.2. ARMCD ACTARMCD不相同,没必要ARMNRS;
4.3. 如果ARMNRS是Unpanned trt,则ACTARMUD应该加以描述
5. SDTM和SUPP--不允许包含任何population变量。
6. RACE相关信息:MULTIPLE,或OTHER,这两种详细信息在SUPP--说明。或UNKNOWN(受试者不提供)
7. RFSTDTC, RFENDTC, RFXSTDTC, RFXENDTC, RFICDTC, RFPENDTC, and BRTHDTC是qualifier变量,而不是Timing变量。因为这些时间不是记录收集时间。
DM中只被允许的identifier/timing/qualifier变量,VISITNUM, VISIT, VISITDY. The Record Qualifier DMXFN(External File Name)是唯一允许添加变量
8. RFSTDTC用来计算DY。如果试验不设计服药,或者随机化和治疗间间隔很大,则重新选个参考时点。
RFSTDTC为空对于"SCREEN FAILURE" "NOT ASSIGNED" "NOT TREATED"
9. RFSTDTC and RFENDTC通常由sponsor定义,如果有清洗期,或医疗程序,像活检验。RFSTDTC可能是RFICDTC,而不是参考服药时间。
RFXSTDTC 和 RFXENDTC是服药开始结束时间。和SE中treatment元素开始结束时间一致。
RFICDTC and RFPENDTC,签知情同意时间(如果签多次,使用第一次的)和最后一次参与试验活动时间(组最后一次记录数据的时间)。如果试验不涉及服药,则可能和RFSTDTC RFENDTC相同
具体存入方法:
补充:
1.


如果sponsor决定把一些值map到另外一些值。
2.
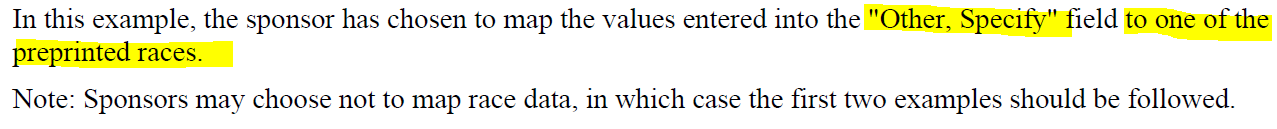
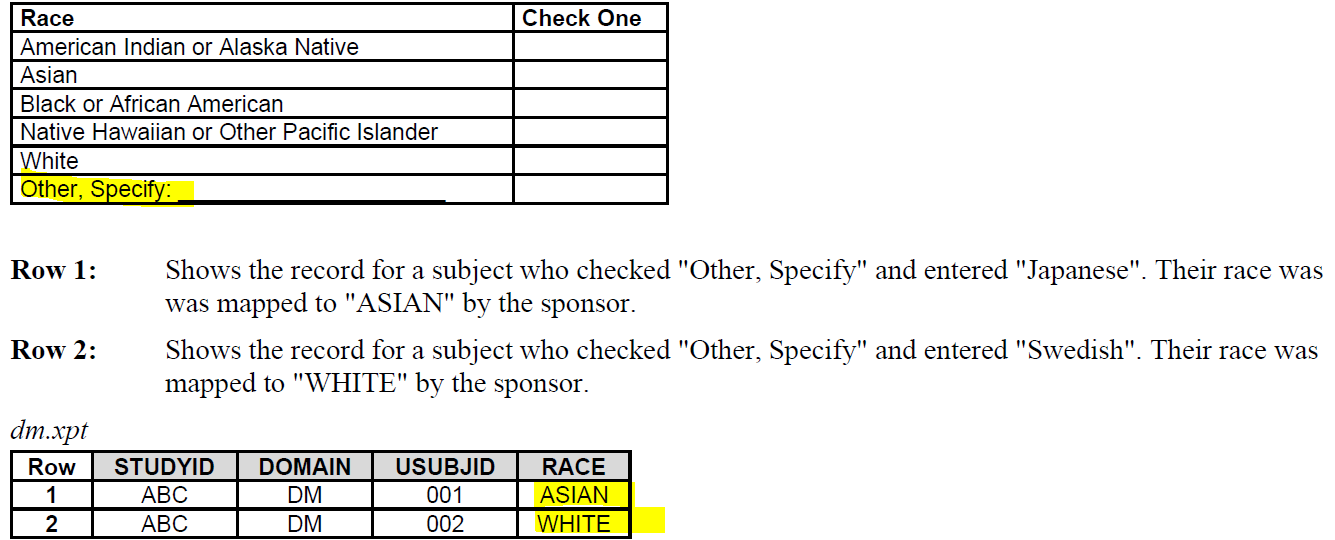

把other的具体值map到CT的那些值。
本文来自博客园,作者:Iving,转载请注明原文链接:https://www.cnblogs.com/SAS-T/p/16889579.html


 浙公网安备 33010602011771号
浙公网安备 33010602011771号