SDTM IG --- Base
1. Controlled Term, Codelist or Format


就是对值的一些要求
2. 只递交CRF实际收集的数据,要求ADaM的source是SDTM,如果没有对应的SDTM,则不允许adam。
3. Required 和 Expected变量是必须存在的,前者要求不能有任何空值,后者可以存在空值。
4. Sponsor自定义的变量可以放SUPP中
5. 如果study包括permissible变量,即使全为空,也要放到SDTM数据集中。如果不涉及permissible变量,则不需要。
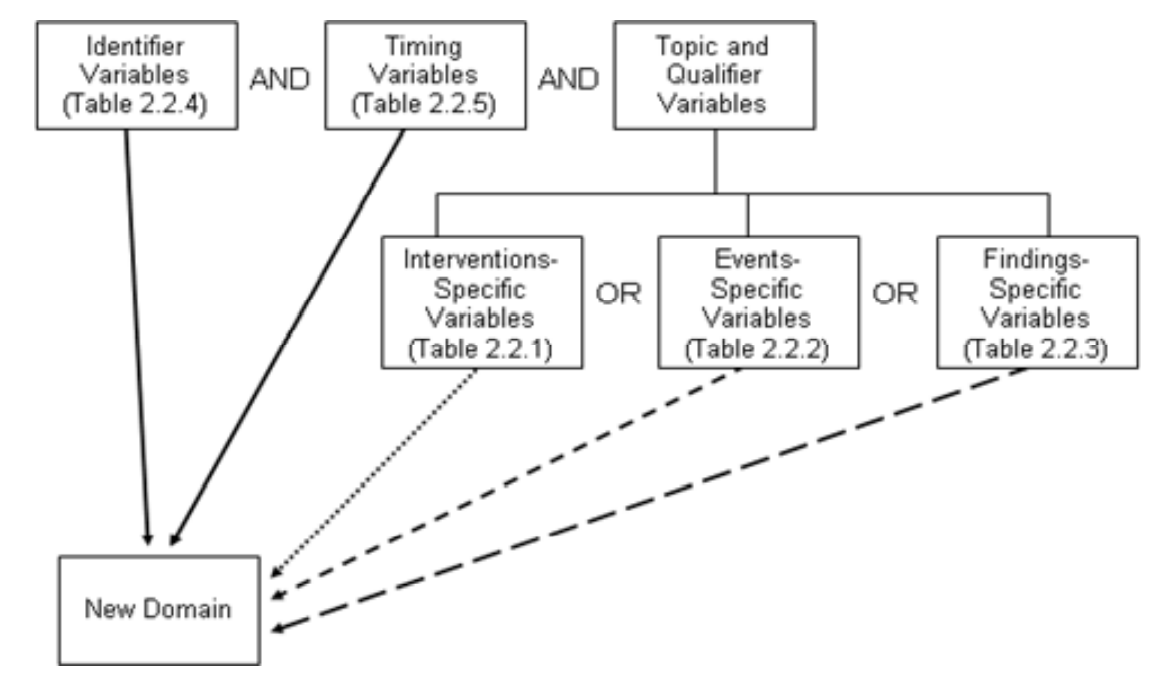
6. 自定义一个domain
要求:
前提是SDTM已存在的domain不满足需求
需要有general topic,不能是根据检验方法等
不能基于time建立新domain, 通常是收集到一个域。例如CM,包括之前用药和当前用药
如何使用收集的数据,也不允许根据这新建一个domain
去CDISC wiki SDTM Draft Domains Home 查draft ig,看有没有目标domain
参考已存在的domain,选取合适变量和顺序
7. 在人类实验中谨慎使用下述变量

二
1. IG 是一切基础
2. Timing变量不允许加到RELREC SUPP中
3. EPOCH
EPOCH基于--DTC in finding , 基于--STDTC in event/intervention
或者基于--ENDTC当样本是intervel时,采样开始时是一个EPOCH,结束在另一个EPOCH。
3.1
EPOCH不允许impute,但可以assign基于CRF信息,即使CRF date信息不完全。EPOCH也可以为空
在参与实验之前,不涉及EPOCH,所以EPOCH为空。在三个基本域中
4. SDTM 变量顺序必须和IG一致
5. Required 和 Expected变量是必须存在的,前者要求不能有任何空值,后者可以存在空值
只要study涉及Expected 和Permissible变量,即使全为空,也要包含在数据集中。
6. 自定义domain以X Y Z开头
7. 数据集拆分
DOMAIN的值和拆分前一样
需要domain作为前缀的变量,这个前缀得一致
可以根据--CAT SCAT拆分
--SEQ必须唯一在一个USUBJID内
拆分后,SUPP--中的IDVAR一般为--SEQ,如果不用--SEQ,请确认merge back to parent domain时的正确性
Permissible变量没必要包含在两个拆分后的数据集中
拆分后的数据集名字可以有四个字母,--CAT. 例如FACM, FAAE,QS36(SF 36), SUPP--也可以有四个字母
SUPP--数据集跟着DOMAIN一起拆分,注意RDOMAIN还是保持原来的名字 FA/CM等
RELRECdomain中的RDOMAIN需要换成四个字
AP和define也得注意下
三
1. SDTM 中的--TEST变量不允许和测量部位等qualifier变量拼接在一起。但ADaM中的PARAM可以
--TESTCD推荐使用简单明了的,例如首字母。
原因:SDTM可能导致大量CT
--TESTCD八个字符不够用
2. SDTM有命名规则,详见SDTM 附录D--命名参考
3. --CD一般要求八个字母,ARMCD要求不大于20个字母。label要求不超过40个字符。
4. 要求变量名字,类型,CT,format,decode等全study保持一致
5. Domain中的变量多数使用DOMAIN作为前缀,除了
DM中的变量,RELREC中的变量,SUPP--中的变量
Timing变量,VISIT VISITNUM
STUDYID DOMAIN等
四
1. USUBJID是唯一识别一个subject/patient,SUBJID只是一个人的代号。
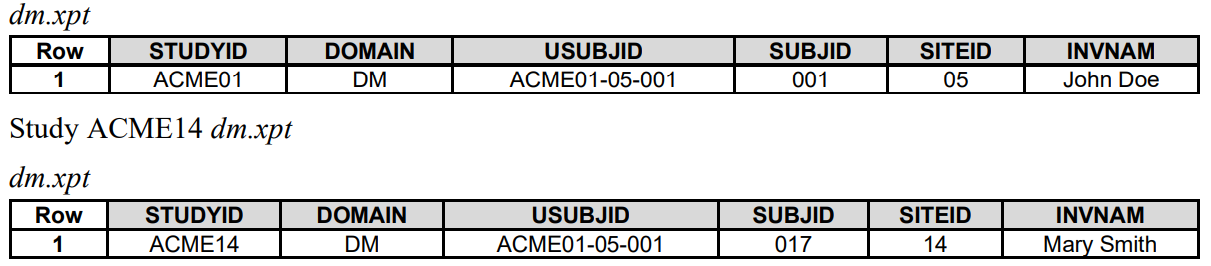
同一个人可以有不同的SUBJID,但只有一个USUBJID
2. 长文本和--TEST推荐小写,方便阅读,其余的文本型或者MedDRA推荐大写
3. --STAT --REASND解释NOT DONE
4.

5. --CAT/--SCAT和--GRPID
前者是across USUBJID,后者是USUBJID内
前者是提前设定的,可能有CT值。后者是CRF后设定的
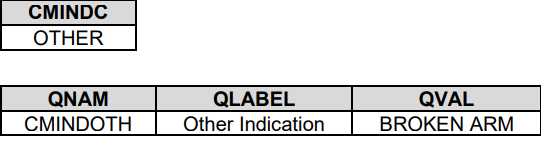
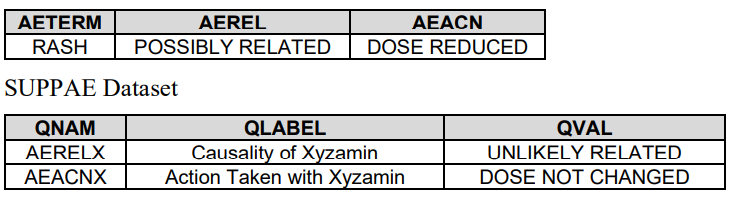
6. 当CRF出现'Other, Specify'时,收集到SUPP--中,使用QNAM QLABEL QVAL
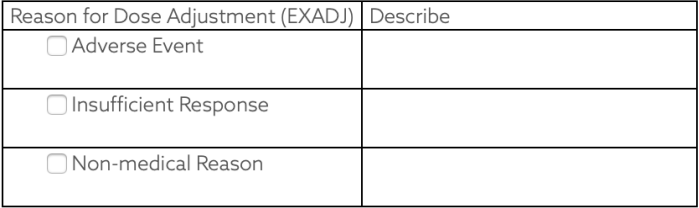
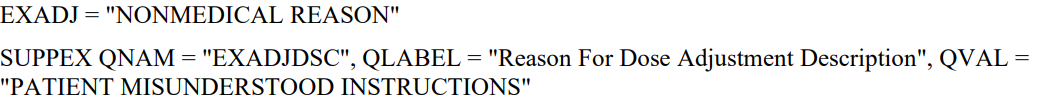

如果Sponsor要求--INDC是受限于CT
如果Sponsor要求CT是可扩展的
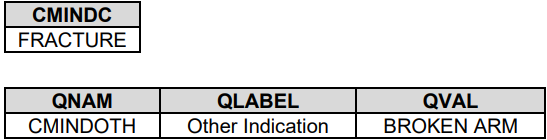
如果Sponsor对CT没啥要求

Finding域也对应这三种情况



如果是Topic变量,则加--PRESP加以区分
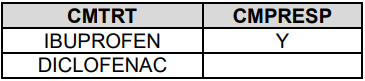
如果是--TEST,则直接Code就好
五Multiple 值
1.
Intervention 或 Event 中的topic有可能含有多个值,根据sponsor要求进行拆分。
2. 如果是Finding中--TEST有多个值,加个Nature key进行区分
3. 如果CRF允许存在多个值,则把对应变量加SUPP中

如果同时服用两种药
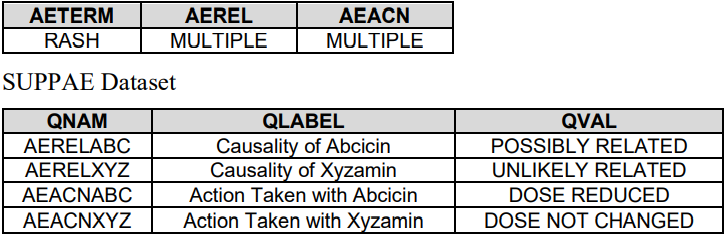
如果指定哪种药是感兴趣的药,这种指定必须清楚写在metadta中或CRF中
六
1. 变量长度要求200
七
CT
1. * SDS team希望Sponsor有自己的CT
单一值。例如PR CM
(NY) CDISC CT名字
MedDRA/ISO8601等外部CT
2. 数据和CT大小写一致
3. CT应该包含在define.xml中。
即使空是CT一部分,CT中也不包含空值
需要包含计划收集的所有CT值,即使数据中没有这些CT值。而不是在define.xml不加以区分的包含这个CT的所有值。
例如--PRESP CT是(NY),但define.xml中CT只放Y
4. 使用一些标准,以减少歧义
例如MedDRA WHODRUG CTCAE等
5. --BODSYS --SOC
如果是Primary system organ class用在分析,则--BODSYS --SOC都一样
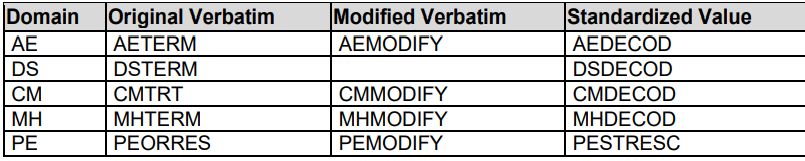
6. 用作coding的中间变量也要包含在数据集中。例如--LLT --LLTCD
变量和coding变量都要包含在数据集中

CMDECOD CMCLAS ATC可以用作CM相关分析中

解剖学治疗学化学分类
7.
8. Y/N
这种CT消除了空值带来的困惑,空值为N还是null
Sponsor可以扩展,加入NA NULL U
还有中CT是Y_BLANK
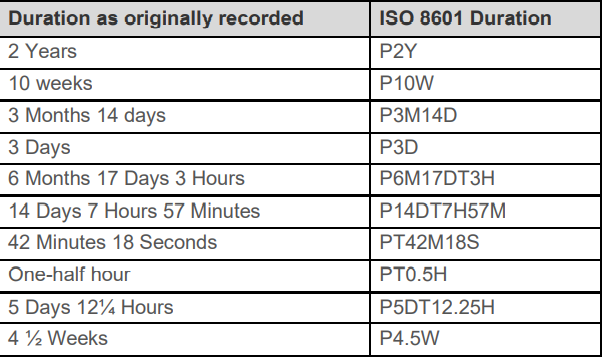
八 ISO8601
1. 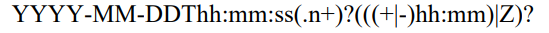
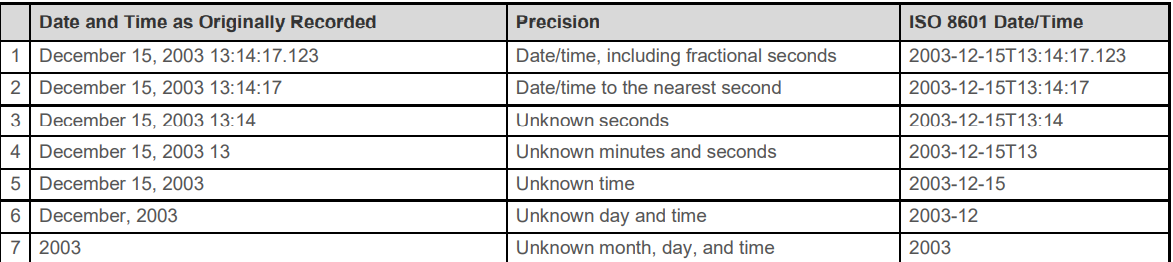
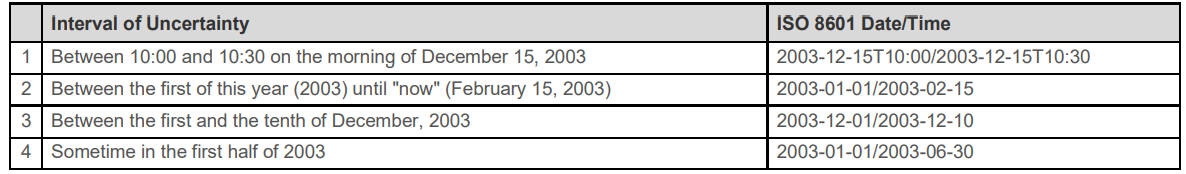
/表示intervel
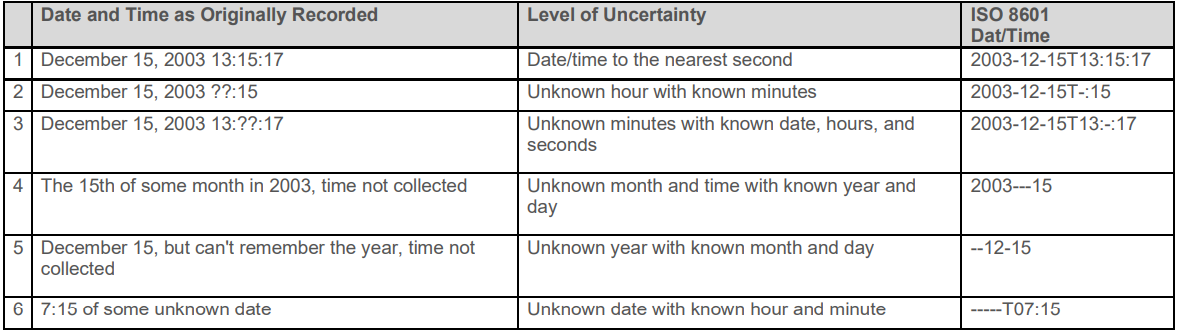
缺失的日期用--表示
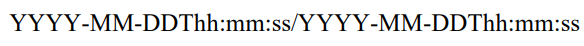
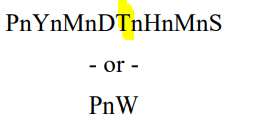
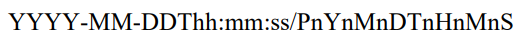
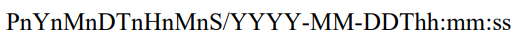
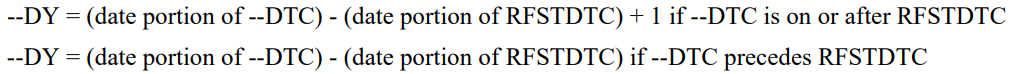
2.
VISITDY为空当VISIT为Uncheduled时,但VISITNUM非空
VISIT和VISITNUM是一对一mapping
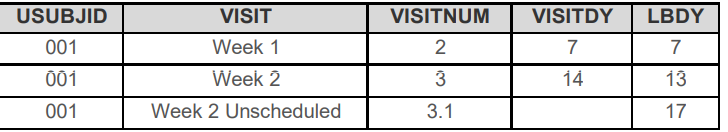
3. --STRF --ENRF
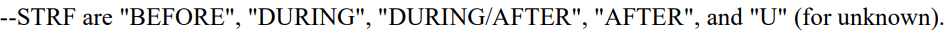
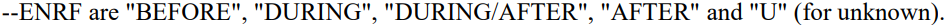
即相对这个Intervel,这条记录的状态
这两个变量有限制,RFSTDTC是固定的,可能不太准确
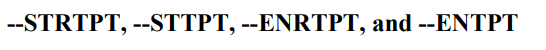
这四个变量指定开始参考点和结束参考点
CT值AFTER在这是无意义的,可以使用Ongoing

4. --DTC
--DTC是样本采集开始时间,或记录收集时间。不在Finding中使用--STDTC
![]()
5. 一些--TEST的值是时间时需要小心
6.
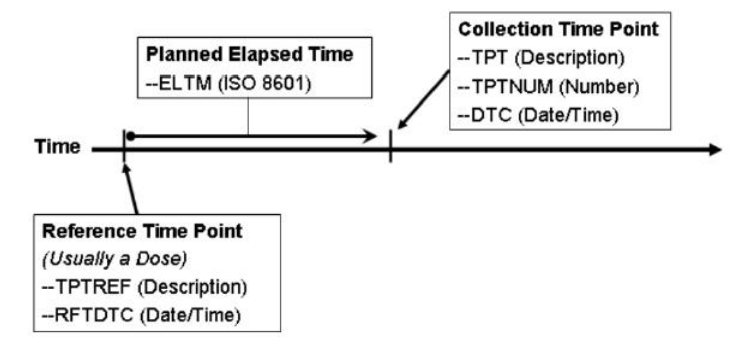

7. Disease milestone
是一个是在疾病过程中可以预期的事件或活动,但时间不确定。
MIDSTYPE = EPISODE OF DISEASE UNDER STUDY
MIDS = 
MIDS类似--TPTREF,相当于一个anchor
RELMIDS类似--ELTM,但只能是text型
MIDSDTC类似--RFTDTC
IG51页还要再看下
九
1.--ORRES
--ORRES是不能为空的,除了--STAT为NOT DONE,--DRVFL = Y
只要有--ORRES,必须有--STRESC
如果--ORRES有< >等符号,直接copy到--STRESC中。--STRESN为空,只在adam中根据方案做derive
2. --TECD没有做 LBALL
有两种呈现方法,一是当前记录没做,而是一个group都没做
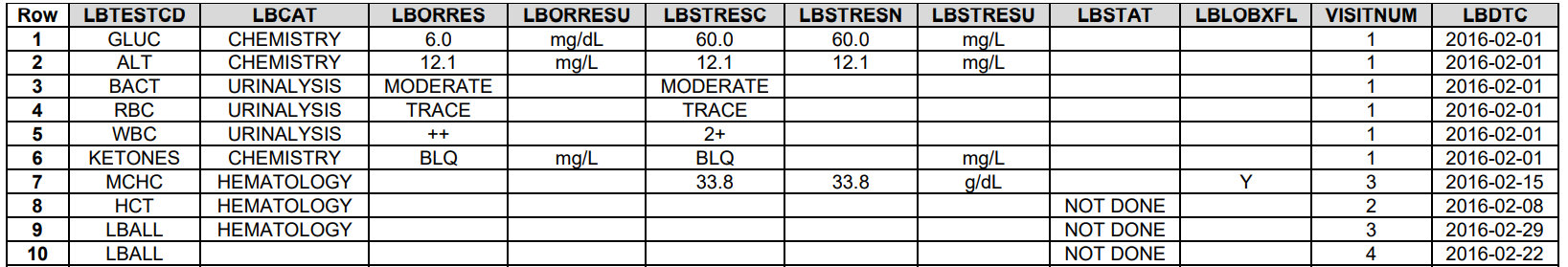
8是某个TESTCD没做
9是HEMATOLOGY这个CAT都没做
10是所有--TEST都没做
主要看--TESTCD是不是--ALL
3. --TEST不能超40个字符,因为可能会使用transpose
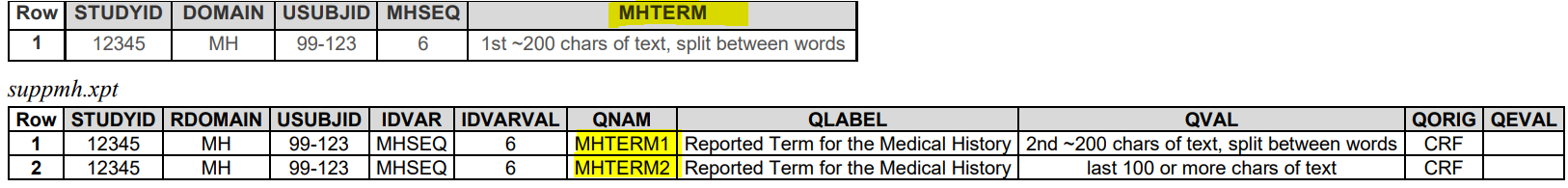
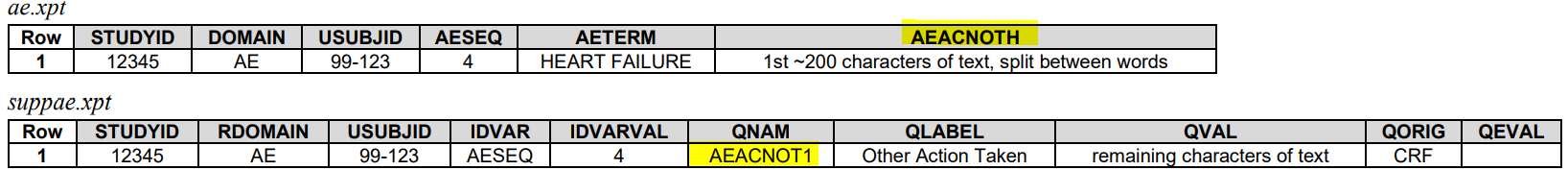
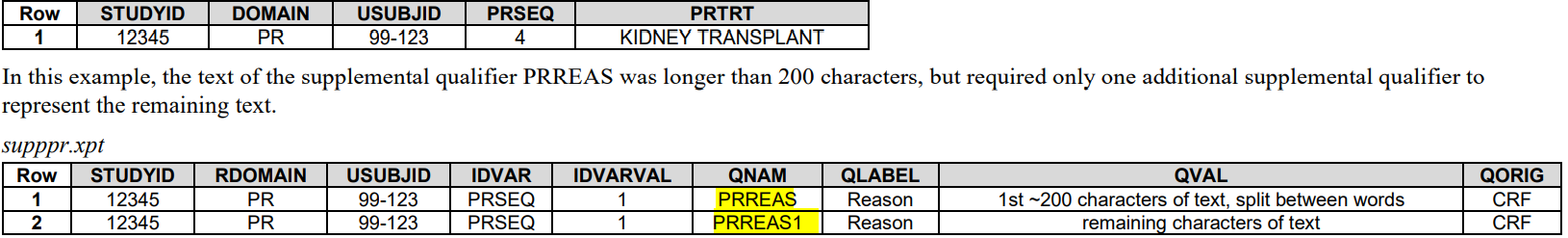
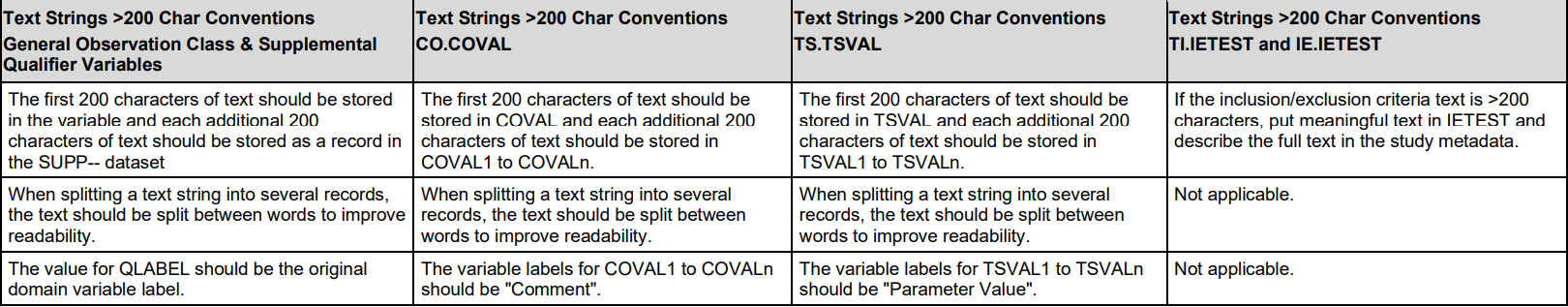
4. 当值长度超过200
Parent可以保留前200个,SUPP--中分开放
或这全放SUPP--中
5. --CLSIG
QNAM.--CLSIG是否显著
--INTP记录NORMAL等
6. --REAS
QNAM.--REAS
--REASND是NOT DONE的原因。QNAM.REAS是其它原因,例如重复测量了一次
7. --PRESP --OCCUR
是intervention 和 events域
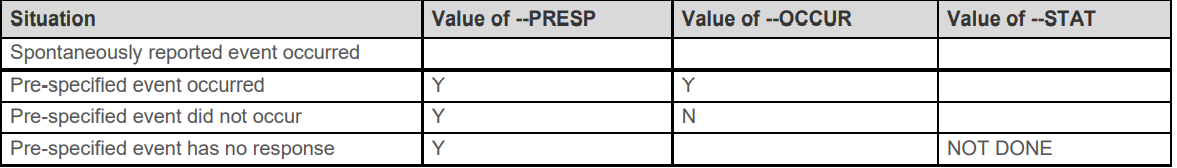
8.
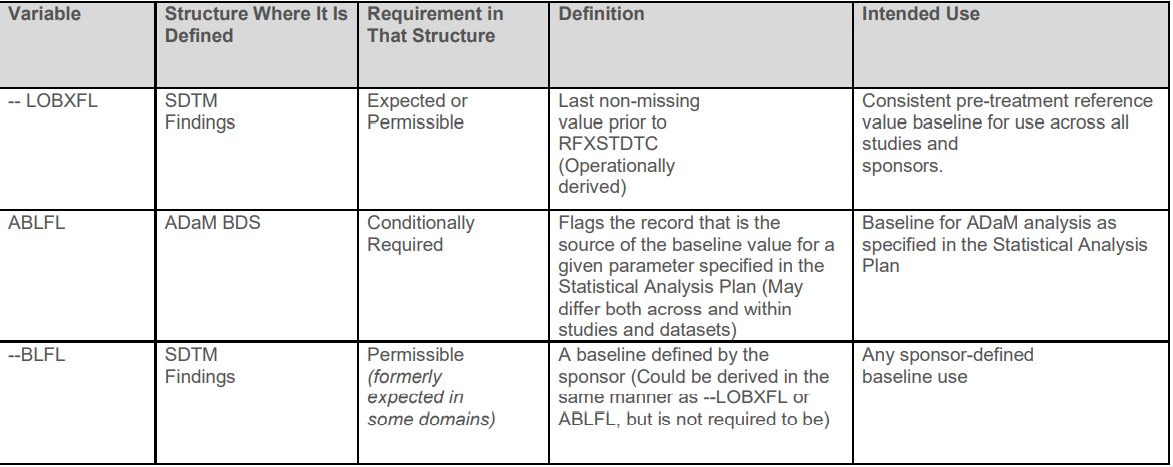
十一
本文来自博客园,作者:Iving,转载请注明原文链接:https://www.cnblogs.com/SAS-T/p/15810385.html


 浙公网安备 33010602011771号
浙公网安备 33010602011771号