易基因:WGBS揭示Vpr蛋白在HIV-1感染中对CD4+ T细胞DNA甲基化变化的作用|项目文章
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
全球约有3800万HIV-1感染者,每年新增感染者约150万。HIV-1主要攻击CD4+ T细胞,导致其耗竭,最终发展为艾滋病和死亡。尽管抗逆转录病毒治疗有效抑制HIV-1复制,但由于病毒在潜伏感染细胞中的持续存在,这种病毒仍然是一个重大的全球威胁,导致了大量的发病率和死亡率。在HIV-1感染的细胞内,辅助病毒蛋白r(viral protein r,Vpr)调控多种生物过程,包括细胞周期进展、DNA修复和凋亡。DNA甲基化在不改变DNA序列下调控基因表达,在生理过程中扮演着至关重要的角色。然而,关于Vpr对人类CD4+ T细胞DNA甲基化作用研究尚未得到充分探索。
近日,中山大学附属第三医院王培培为第一作者,中山大学中山医学院蔡金锋博士和中山大学附属第三医院高志良教授为共同通讯作者在《Virology Journal》杂志发表题为“Vpr driving DNA methylation variation of CD4 + T cells in HIV-1 infection“的研究论文。研究对感染了HIV-1-Vpr或HIV-1-△Vpr的原代CD4+ T细胞进行基于单碱基分辨率的全基因组亚硫酸盐测序(WGBS),以分析Vpr在DNA甲基化变异中的作用。还对Vpr诱导的差异甲基化胞嘧啶(DMCs)的特异性特征进行了分析,同时研究了组蛋白DNA甲基化与Vpr之间的相关性。深圳易基因科技为本研究提供WGBS测序分析技术服务。

本研究采用基于单碱基分辨率的全基因组亚硫酸盐测序(WGBS)、实时定量PCR和western blot实验,以探索HIV-1感染下Vpr对宿主细胞DNA甲基化的影响。研究结果表明HIV-1感染导致原代CD4+ T细胞整体DNA甲基化水平升高。特别是Vpr诱导DNA甲基化模式的显著变化,影响启动子区域和基因体内的区域。这些变化显著影响与免疫相关通路和嗅觉受体活性相关的基因。此外,Vpr还表现出降低组蛋白基因甲基化水平的特异性功能。
这些发现强调了Vpr在通过调控DNA甲基化模式调控转录中的重要作用。研究结果显著增强了对HIV-1 Vpr对宿主细胞DNA甲基化影响的理解,从而为HIV进展和治疗的调控提供创新的治疗靶点。未来进一步的研究需要深入了解Vpr如何调控DNA甲基化的具体机制,特别是其对组蛋白基因甲基化的调控。这将有助于开发新的治疗策略,以更有效地控制HIV-1的进展和管理。
研究结果
(1)HIV-1 Vpr 诱导原代 CD4 + T 细胞中的 DNA 甲基化变化
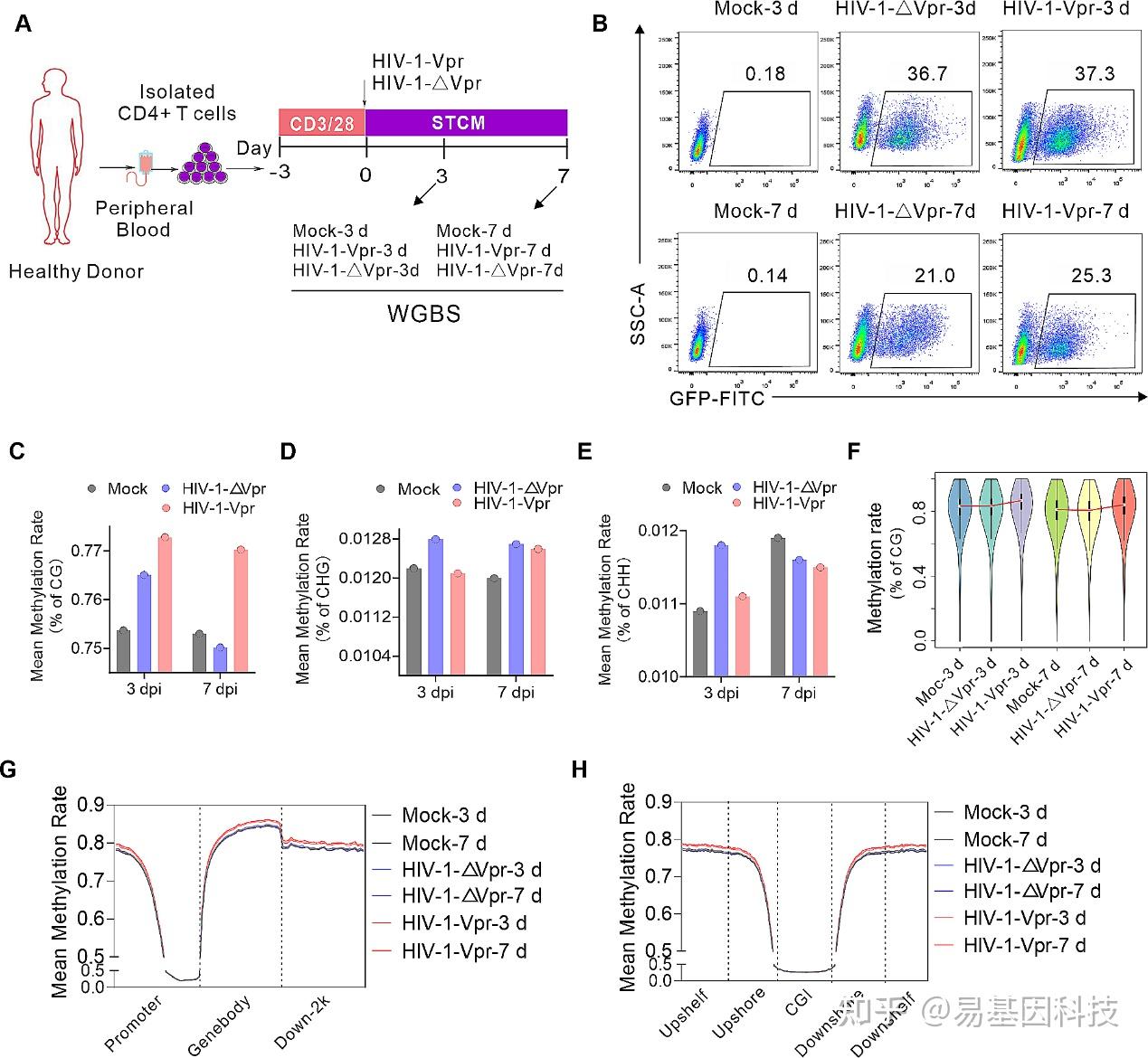
图1:Vpr诱导的DNA甲基化。
- 全基因组亚硫酸盐测序(WGBS)研究中采用的实验设计示意图。
- 流式细胞术图展示了在WGBS下HIV-1对原代CD4+ T细胞的感染。
C-E. 全基因组范围内CG(C)、CHG(D)和CHH(E)环境中的甲基化水平。
F. 小提琴图展示甲基化水平的整体分布,bin大小为10 kb。
G-H. 基于元件(G)和CGI(H)模式计算平均DNA甲基化水平。
(2)HIV-1 Vpr诱导广泛的DNA高甲基化
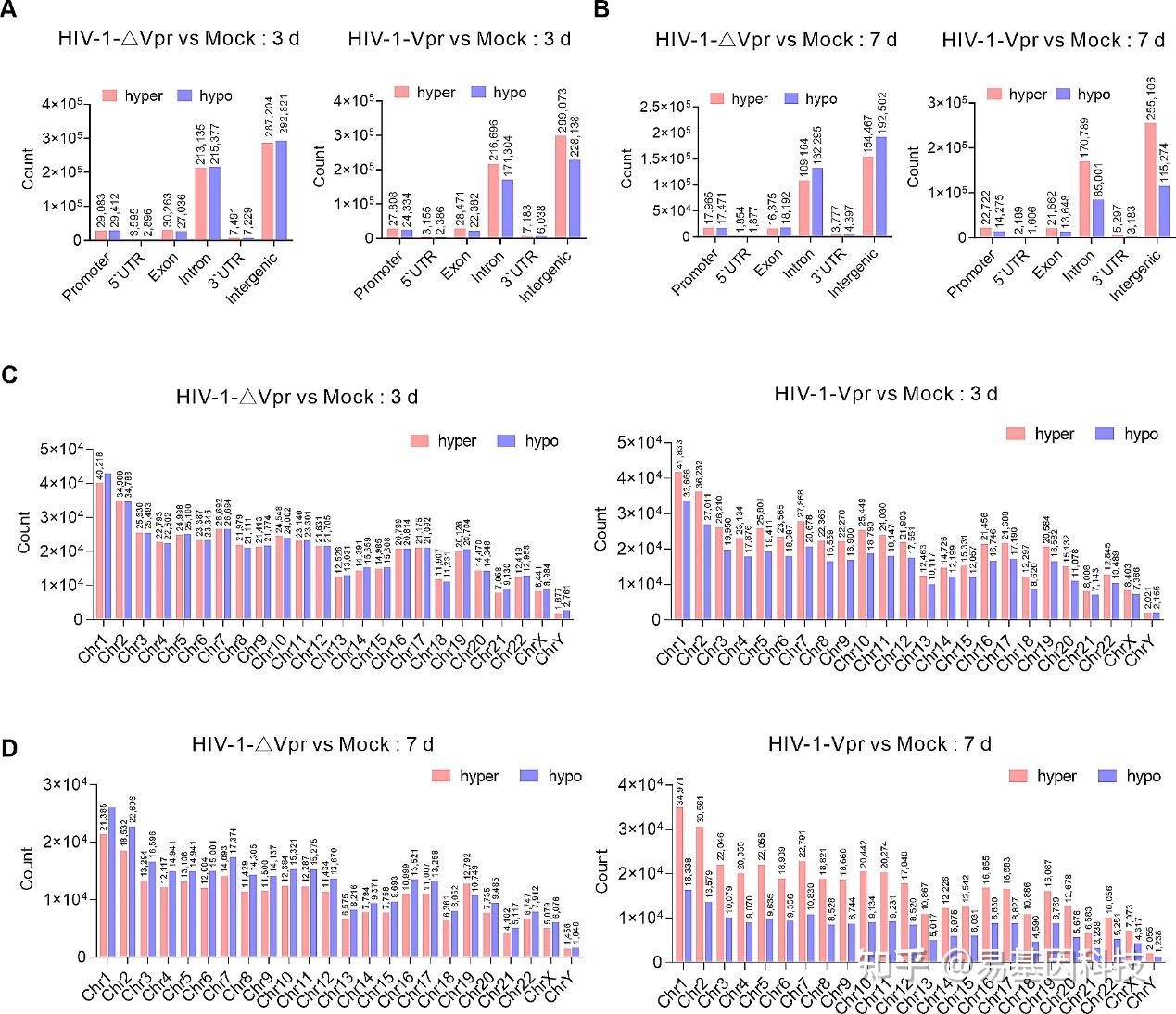
图2:HIV-1 Vpr诱导广泛的DNA高甲基化。
- 感染后第3天,HIV-1-∆Vpr感染和HIV-1-Vpr感染中差异甲基化胞嘧啶(DMCs)的基因组特征。
- 感染后第7天,HIV-1-∆Vpr感染和HIV-1-Vpr感染中差异甲基化胞嘧啶(DMCs)的基因组特征。
- 感染后第3天,HIV-1-∆Vpr或HIV-1-Vpr感染期间每条染色体上DMCs的分布。
- 感染后第7天,HIV-1-∆Vpr或HIV-1-Vpr感染期间每条染色体上DMCs的分布。
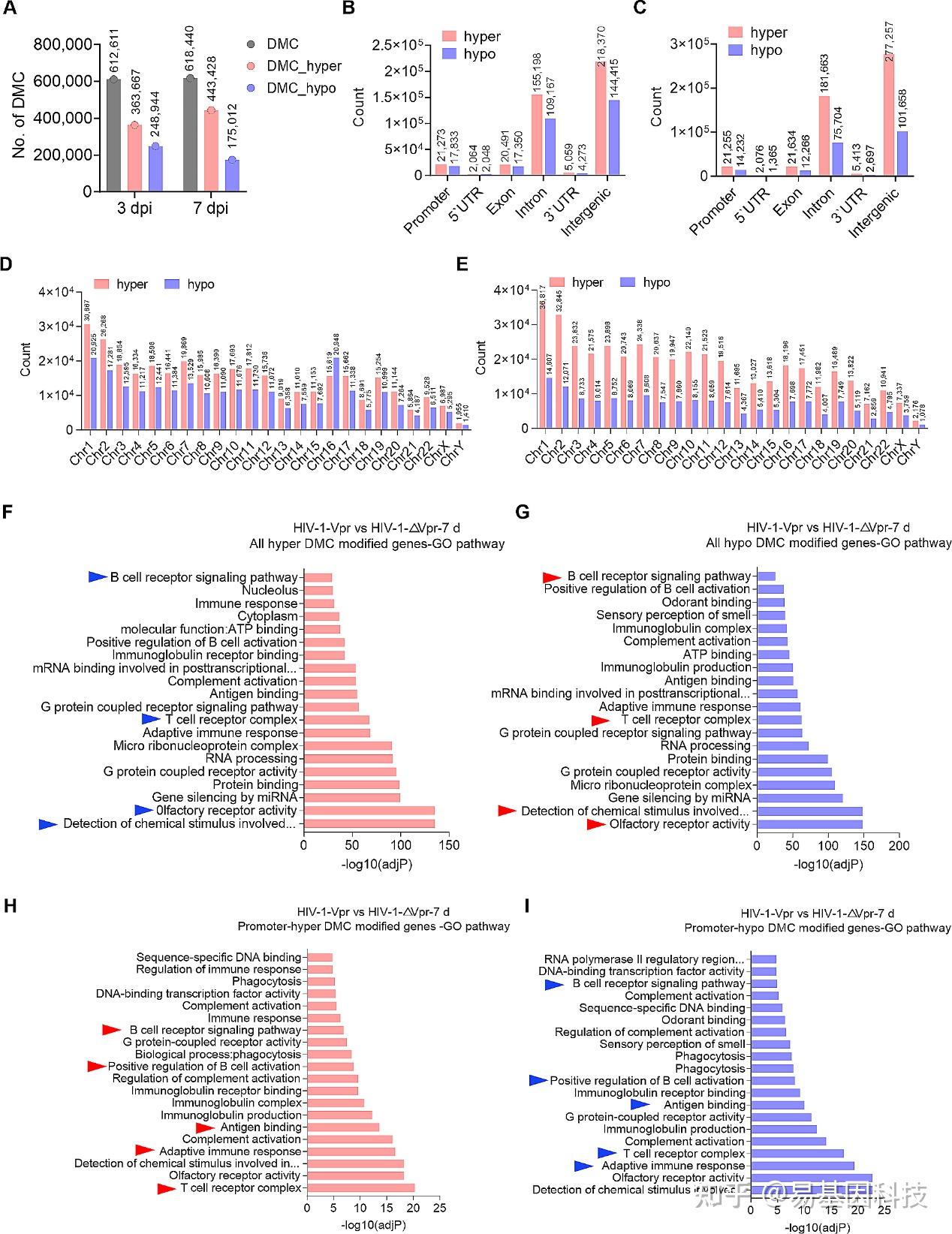
图3:Vpr诱导的DNA甲基化变化主要分布于免疫相关通路中。
- 由Vpr特异性诱导的差异甲基化胞嘧啶(DMCs)数量。
B-C. 感染后第3天(B)和第7天(C)Vpr特异性诱导的DMCs基因组特征。
D-E. 感染后第3天(D)和第7天(E)Vpr特异性诱导的DMCs在每条染色体上的分布。
F-G. 与全部高甲基化(F)或低甲基化(G)DMCs相关的基因的基因本体(GO)富集分析。
H-I. 与启动子高甲基化(H)或低甲基化(I)DMCs相关的基因的GO富集分析。
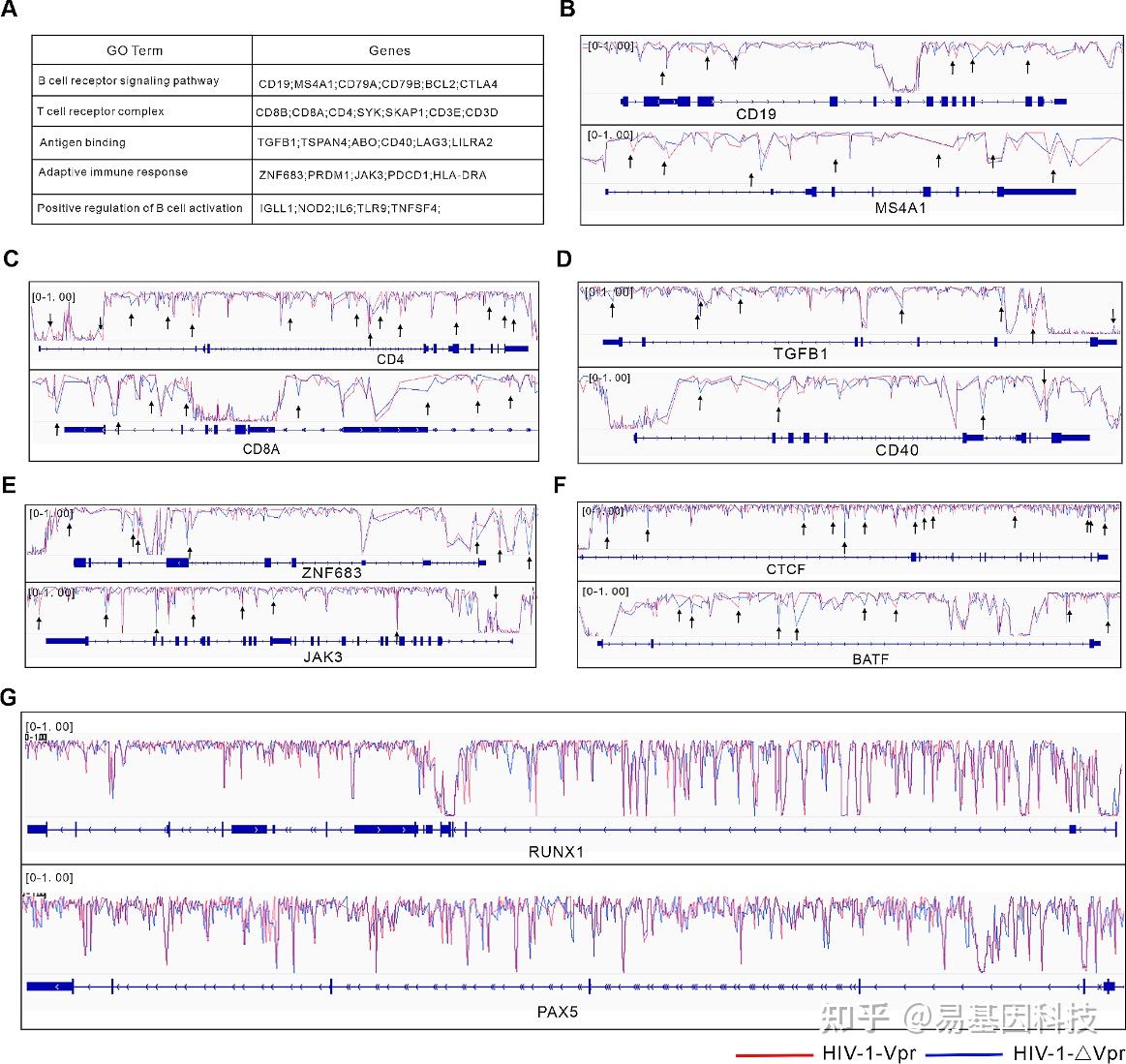
图4:Vpr诱导淋巴细胞分化相关基因的DNA甲基化变化。
- Vpr诱导的DMCs的主要GO富集通路标志性基因。
B-G. IGV基因组浏览器可视化HIV-1-∆Vpr和HIV-1-Vpr感染中CD19或MS4A1基因(B)、CD4或CD8A基因(C)、TGFB1或CD40基因(D)、ZNF683或JAK3基因(E)、CTCF或BATF基因(F)、RUNX1或PAX5基因(G)的WGBS数据。黑色箭头表示DMCs。
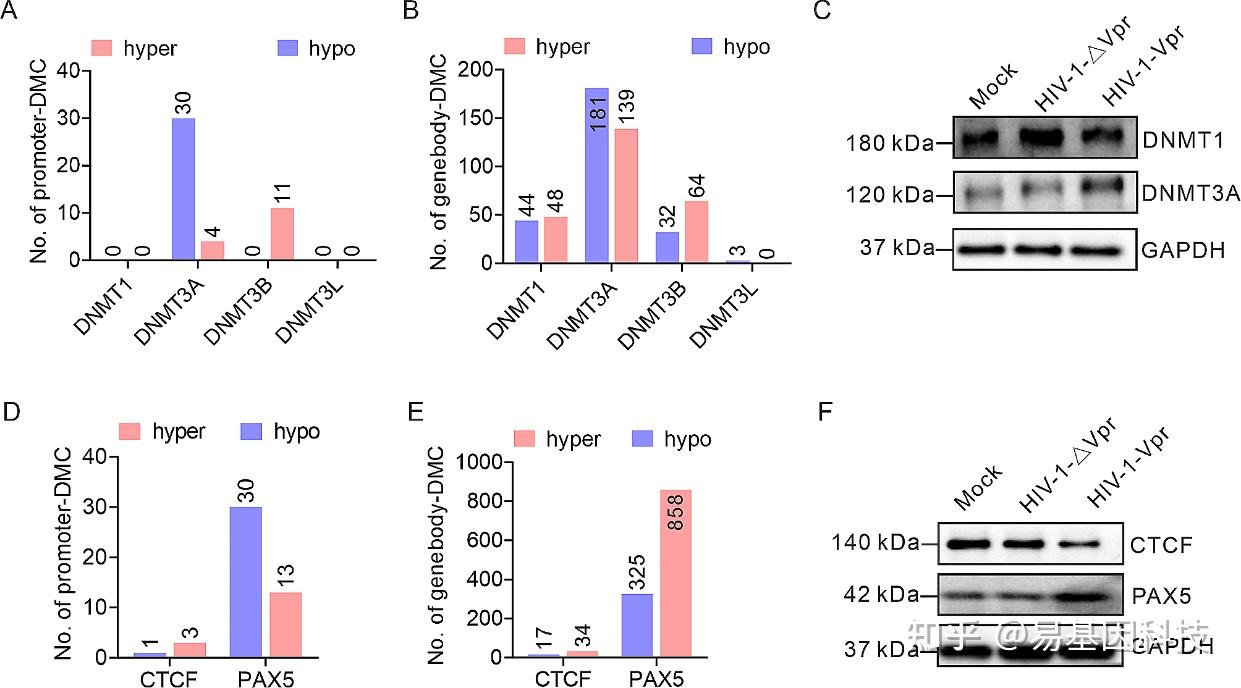
图5:Vpr对宿主细胞DNA甲基化的影响通过western blot验证。
A-B. Vpr对DNA甲基转移酶(DNMTs)启动子(A)或gene body(B)区域DMCs的作用。
C. Vpr对DNMT1和DNMT3A蛋白水平的作用。
D-E. Vpr对CTCF和PAX5启动子(A)或gene body(B)区域中DMCs的作用。
F. Vpr对CTCF和PAX5蛋白水平的作用。
(3)HIV-1 vpr改变原代CD4+T细胞中的差异甲基化区域(DMR)
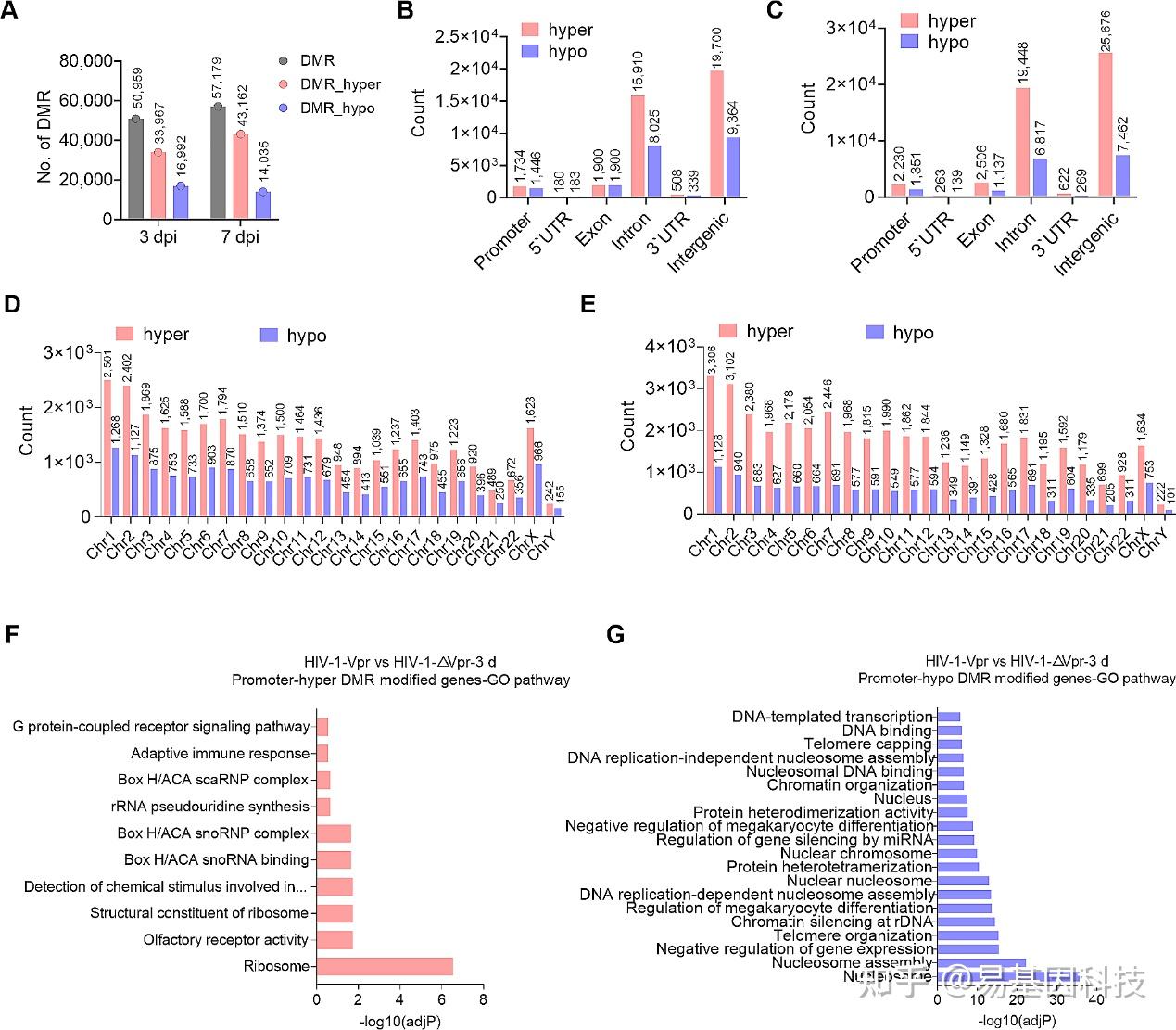
图6:Vpr改变原代CD4+ T细胞中的DMRs。
- Vpr诱导的DMRs数量。
B-C. Vpr诱导的DMRs在感染后第三天(B)和第七天(C)的基因组特征。
D-E. Vpr诱导的DMRs在感染后第三天(D)和第七天(E)每条染色体上的分布。
F-G. 启动子高甲基化(F)或低甲基化(G)DMCs修饰相关基因的GO富集分析。
(4)HIV-1 vpr导致组蛋白DNA甲基化丢失
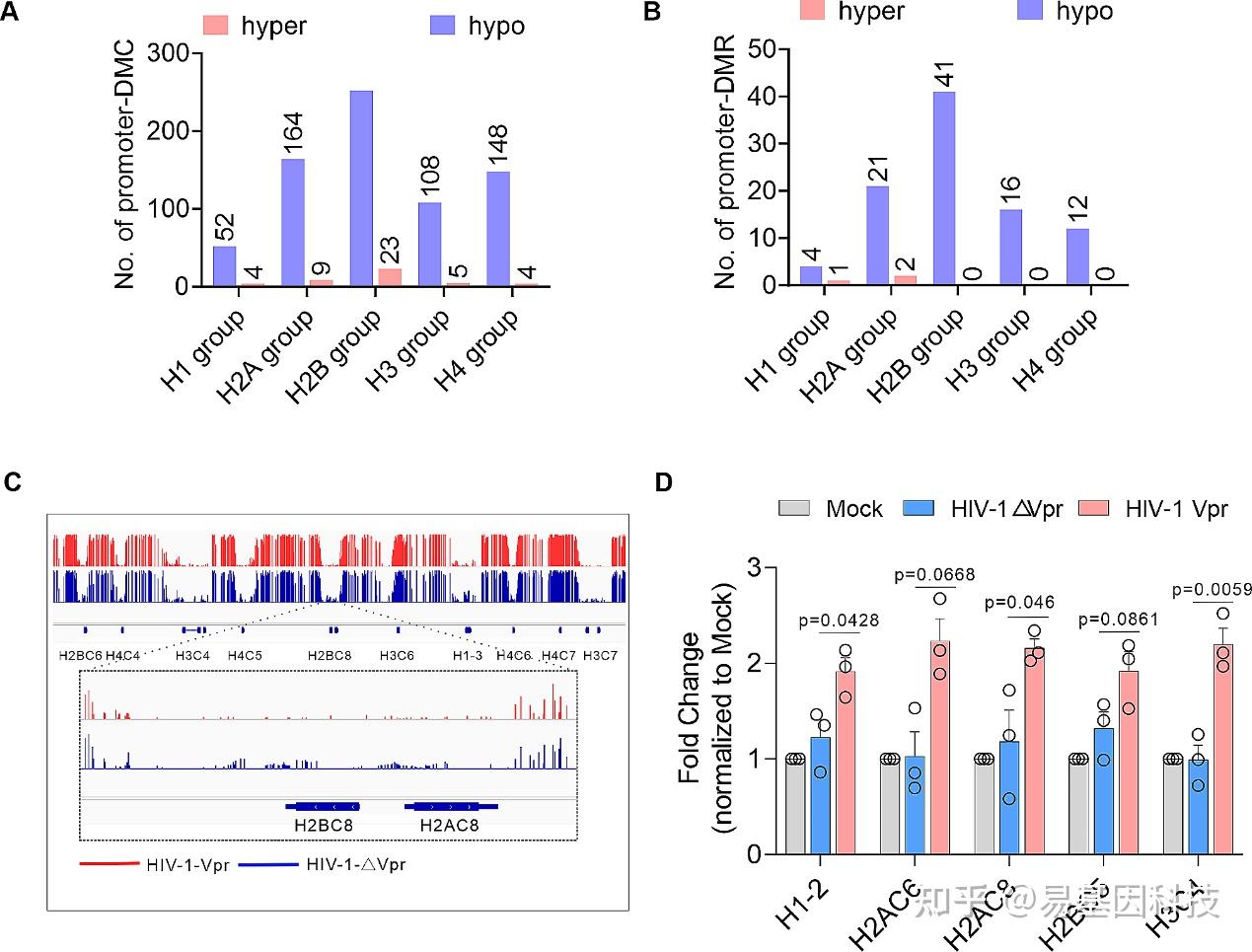
图7:Vpr诱导组蛋白DNA甲基化丢失。
A-B. Vpr对组蛋白DNA甲基化的作用。DMCs(A)或DMRs数量。
C. HIV-1-△Vpr和HIV-1-Vpr感染中组蛋白DNA甲基化谱的基因组浏览器轨迹示例。
D. 通过实时定量RCR分析Vpr对组蛋白基因转录的作用。
易基因:DNA甲基化研究基本思路
DNA甲基化一般遵循四个步骤:
首先,进行整体全基因组甲基化变化的分析,包括平均甲基化水平变化、甲基化水平分布变化、降维分析、聚类分析、相关性分析等。
其次,进行甲基化差异水平分析,筛选具体差异基因,包括DMC/DMR/DMG鉴定、DMC/DMR在基因组元件上的分布、DMC/DMR的TF结合分析、时序甲基化数据的分析策略、DMG的功能分析等。
再次,将甲基化组学&转录组学关联分析,包括Meta genes整体关联、DMG-DEG对应关联、网络关联等。
最后,对筛选出的目标区域DNA甲基化进行验证,通常采用靶基因重亚硫酸盐测序(Target-BS)。

关于易基因全基因组重亚硫酸盐测序(WGBS)
全基因组重亚硫酸盐甲基化测序(WGBS)可以在全基因组范围内精确的检测所有单个胞嘧啶碱基(C碱基)的甲基化水平,是DNA甲基化研究的金标准。WGBS能为基因组DNA甲基化时空特异性修饰的研究提供重要技术支持,能广泛应用在个体发育、衰老和疾病等生命过程的机制研究中,也是各物种甲基化图谱研究的首选方法。
易基因全基因组甲基化测序技术通过T4-DNA连接酶,在超声波打断基因组DNA片段的两端连接接头序列,连接产物通过重亚硫酸盐处理将未甲基化修饰的胞嘧啶C转变为尿嘧啶U,进而通过接头序列介导的 PCR 技术将尿嘧啶U转变为胸腺嘧啶T。
应用方向:
WGBS广泛用于各种物种,要求全基因组扫描(不错过关键位点)
- 全基因组甲基化图谱课题
- 标志物筛选课题
- 小规模研究课题
技术优势:
- 应用范围广:适用于所有参考基因组已知物种的甲基化研究;
- 全基因组覆盖:最大限度地获取完整的全基因组甲基化信息,精确绘制甲基化图谱;
- 单碱基分辨率:可精确分析每一个C碱基的甲基化状态。

易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化)和表观转录组学(m6A、m5C、m1A、m7G、ac4C)、染色质结构与功能组学技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900。
参考文献:
Wang P, Meng Z, Deng K, Gao Z, Cai J. Vpr driving DNA methylation variation of CD4 + T cells in HIV-1 infection. Virol J. 2024 Apr 26;21(1):97. pii: 10.1186/s12985-024-02363-5. doi: 10.1186/s12985-024-02363-5. PubMed PMID: 38671522.
相关阅读:
项目文章 | WGBS+RNA-seq揭示松材线虫JIII阶段形成过程中的DNA甲基化差异
Cell|易基因微量DNA甲基化测序助力中国科学家成功构建胚胎干细胞嵌合体猴,登上《细胞》封面


