易基因: m6A-seq+RIP-seq+ATAC等揭示YTHDF2通过整合RNA与DNA表观组学调控T细胞抗肿瘤免疫多功能性|NC
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
N6-甲基腺苷(m6A)是真核mRNA中最普遍和丰富的修饰,通过“writer”(甲基转移酶)、“eraser”(去甲基化酶)和“reader”(阅读蛋白)动态调控mRNA代谢的几乎每一步,并干扰多种生物过程。RNA甲基化是调控免疫细胞功能的重要过程,但其如何影响CD8 T细胞的抗肿瘤活性尚不完全清楚。
近日,澳门大学侯嘉杰教授和中山大学徐瑞华教授团队合作研究了m6A RNA reader蛋白YTHDF2在CD8 T细胞中的表达上调和亚细胞定位如何决定其在抗肿瘤免疫中的多功能性。研究发现YTHDF2在早期效应T细胞或效应样CD8 T细胞中高表达,并且对肿瘤进展和抗PD-1阻断治疗反应有重要作用。相关研究成果以“YTHDF2 upregulation and subcellular localization dictate CD8 T cell polyfunctionality in anti-tumor immunity”为题发表在Nature子刊《Nature Communications》上。

标题:YTHDF2 upregulation and subcellular localization dictate CD8 T cell polyfunctionality in anti-tumor immunity(YTHDF2上调和亚细胞定位决定CD8 T细胞在抗肿瘤免疫中的多功能性)
期刊:Nature Communications
发表时间:2024年11月5日
技术平台:m6A-seq、RIP-seq、RNA-seq、ATAC-seq等(易基因金牌技术)
本研究首先揭示了m6A RNA reader蛋白YTHDF2在早期效应或效应样CD8 T细胞中高表达。分析结果表明YTHDF2促进了新生RNA(nascent RNA)合成,而m6A识别对于蛋白质特异性核功能至关重要,也加强了其在RNA水平上的自我调控。T细胞中YTHDF2缺失会加剧肿瘤进展,并导致对PD-1阻断在小鼠和人类中的无反应性。除了启动对线粒体健康必要的RNA衰变外,YTHDF2还协调染色质变化,促进T细胞的多功能性。YTHDF2与IKZF1/3互作,促进目标基因的持续转录。因此,在YTHDF2缺失T细胞中,通过联合使用IKZF1/3抑制剂来那度胺(lenalidomide),可以大幅恢复免疫疗法诱导的疗效,该疗效在小鼠模型中得到验证。总之,本研究结果表明YTHDF2协调表观转录和转录网络,以增强T细胞免疫,这可能为癌症免疫治疗提供新策略。
研究思路:
实验方法:
样本选择:
- 动物模型:使用Ythdf2Flox/Flox(Ythdf2F/F)小鼠与dLckCre转基因小鼠杂交,条件性敲除T细胞中的Ythdf2(Ythdf2CKO)。
- 细胞培养:从小鼠脾脏组织分离外周naïve CD8 T细胞,进行体外激活和培养。
- 人类样本:结直肠癌(CRC)和肝细胞癌(HCC)患者的组织样本。
技术平台:
- 流式细胞术(Flow Cytometry):分析和分选不同的T细胞亚群,包括肿瘤浸润性T细胞。
- 免疫荧光染色:检测YTHDF2和CD8在组织样本中的表达和定位。
- 免疫共沉淀(IP)和质谱分析(MS):鉴定与YTHDF2互作的蛋白质。
- RNA测序技术(RNA-seq):分析基因表达变化和转录组分析。
- m6A测序技术(m6A-seq):分析m6A甲基化水平变化。
- RNA免疫沉淀测序(RIP-seq):分析YTHDF2结合的RNA。
- ATAC-seq:分析染色质可及性,即基因组中开放染色质区域的鉴定。
- CUT&RUN:分析特定蛋白质在基因组上的结合位点。
- Ribo-seq:分析翻译过程中的RNA分子。
- 电子显微镜技术:观察线粒体的形态变化。
结果图形:
(1)YTHDF2在早期效应T细胞(Teff)和类效应T细胞中选择性上调和重新分布。
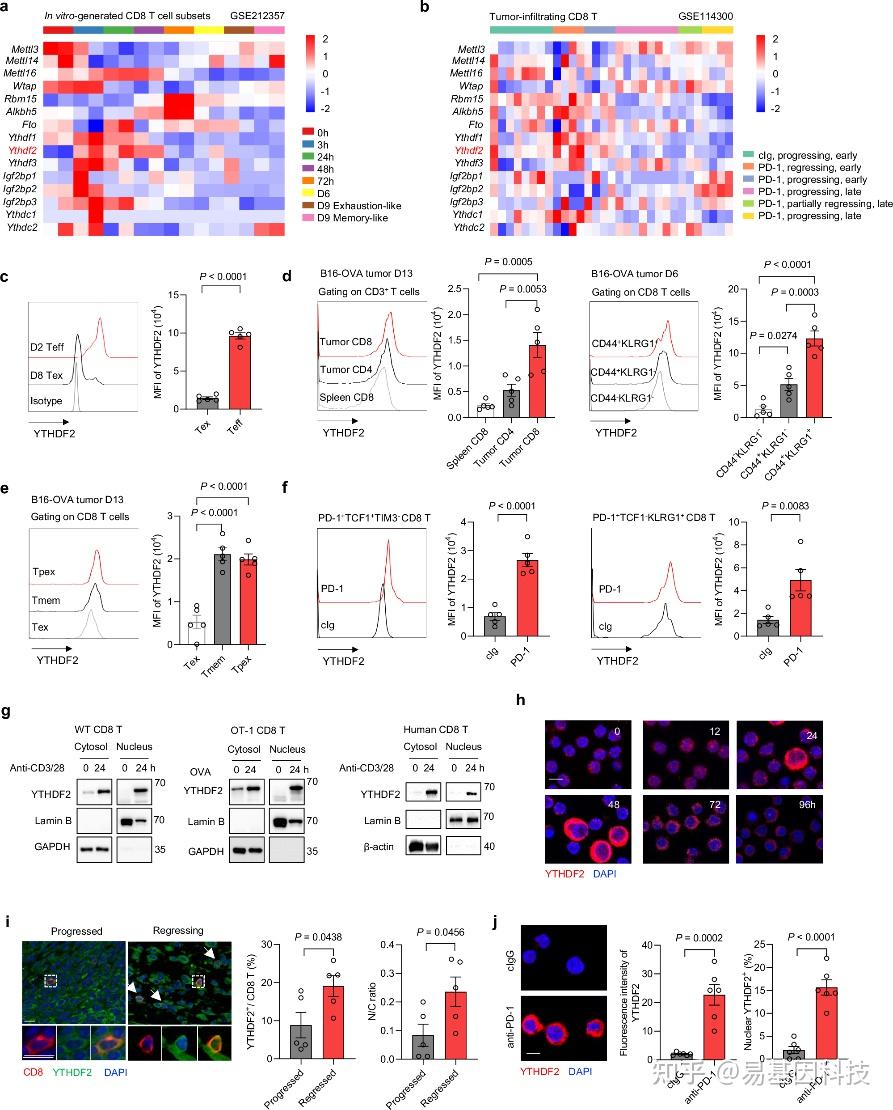
图1:YTHDF2在早期Teff和类Teff细胞中选择性上调和重新分布。
a. 不同时间点激活或向耗竭/记忆阶段分化的人CD8 T细胞中m6A修饰物的mRNA表达(GSE212357)。
b. 接受抗PD-1或cIg治疗的小鼠肺肿瘤中的CD8 T细胞中m6A修饰物的mRNA表达(GSE114300)。
c. 在体外生成的效应CD8 T细胞(Teff,n=5个独立样本)和耗竭CD8 T细胞(Tex,n=5个独立样本)中YTHDF2的平均荧光强度(MFI)。
d-e. 在接种B16F10-OVA肿瘤的小鼠的脾脏或肿瘤浸润性T细胞亚群中YTHDF2的MFI,在肿瘤接种后第6天(n=5只小鼠)或第13天(n=5只小鼠)。 Tpex:祖细胞耗竭T细胞。Tmem:记忆T细胞。
f. 在接受抗PD-1或cIg治疗的B16F10-OVA肿瘤中的CD8 T细胞亚群中YTHDF2的MFI(每组n=5只小鼠)。
g. 刺激的小鼠或人类CD8 T细胞的细胞质和细胞核中YTHDF2的免疫印迹分析。
h. naïve或激活的CD8 T细胞中YTHDF2(红色)和DAPI(蓝色)的代表性共聚焦免疫荧光图像。
i. 在进展(n=5个独立样本)或缩小(n=5个独立样本)的B16-OVA肿瘤中CD8(红色)和YTHDF2(绿色)的代表性免疫荧光染色。
j. 在接受抗PD-1或cIg治疗的CD8 Tpex细胞中YTHDF2(红色)和DAPI(蓝色)的代表性共聚焦免疫荧光图像(每组n=6个独立样本)。
(2)YTHDF2 对 CD8 T 细胞的抗肿瘤作用至关重要
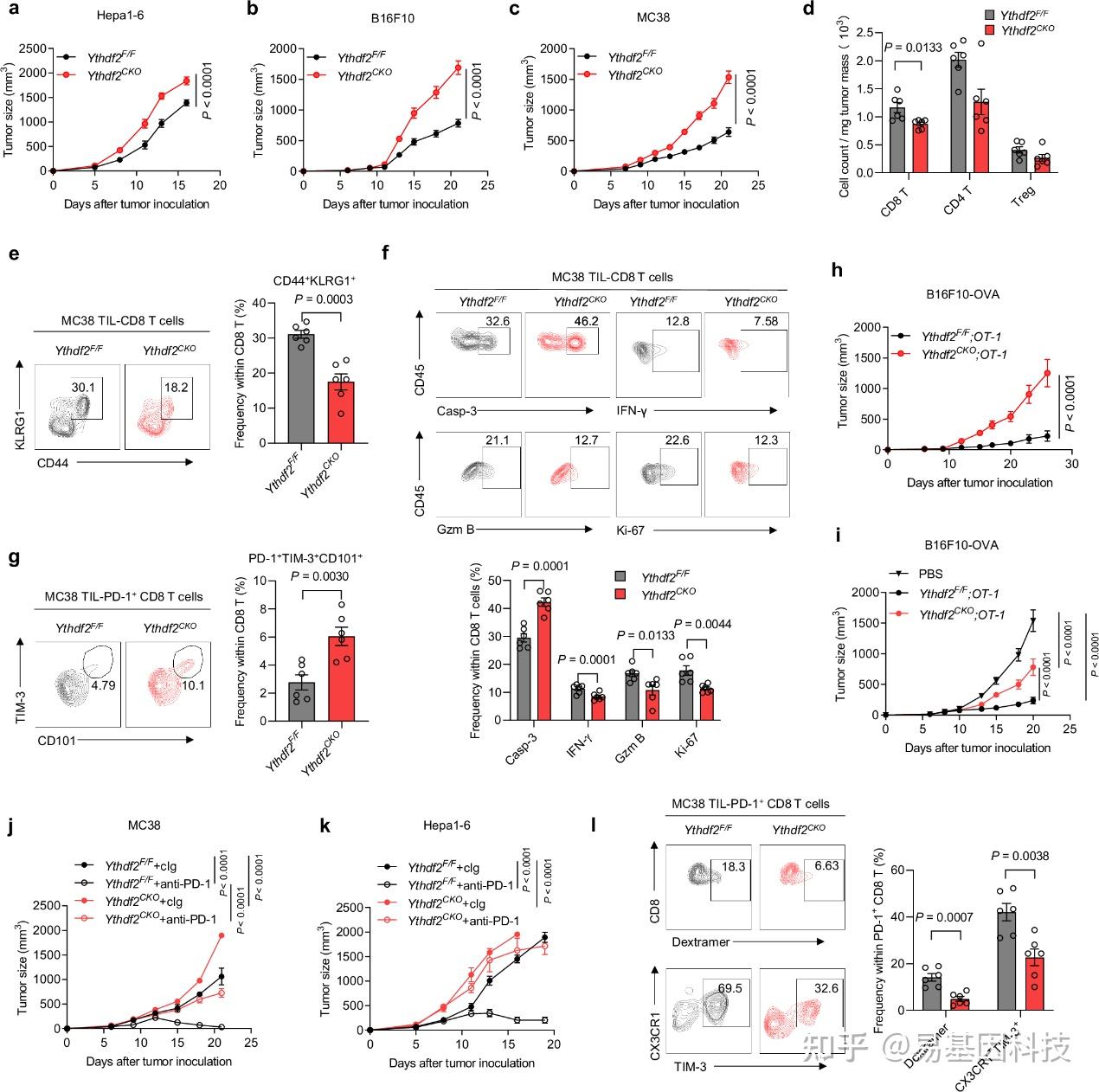
图2:YTHDF2对CD8 T细胞的抗肿瘤效应至关重要。
a. 雄性Ythdf2F/F(n=6)或Ythdf2CKO(n=6)小鼠皮下注射10^6 Hepa1-6细胞。
b. 雌性Ythdf2F/F(n=7)或Ythdf2CKO(n=5)小鼠皮下注射5×10^5 B16F10细胞。
c. 雌性Ythdf2F/F(n=5)或Ythdf2CKO(n=5)小鼠皮下注射10^6 MC38细胞。每2或3天监测一次肿瘤生长。
d-f. 从接种MC38肿瘤的Ythdf2F/F(n=6)和Ythdf2CKO(n=6)小鼠中分离出的肿瘤浸润性淋巴细胞(TIL),在肿瘤接种后第12天,通过流式细胞术评估TIL中T细胞亚群(CD8、CD4和调节性(Treg)T细胞)的数量(d),以及CD8 T细胞亚群中CD44+、KLRG1+阳性(e)、活化caspase-3(Casp-3)、颗粒酶B(Gzm B)、干扰素-γ(IFN-γ)或Ki-67阳性的频率(f)。
g. 从携带MC38肿瘤的Ythdf2F/F(n=6)和Ythdf2CKO(n=6)小鼠(第18天)中,通过流式细胞术评估PD-1+TIM3+CD101+的CD8 T细胞亚群频率。
h. 将雌性Ythdf2F/F;OT-1(n=8)或Ythdf2CKO;OT-1(n=6)小鼠皮下注射10^6 B16F10-OVA细胞,并监测肿瘤生长。
i. 采用PBS对照或OVA预激活的Ythdf2F/F;OT-1或Ythdf2CKO;OT-1 CD8 T细胞进行过继转移处理B16F10-OVA黑色素瘤(每组5只小鼠)。
j-k. 雌性Ythdf2F/F(n=12)或Ythdf2CKO(n=11)小鼠皮下注射10^6 MC38细胞(j)。雄性Ythdf2F/F(n=16)或Ythdf2CKO(n=12)小鼠皮下注射10^6 Hepa1-6细胞(k)。携带肿瘤的小鼠接受抗PD-1或cIg治疗。
l. 从接种MC38肿瘤并接受抗PD-1治疗的Ythdf2F/F(n=6)和Ythdf2CKO(n=6)小鼠中分离出的TIL,通过流式细胞术评估PD-1+Dextramer+、CX3CR1+Tim3+CD101-PD-1+ 的CD8 T细胞亚群频率。
(3)YTHDF2通过m6A依赖性RNA衰变预防T细胞线粒体功能障碍
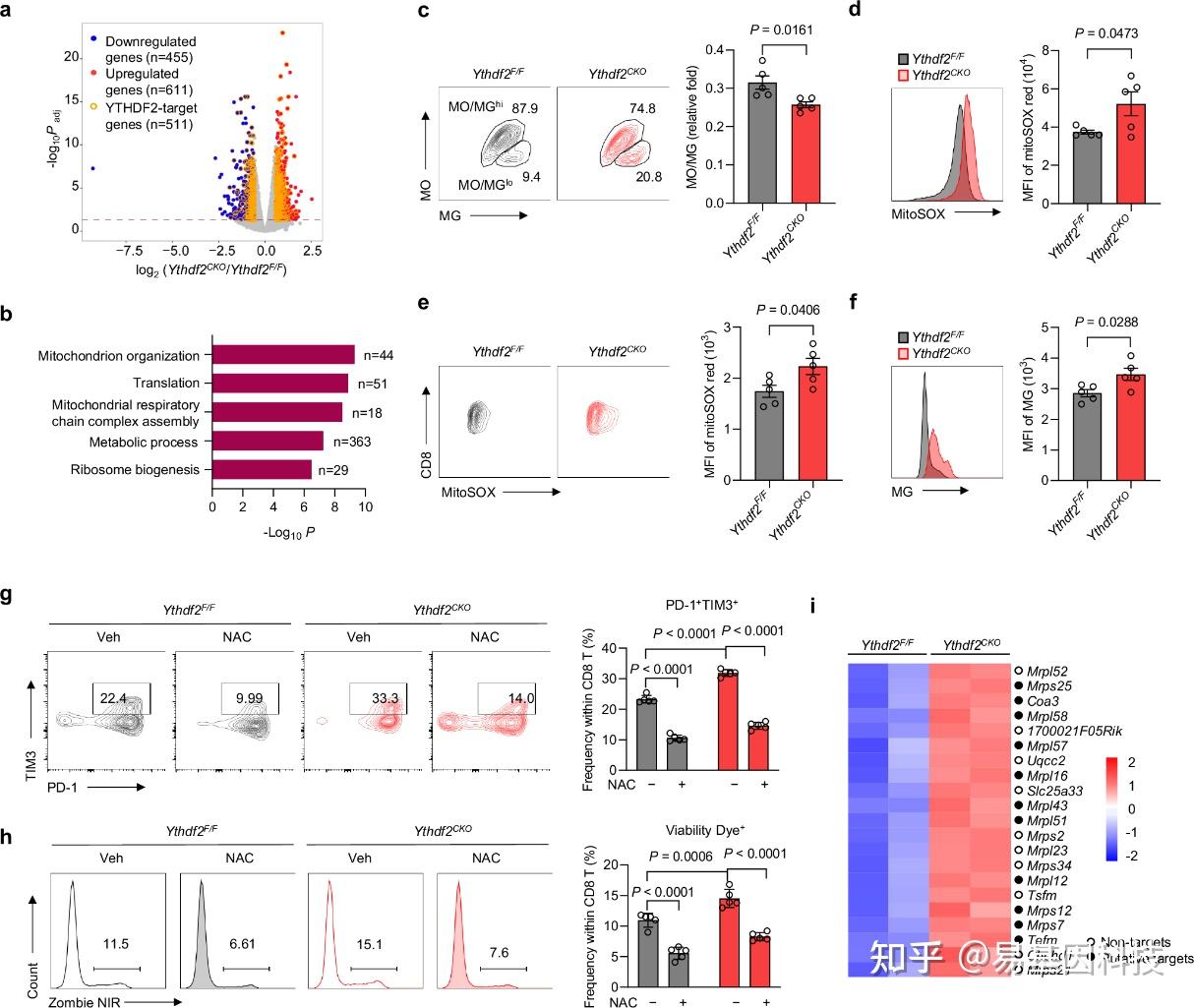
图3:YTHDF2通过m6A依赖性RNA衰变预防线粒体应激和T细胞耗竭。
a. 在激活的或Ythdf2CKO CD8 T细胞(抗CD3/CD28,5μg/ml,24小时)中的差异mRNA表达基因火山图(每个基因型2个样本)。显著上调或下调的基因分别用红色或蓝色点表示。在RIP-seq和m6A-seq中富集的潜在YTHDF2靶标用黄色圆圈标记。
b. 与Ythdf2F/F CD8 T细胞相比,在Ythdf2CKO CD8 T细胞中上调基因的GO富集分析(抗CD3/CD28,5μg/ml,24h后)。
c. 在激活的Ythdf2F/F(5个独立样本)和Ythdf2CKO(5个独立样本)CD8 T细胞中线粒体膜电位和线粒体质量通过MitoTracker Orange(MO)和MitoTracker Green(MG)染色测量。线粒体健康状况根据MO/MG比率评估。
d. 在Ythdf2F/F(5只小鼠)或Ythdf2CKO(5只小鼠)小鼠中激活的CD8 T细胞中线粒体活性氧(ROS)通过MitoSOX染色测量。
e. 在Ythdf2F/F(5只小鼠)和Ythdf2CKO(5只小鼠)小鼠的MC38肿瘤浸润性CD8 T细胞中MitoSOX染色。
f. 在Ythdf2F/F(5只小鼠)或Ythdf2CKO(5只小鼠)小鼠的MC38肿瘤浸润性CD8 T细胞中MG的MFI定量。
g, h. 在存在10 mΜ NAC或veh的情况下,Ythdf2F/F(5个独立样本)和Ythdf2CKO(5个独立样本)CD8 T细胞(抗CD3/CD28,5μg/ml,48小时)中Tim3+ PD-1+(g)和Zombie NIR+(h)频率定量。
i. 热图显示在激活的Ythdf2F/F和Ythdf2CKO CD8 T细胞中与线粒体相关且在Ythdf2CKO中上调的代表性基因相对表达。潜在的YTHDF2靶标用实心圆表示。
(4) YTHDF2螯合IKZF1/3以调控多功能CD8 T细胞中的活性染色质状态
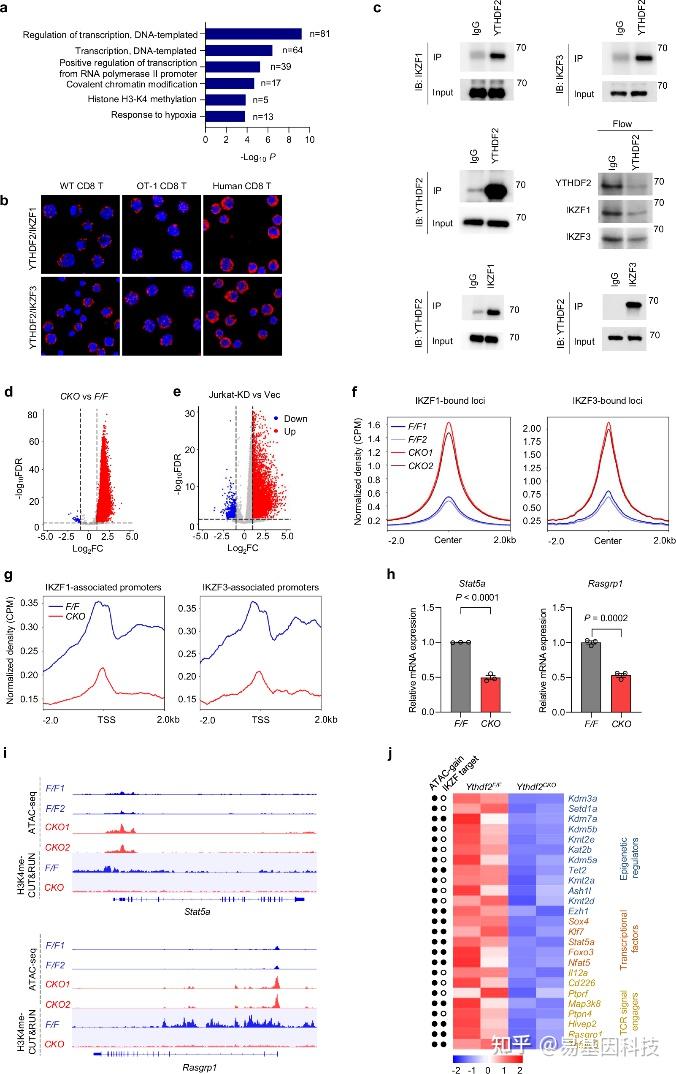
图4:YTHDF2螯合IKZF1/3以调控多功能CD8 T细胞活性染色质状态。
a. 在用抗CD3/CD28(5μg/ml,24小时)处理后,与Ythdf2F/F相比,Ythdf2CKO CD8 T细胞中下调基因的GO富集分析。
b. 在用抗CD3/CD28(5μg/ml,24小时)或OVA(10nM,24小时)刺激的小鼠(WT或OT-1)和人类CD8 T细胞中,YTHDF2与IKZF1或IKZF3相关联的邻近连接分析(PLA)分析。
c. 在用抗CD3/CD28(5μg/ml,24小时)处理的WT CD8 T细胞中,YTHDF2与IKZF1或IKZF3相关联的共免疫沉淀实验。
d. 在激活的Ythdf2F/F和Ythdf2CKO CD8 T细胞(抗CD3/CD28,5μg/ml,24小时)之间,基因的染色质可及性差异火山图。
e. 在Jurkat-shCtrl(Vec)和Jurkat-shYTHDF2(KD)细胞之间,基因的染色质可及性差异火山图。
f, g. 使用Cistrome Data Browser获得的小鼠T细胞中IKZF1(GSM1296538)和IKZF3(GSM803106)的ChIP-seq数据集。在IKZF1/3结合位点或IKZF1/3相关启动子上,激活的Ythdf2F/F和Ythdf2CKO CD8 T细胞的ATAC-seq(f)或H3K4me CUT&RUN(g)分析。
h. 在用抗CD3/CD28(5μg/ml,24小时)处理的激活的Ythdf2F/F(n=3独立样本)和Ythdf2CKO(n=3独立样本)CD8 T细胞中,通过RT-qPCR检测的Stat5a(左)和Rasgrp1(右)mRNA水平。
i. 在激活的Ythdf2F/F和Ythdf2CKO CD8 T细胞中,Stat5a(上)和Rasgrp1(下)基因位点上的ATAC-seq和H3K4me CUT&RUN分析。
j. 热图显示在激活的Ythdf2F/F和Ythdf2CKO CD8 T细胞中,RNA-seq数据中代表性基因(Ythdf2CKO中下调)的相对表达。增强的染色质可及性或潜在的IKZF1/3结合用实心圆表示。
(5)来那度胺挽救YTHDF2缺失型CD8 T细胞的多功能性
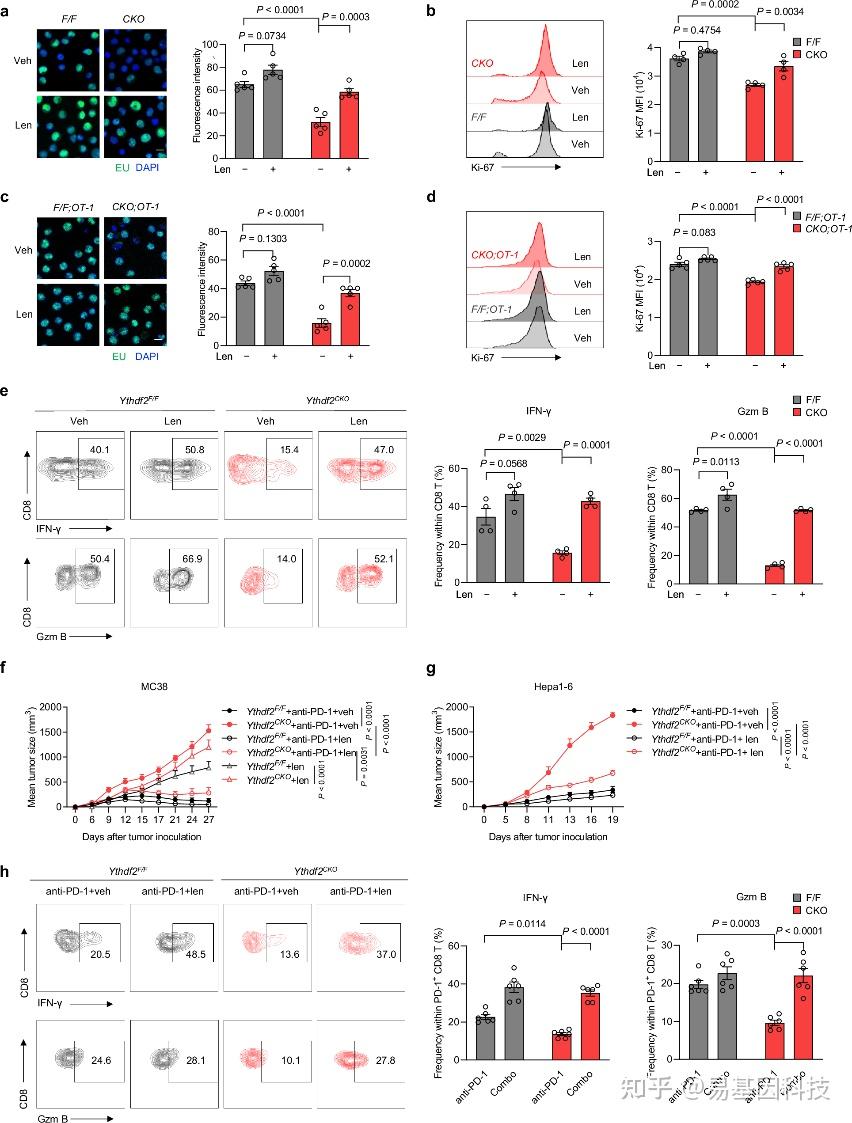
图5:来那度胺恢复了YTHDF2缺失的CD8 T细胞的抗肿瘤功能。
a. 10 μΜ来那度胺(len)或载体对照(veh)情况下,对Ythdf2F/F(n=5个独立样本)和Ythdf2CKO(n=5个独立样本)CD8 T细胞进行抗CD3/CD28(5μg/ml,24小时)刺激,使用Click-it RNA成像分析新生RNA合成(绿色)。
b. 10 μΜ来那度胺或对照情况下,对Ythdf2F/F(n=4个独立样本)和Ythdf2CKO(n=4个独立样本)CD8 T细胞进行抗CD3/CD28刺激,量化Ki-67 MFI。
c. 10 μΜ来那度胺或对照情况下,对Ythdf2F/F;OT-1(n=5个独立样本)和Ythdf2CKO;OT-1(n=5个独立样本)CD8 T细胞进行OVA(10nM,24小时)刺激,使用Click-it RNA成像分析新生RNA合成(绿色)。
d. 10 μΜ来那度胺或对照情况下,对Ythdf2F/F;OT-1(n=5个独立样本)和Ythdf2CKO;OT-1(n=5个独立样本)CD8 T细胞进行OVA(10nM,72小时)刺激,量化Ki-67 MFI。
e. 10 μΜ来那度胺或对照下,对Ythdf2F/F(n=4个独立样本)和Ythdf2CKO(n=4个独立样本)CD8 T细胞进行抗CD3/CD28(5μg/ml,48小时)刺激,量化Gzm B和IFN-γ MFI。
f. 携带MC38肿瘤的Ythdf2F/F(n=21)或Ythdf2CKO(n=18)小鼠接受抗PD-1(250μg/只小鼠)和/或来那度胺(10mg/kg)治疗,并监测肿瘤生长。
g. 携带Hepa1-6肿瘤的Ythdf2F/F(n=12)或Ythdf2CKO(n=12)小鼠接受抗PD-1(250μg/只小鼠)和/或来那度胺(10mg/kg)治疗,并监测肿瘤生长。
h. 从携带Hepa1-6肿瘤的Ythdf2F/F(n=6)或Ythdf2CKO(n=6)小鼠中分离出的肿瘤浸润性淋巴细胞(TILs)中,量化Gzm B+ CD8 T或IFN-γ+ CD8 T的频率,这些小鼠接受抗PD-1(250μg/只小鼠)和/或来那度胺(10mg/kg)治疗(第13天)。
(6)YTHDF2依赖于m6A结合的转录本进行核转位(nuclear translocation)
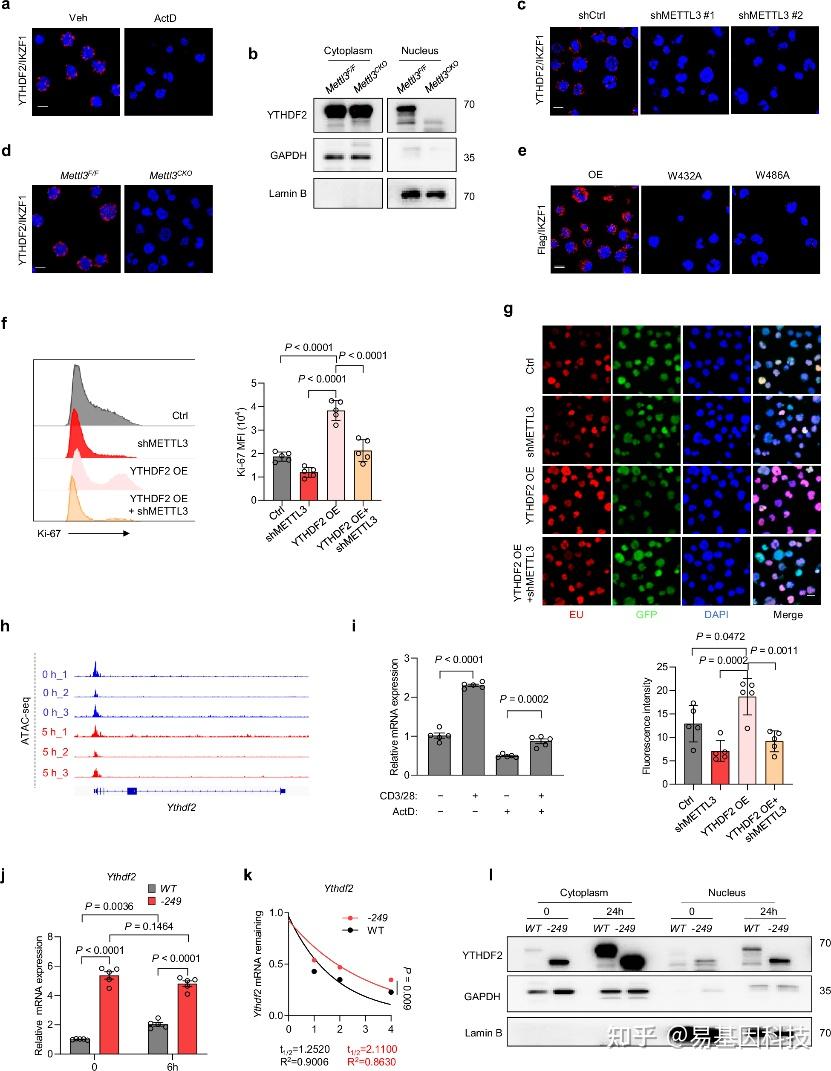
图6:m6A修饰机制调控YTHDF2的重新定位和表达。
a. 用或不用ActD(500μg/ml,4小时)处理的Jurkat细胞进行YTHDF2与IKZF3相关PLA分析。
b. 用抗CD3/CD28(5μg/ml,24小时)刺激的Mettl3F/F或Mettl3CKO CD8 T细胞的细胞质和细胞核中进行YTHDF2的免疫印迹分析。
c. 在Jurkat-shCtrl和Jurkat-shMETTL3细胞中进行YTHDF2与IKZF3相关PLA分析。
d. 用抗CD3/CD28(5μg/ml,24小时)刺激的Mettl3F/F或Mettl3CKO CD8 T细胞中进行YTHDF2与IKZF3相关PLA分析。
e. 在引入带有Flag标签的野生型或突变型YTHDF2的Jurkat细胞中,进行Flag与IKZF3相关联的PLA分析。
f. 在METTL3敲低和对照Jurkat细胞中,有或没有YTHDF2过表达(OE)的Ki-67 MFI的定量分析(5个独立样本)。
g. 在METTL3敲低和对照Jurkat细胞中,有或没有YTHDF2过表达(OE)的新生RNA合成的Click-it RNA成像分析(5个独立样本)。
h. 在naïve或激活的人类T细胞(抗CD3/CD28,5小时)中Ythdf2位点的ATAC-seq轨迹(GSE116696)。
i. 在用或不用抗CD3/CD28(5μg/ml)和ActD(500 μg/ml)刺激24小时的CD8 T细胞中,通过qPCR检测Ythdf2 mRNA水平(5个独立样本)。
j. 在naïve(0小时)或激活(6小时)的WT(5个独立样本)和Ythdf2 −249(5个独立样本)CD8 T细胞中通过qPCR检测Ythdf2 mRNA水平。
k. Naïve Ythdf2 −249(3个独立样本)和WT(3个独立样本)CD8 T细胞用ActD(500μg/ml)处理,并在ActD处理后的不同时间点收集RNA。通过qPCR检测Ythdf2 mRNA水平,并表示为转录抑制(TI)后剩余的mRNA。
l. 在naïve(0小时)或激活(24小时)的WT与Ythdf2 −249 CD8 T细胞的细胞质和细胞核中进行YTHDF2的免疫印迹分析。
(7)YTHDF2在人类肿瘤浸润性T细胞中的表达和分布。
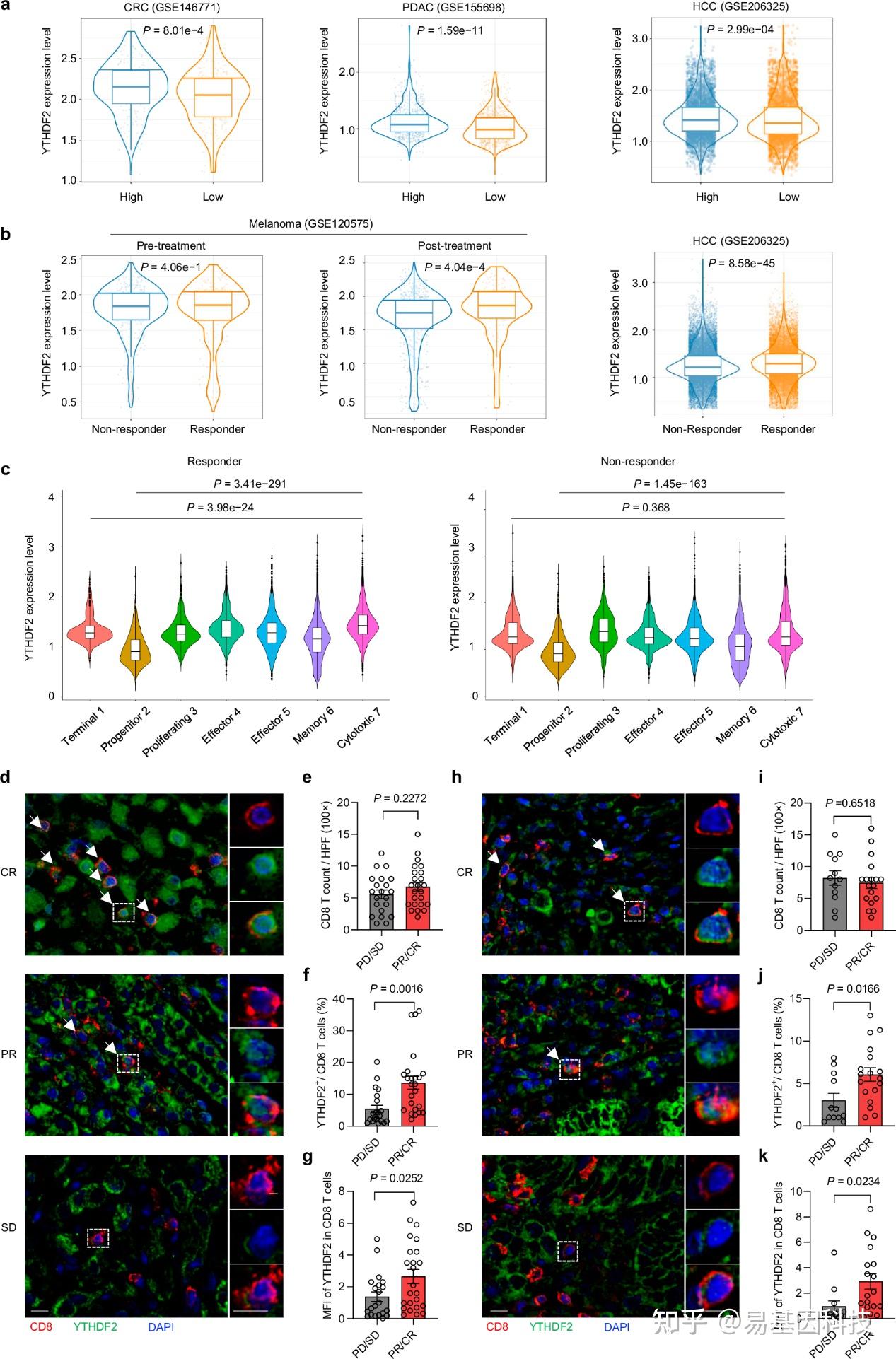
图7:人类癌症中YTHDF2的表达和分布与T细胞功能相关。
a. 小提琴图比较了根据单细胞RNA测序数据得出的高或低多功能性特征分数的CD8 T细胞中Ythdf2基因表达水平。左图,CRC(结直肠癌),n=10名患者。中间,PDAC(胰腺导管腺癌),n=20名患者。右图,HCC(肝细胞癌),n=31名患者。
b. 小提琴图比较了治疗前后应答和不应答CD8 T细胞中Ythdf2基因表达水平。左图,治疗前黑色素瘤,n=19(治疗前)或29(治疗后)。右图,HCC,n=31(治疗后)。
c. 小提琴图比较了接受新辅助抗PD-1治疗的HCC中生成的CD8 T细胞簇中Ythdf2基因表达水平。
d-i. 来自HCC(n=45名患者,d-g)或CRC(n=30名患者,h-k)的经治疗患者的组织切片被染色为CD8(红色)、YTHDF2(绿色)和DAPI(蓝色)。
d-h. 来自HCC(d)和CRC(h)患者的切片的代表性免疫荧光图像,显示对新辅助化疗(免疫)治疗的不同反应。虚线框表示底部单独通道显示的4倍放大区域。白色箭头指向YTHDF2和CD8阳性细胞。量化CD8 T细胞的数量(e, i),YTHDF2阳性CD8 T细胞的频率(f, j)以及CD8 T细胞中YTHDF2的强度(g, k)。CR,完全反应;PR,部分反应;SD,疾病稳定;PD,疾病进展。
研究小结:
本研究通过RIP-seq、RNA-seq、m6A-seq、ATAC-seq等分析揭示了YTHDF2在早期效应T细胞和效应样T细胞中选择性上调和重新分布;YTHDF2缺失加剧了肿瘤进展,并对小鼠和人类的PD-1阻断治疗无反应性;YTHDF2通过m6A依赖性RNA衰变预防线粒体功能障碍;YTHDF2与IKZF1/3互作促进T细胞多功能性;通过联合使用IKZF1/3抑制剂来那度胺,可以恢复YTHDF2缺失T细胞的免疫治疗效果。
本研究结果表明,YTHDF2通过协调表观遗传和转录网络来增强T细胞免疫,可能为治疗干预提供信息。YTHDF2表达和分布与人类肿瘤中T细胞功能相关,可能作为癌症预后的临床指标。
研究亮点:
- 揭示了YTHDF2在CD8 T细胞中的新功能,即通过m6A依赖性机制调控T细胞的抗肿瘤功能。
- 首次展示了YTHDF2在T细胞激活和治疗诱导核重新定位。
- 提出了YTHDF2与IKZF1/3互作新机制,这一发现可能对开发新的免疫疗法具有重要意义。
- 研究结果强调了YTHDF2在自然和ICB诱导的抗肿瘤免疫中的关键作用,并可能作为预测癌症治疗反应的生物标志物。
关于易基因RNA m6A甲基化测序(MeRIP-seq)技术
易基因MeRIP-seq技术利用m6A特异性抗体富集发生m6A修饰的RNA片段(包括mRNA、lncRNA等rRNA去除所有RNA),结合高通量测序,可以对RNA上的m6A修饰进行定位与定量,总RNA起始量可降低至10μg,最低仅需1μg总RNA。广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症发生与发展、药物应答等研究领域;可应用于动物、植物、细胞及组织的m6A检测。
大样本量m6A-QTL性状关联分析,传统MeRIP单个样品价格高,通常难以承担。易基因开发建立MeRIP-seq2技术,显著提成IP平行性,实现不同样本间相对定量,降低检测成本。
易基因提供适用于不同科研需求的MeRIP技术:
- m6A甲基化-常量mRNA 甲基化测序(MeRIP-seq)
- m6A甲基化-常量mRNA +lncRNA甲基化测序(lnc-MeRIP-seq)
- m6A甲基化-微量mRNA +lncRNA甲基化测序(Micro-lnc-MeRIP-seq)
- 高通量m6A甲基化-常量mRNA甲基化测序(MeRIP-seq2)
技术优势:
- 起始量低:样本起始量可降低至10-20μg,最低仅需1μg总RNA;
- 转录组范围内:可以同时检测mRNA和lncRNA;
- 样本要求:可用于动物、植物、细胞及组织的m6A检测;
- 重复性高:IP富集重复性高,最大化降低抗体富集偏差;
- 应用范围广:广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症的发生与发展、药物应答等研究领域。
研究方向:
m6A甲基化目前主要运用在分子机制的理论性研究
- 疾病发生发展:肿瘤、代谢疾病(如肥胖/糖尿病)、神经和精神疾病(如阿尔兹海默症/抑郁症)、炎症…
- 发育和分化:早期胚胎发育、个体/组织/器官生长发育、干细胞分化与命运决定、衰老
- 环境暴露与响应:污染、抗逆、生活方式
关于m6A甲基化研究思路
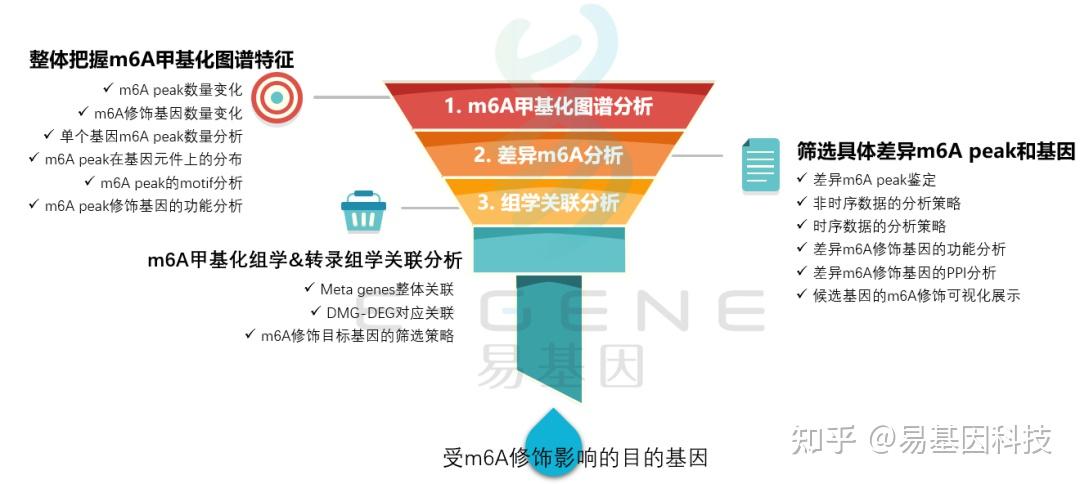
(1)整体把握m6A甲基化图谱特征:m6A peak数量变化、m6A修饰基因数量变化、单个基因m6A peak数量分析、m6A peak在基因元件上的分布、m6A peak的motif分析、m6A peak修饰基因的功能分析
(2)筛选具体差异m6A peak和基因:差异m6A peak鉴定、非时序数据的分析策略、时序数据的分析策略、差异m6A修饰基因的功能分析、差异m6A修饰基因的PPI分析、候选基因的m6A修饰可视化展示
(3)m6A甲基化组学&转录组学关联分析:Meta genes整体关联、DMG-DEG对应关联、m6A修饰目标基因的筛选策略
(4)进一步验证或后期试验
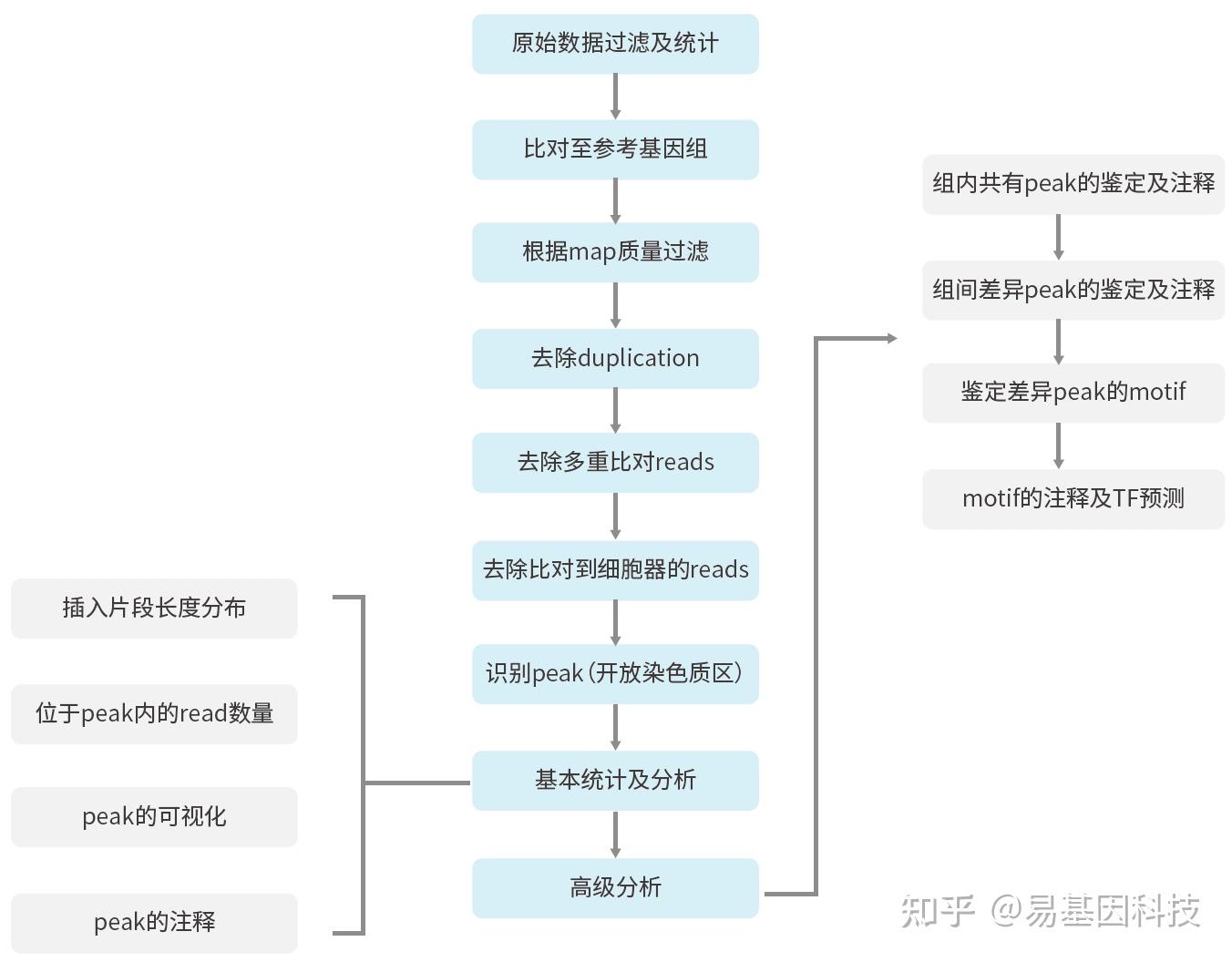
易基因染色质可及性-转座酶易接近染色质测序(ATAC-seq)
ATAC-seq(Assay for Transposase-Accessible Chromatin with high throughput sequencing)是通过使用高通量测序对转座酶可接近性核染色质区域进行分析的一种创新表观遗传学研究技术。该技术通过转座酶对某种特定时空下开放的核染色质区域进行切割,进而获得在该特定时空下基因组中所有活跃转录的调控序列。
真核生物的DNA并不是裸露的,而是被包装成核小体形成串珠状结构并进一步被折叠、包装。而基因的转录,需要将这种高级结构解开,使DNA成为可以使各种转录机器与其结合的裸露状态,即形成开放染色质区域。如何鉴定开放染色质区域呢?传统的方法主要是借助和DNase-Seq、MNase-Seq及ChIP-seq。但这些方法需要的起始细胞量较大,对于少量样本和珍稀样本可行性不高。ATAC-Seq是一种新型的研究开放染色质的技术,利用Tn5转座酶进入并切割裸露的DNA,并同时连接上特异性的测序接头。因为切割和加接头一步完成,因此该技术可大大降低所需细胞起始量。
技术优势:
(1)所需细胞起始量低。
(2)应用范围广,适用于大部分物种及细胞类型。
实验策略:

信息分析:
易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化)和表观转录组学(m6A、m5C、m1A、m7G、ac4C)、染色质结构与功能组学技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900。
参考文献:
Zhang H, et al. YTHDF2 upregulation and subcellular localization dictate CD8 T cell polyfunctionality in anti-tumor immunity. Nat Commun. 2024 Nov 5;15(1):9559. doi: 10.1038/s41467-024-53997-6.
相关阅读:
项目文章:MeRIP-seq+RNA-seq揭示家禽(鸡)脂肪沉积中的m6A RNA甲基化调控机制
项目文章 | MeRIP-seq揭示m6A修饰在肺动脉高压(PAH)发病机制中的潜在作用和新治疗靶点




【推荐】国内首个AI IDE,深度理解中文开发场景,立即下载体验Trae
【推荐】编程新体验,更懂你的AI,立即体验豆包MarsCode编程助手
【推荐】抖音旗下AI助手豆包,你的智能百科全书,全免费不限次数
【推荐】轻量又高性能的 SSH 工具 IShell:AI 加持,快人一步
· winform 绘制太阳,地球,月球 运作规律
· 超详细:普通电脑也行Windows部署deepseek R1训练数据并当服务器共享给他人
· 上周热点回顾(3.3-3.9)
· AI 智能体引爆开源社区「GitHub 热点速览」
· 写一个简单的SQL生成工具