易基因:Nature:WGBS揭示最全正常人类细胞类型的综合DNA甲基化图谱
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
DNA甲基化是一种基本的表观遗传标记,可以调控基因表达和染色质组装,从而为研究细胞身份和发育过程提供了重要视角。当前已有的数据集通常只包括部分甲基化位点,并且常常基于在培养过程中经历了巨大变化的细胞系,或者是基于包含未指定混合细胞的组织。
2023年,以色列耶路撒冷希伯来大学Tommy Kaplan等人基于深度全基因组亚硫酸盐测序(WGBS)对来自205个健康组织样本中分选的39种细胞类型的数千个独特标记进行片段级分析,构建了人类DNA甲基化图谱。研究发现,相同细胞类型的重复样本之间的相似性超过99.5%,显示出细胞身份程序对环境动态变化的稳健性(robustness)。相关研究成果以“A DNA methylation atlas of normal human cell types”为题发表在《自然》(Nature)期刊上。

题目:A DNA methylation atlas of normal human cell types
期刊:Nature
影响因子:50.5
技术平台:WGBS(易基因金牌技术)
本研究通过WGBS对不同细胞类型的DNA甲基化图谱进行无监督聚类分析,追溯到组织发育的关键因子,并鉴定出自胚胎发育起始的保守甲基化模式。研究揭示特定细胞类型中特异性未甲基化位点通常位于转录增强子中,并包含组织特异性转录调控因子的DNA结合位点。特异性高甲基化位点则较为罕见,且富含CpG岛、Polycomb靶点和CTCF结合位点,表明其在塑造细胞类型特异性染色质回路中可能发挥新作用。该图谱为研究基因调控和与疾病相关的遗传变异提供一个基本资源,并为液体活检中使用的潜在组织特异性生物标志物提供了大量可能性。
人类细胞类型的DNA甲基化图谱
为了绘制不同细胞类型中的全基因组DNA甲基化图谱,研究人员对205个样本(包括77种主要细胞类型)进行WGBS(平均深度至少为30×的150bp的配对末端测序)。所选样本经过仔细分选并比对到人类参考基因组(hg19,hg38),通过流式细胞术、基因表达和DNA甲基化分析鉴定平均样本纯度(所需细胞类型材料比例)超过90%。所分析的细胞类型(图1)代表了大多数主要的人类细胞类型,可以对生理系统(如胃肠道、造血细胞和胰腺)进行综合观察,以及比较不同环境中的类似细胞类型(如组织驻留的巨噬细胞)。
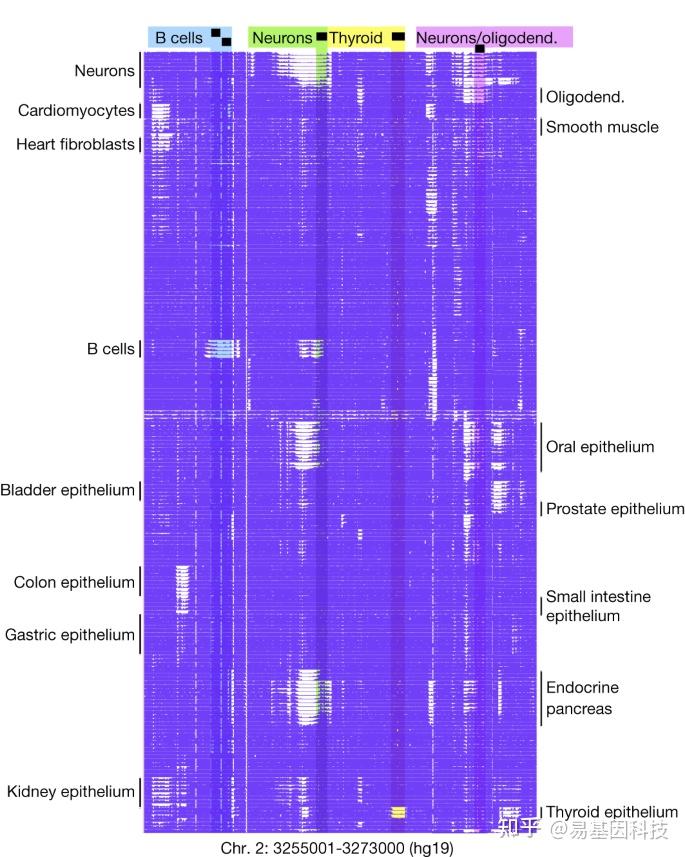
图1:成人人体的甲基化图谱。
在18kb区域中显示了344个CpG位点(列)上205个甲基化体(行)的DNA甲基化模式。突出显示的是B细胞(蓝色)、神经元(绿色)、甲状腺上皮(黄色)和神经元/少突胶质细胞(少突胶质)(粉红色)中未甲基化的区域。
205个甲基化图谱在重复样本中相似,而在不同细胞类型之间则以区块方式显著变化。研究人员在特定细胞类型中鉴定差异甲基化区域,以揭示细胞类型特异性的生物过程,定义细胞身份,并促进甲基化生物标志物的发展,以鉴定循环cfDNA片段的细胞起源。
研究人员开发了一个名为wgbstools的计算机器学习套件,用于分析WGBS数据,通过鉴定多个条件下DNA甲基化模式的变化点,将基因组切割成7104162个不重叠连续区块。每个区块跨越高度相关的CpG位点,在每个样本中甲基化程度相似,保留至少包含三个CpG位点的2783421个甲基化块(平均长度为544 bp),以及8个CpG位点。对这些紧凑的基因组进行稳健分析比单独CpG位点更为直接,并且由于甲基化的区域性质,可以被视为人类DNA甲基化的生物学“原子”。
甲基化记录发展历程
DNA甲基化模式不仅可以反映细胞的功能身份,还可以追溯其发展历程。为了鉴定早期祖先后代共有模式,研究人员计算了至少包含四个CpG位点的区块平均甲基化水平,并选择样本中的最高变异性区块(21000个区块,前1%)。使用无监督聚类分析对所有205个甲基化图谱进行聚类,系统地将相同细胞类型的生物学样本分组(图2),类似于纯化的人血细胞基于阵列的聚类。支持了细胞分离的可重复性,并表明每个正常细胞类型的三~四个重复足以检测其甲基化模式,可用于生物标志物鉴定等实际应用中。
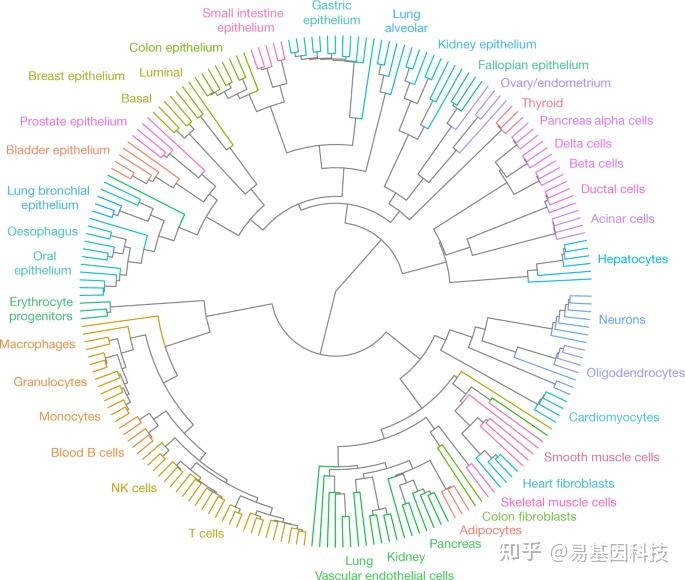
图2:无监督聚类揭示健康细胞类型的人类发育谱系。
细胞类型特异性甲基化标志物
接下来研究以细胞类型特异性方式差异甲基化的基因组区域,作者将205个样本分为39种特定细胞类型,每种细胞类型的前25个差异性未甲基化区域构成了一个包含1246个标记的人类细胞类型特异性甲基化图谱(图3)。这些区域在特定细胞类型中表现出特异性未甲基化(平均甲基化水平为13%),而在所有其他样本甲基化(平均甲基化水平为91%),可以作为敏感的生物标志物,用于定量混合物中特定细胞类型。这些标记包括953个细胞类型特异性未甲基化位点,以及另外293个在少数相关细胞类型中未甲基化的位点。
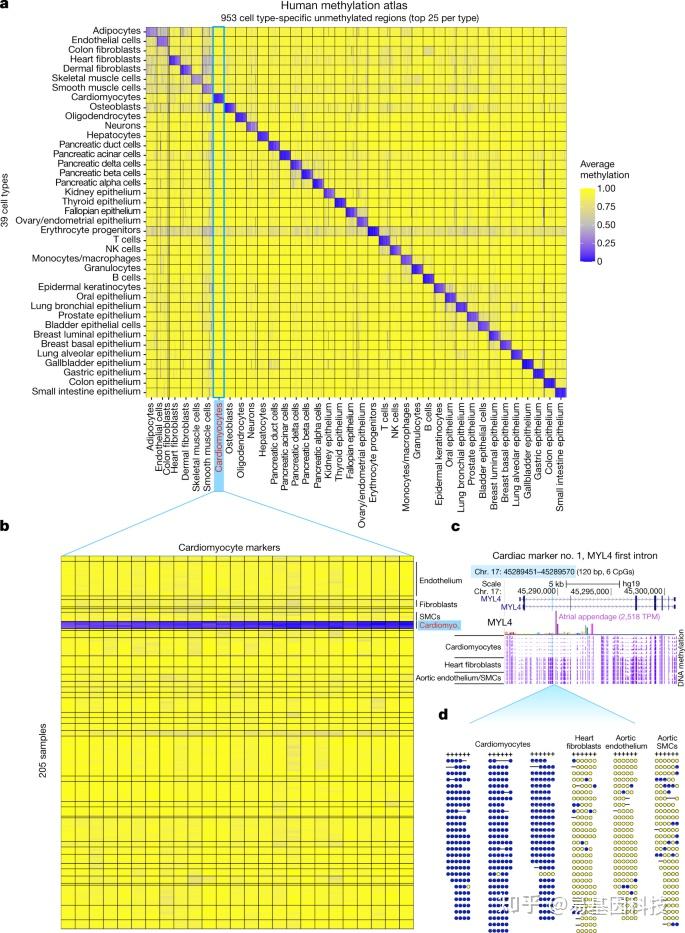
图3:39种细胞类型共205个样本的人类甲基化图谱。
- 总共有953个基因组区域以细胞类型特异性方式未甲基化。图中的每个单元格标记了39个细胞类型(行)中每个基因组区域(列)的平均甲基化水平。每个细胞类型显示多达25个区域,每个区域的平均长度为356 bp(9个CpG位点)。
- 心肌细胞的前25个区域。每个区域绘制了图谱中所有29种细胞类型205个样本中每个CpG位点(列)的平均甲基化水平。
- 心肌细胞特异性未甲基化位点。浅蓝色高亮标记为120 bp(6个CpG位点),位于MYL4基因的第一个内含子中,MYL4是一个心脏特异性基因(心房附属物TPM表达量为2518)。基因组快照显示六个心肌细胞样本、四个心脏成纤维细胞样本和三个主动脉样本(两个内皮细胞和一个平滑肌细胞)的平均甲基化水平(紫色轨迹)。
- 三个心肌细胞样本、一个心脏成纤维细胞样本和两个主动脉样本(内皮细胞和平滑肌细胞)的亚硫酸盐转化片段可视化。黄色和蓝色点分别表示甲基化和未甲基化的CpG位点。
人类细胞类型特异性调控图
接下来,研究人员表征这些细胞类型特异性差异未甲基化区域。分别利用转座酶可及染色质测序(ATAC-seq)、DNase I超敏位点测序(DNaseI-seq)分析细胞类型特异性标记的DNA可及性和染色质状态。分析结果表明,单核细胞和巨噬细胞中前250个未甲基化标记高度可及,并且以单核细胞中的H3K27ac和H3K4me1为特征,而其他细胞类型标记在单核细胞中没有富集,同时还揭示了细胞类型特异性标记chromHMM增强子注释的强烈协调富集(图4a)。这些发现与之前将组织特异性去甲基化与基因增强子联系起来的研究一致。
为进一步评估细胞类型特异性未甲基化区域的生物学重要性,作者研究了它们与转录因子(TFs)的关联。使用每种细胞类型前1000个未甲基化标记进行motif分析,计算这些标记所富集的TF结合motif,研究结果表明对于大多数细胞类型,Top motifs包括主调控因子和关键TFs(图4b)。例如,B细胞富含Ebf2/HEB/E2A,粒细胞富含CEBP/AP1/ETS,T细胞富含ETS/RUNX。细胞类型特异性未甲基化区域与TF结合motif之间的关联可以鉴定新的基因调控回路,并暴露在特定细胞类型中活跃的远端增强子。
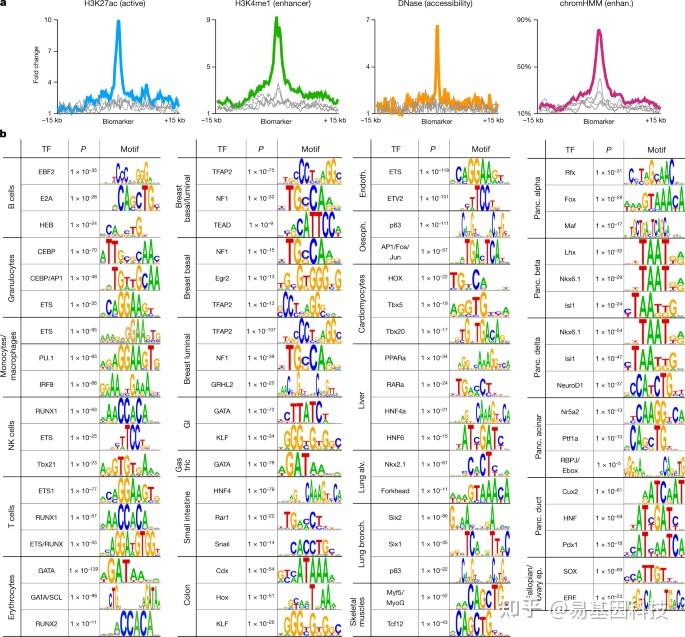
图4:作为潜在增强子的细胞类型特异性标记。
- 单核细胞/巨噬细胞的前250个细胞类型特异性未甲基化标记,显示了活性调控标记H3K27ac、增强子标记H3K4me1、DNA可及性和chromHMM增强子注释的平均ChIP-seq信号。作为比较,其他血细胞类型(粒细胞和B、T及NK细胞)的前250个标记的平均信号以灰色线条显示。
- 细胞类型特异性标记调控motif的富集。显示每个细胞类型中前1000个差异性未甲基化区域富集的top转录因子结合位点motif。
细胞类型特异性高甲基化位点
作者研究了在一种细胞类型中甲基化而在人体其他部位未甲基化的基因组区域(即特异性高甲基化区域),这些区域富含CpG岛且在其他细胞类型中被H3K27me3和Polycomb标记(图5a-c)。
在综合分析所有细胞类型特异性高甲基化区域后,结果揭示特异性高甲基化区域对染色质调节因子CTCF的靶向序列强富集(图5d),表明CTCF结合位点的DNA甲基化可能作为组织特异性调控开关来调控其结合,可能影响组织特异性的三维基因组。为了验证这一假设,作者比较了CTCF位点的DNA甲基化模式与特定组织中全基因组CTCF蛋白结合模式(图5e),结果显示在结肠和肠道特异性甲基化位点的甲基化模式和已发表的体内CTCF占有情况。与DNA甲基化抑制CTCF结合一致,ChIP数据显示结肠中这个位点CTCF结合的选择性丢失。此外,在特定细胞类型中甲基化位点富集了神经基因的转录抑制因子RE1-沉默TF/神经元限制性沉默因子(REST/NRSF)的靶标,且在胰岛细胞的甲基组中最突出(图5f)。
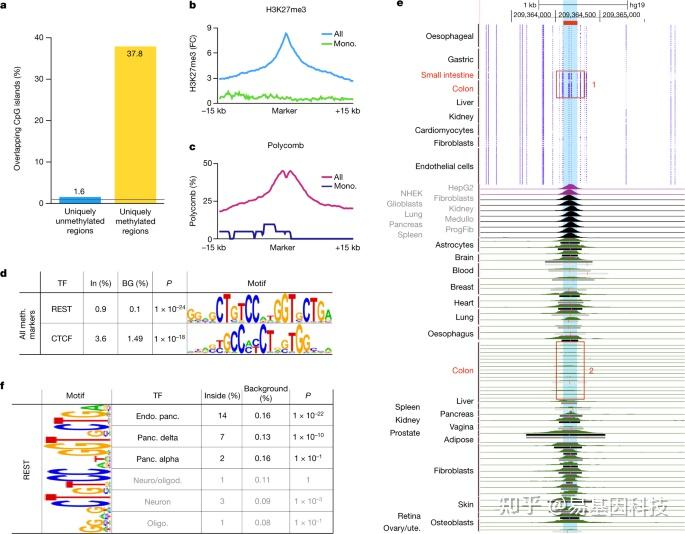
图5:细胞类型特异性高甲基化区域富集于CpG岛、Polycomb靶点以及CTCF和REST/NRSF。
- Top细胞类型特异性高甲基化标记中有38%(3,613个中的1363个)与CpG岛重叠。
- 这些区域通常在其他细胞类型中富含H3K27me3。
- 单核细胞和巨噬细胞中的Polycomb注释(chromHMM),包括所有或单核细胞/巨噬细胞特异性标记。
- 细胞类型中前100个细胞类型特异性高甲基化区域的motif分析鉴定出已知CTCF和REST/NRSF motif。
- 对hg19位点(chr. 1: 209364093–209364250)的ChIP-seq数据分析,该位点在小肠和结肠上皮中特异甲基化(红框1),在其他地方未甲基化。
- 在内分泌胰腺中,前100个细胞类型特异性高甲基化区域中有14%存在REST/NRSF motif,顶级delta细胞标记中有7%,顶级alpha细胞标记中有2%,与背景序列中大约0.1%相比,这与内分泌胰腺中REST靶标表达一致。
片段级甲基化组反卷积
图6:使用细胞类型特异性生物标志物的片段级反卷积。
易小结:
本研究通过WGBS绘制了人类原代细胞类型的全面DNA甲基化图谱,筛选出一套广泛的细胞类型特异性标记,并开发出一套用于混合细胞类型样本片段级分析的计算工具。这些工具的开发补充了现有的大量基于芯片阵列甲基化图谱和去卷积工具,也可用于分析阵列数据。这些数据共同揭示了DNA甲基化在细胞生物学和基因调控中的作用,并促进了在每种细胞类型中活跃的增强子的鉴定。本研究的图谱最有前景的用途可能是混合细胞类型样本的片段级去卷积,允许在癌症和其他疾病患者的血浆中高灵敏度的鉴定cfDNA的起源组织。
关于易基因全基因组重亚硫酸盐测序(WGBS)
全基因组重亚硫酸盐甲基化测序(WGBS)可以在全基因组范围内精确的检测所有单个胞嘧啶碱基(C碱基)的甲基化水平,是DNA甲基化研究的金标准。WGBS能为基因组DNA甲基化时空特异性修饰的研究提供重要技术支持,能广泛应用在个体发育、衰老和疾病等生命过程的机制研究中,也是各物种甲基化图谱研究的首选方法。
易基因全基因组甲基化测序技术通过T4-DNA连接酶,在超声波打断基因组DNA片段的两端连接接头序列,连接产物通过重亚硫酸盐处理将未甲基化修饰的胞嘧啶C转变为尿嘧啶U,进而通过接头序列介导的 PCR 技术将尿嘧啶U转变为胸腺嘧啶T。
应用方向:
WGBS广泛用于各种物种,要求全基因组扫描(不错过关键位点)
- 全基因组甲基化图谱课题
- 标志物筛选课题
- 小规模研究课题
技术优势:
- 应用范围广:适用于所有参考基因组已知物种的甲基化研究;
- 全基因组覆盖:最大限度地获取完整的全基因组甲基化信息,精确绘制甲基化图谱;
- 单碱基分辨率:可精确分析每一个C碱基的甲基化状态。

易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化)和表观转录组学(m6A、m5C、m1A、m7G、ac4C)、染色质结构与功能组学技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900。
参考文献:
Loyfer N, et al. A DNA methylation atlas of normal human cell types. Nature. 2023 Jan;613(7943):355-364. pii: 10.1038/s41586-022-05580-6. doi: 10.1038/s41586-022-05580-6. PubMed PMID: 36599988.
相关阅读:
项目文章 | WGBS+RNA-seq揭示松材线虫JIII阶段形成过程中的DNA甲基化差异
Cell|易基因微量DNA甲基化测序助力中国科学家成功构建胚胎干细胞嵌合体猴,登上《细胞》封面


