易基因:多组学分析揭示围产期IL-6动物模型肾脏发育过程中的DNA甲基化+基因表达调控网络|Cells
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因,
慢性肾脏病(Chronic kidney disease,CKD)是全球发病率和死亡率的主要原因之一。母体肥胖与系统性炎症和促炎细胞因子白细胞介素-6(Interleukin-6,IL-6)水平升高有关。此前研究证明妊娠期间母体 IL-6 增加会影响小鼠的宫内发育。但母体肥胖的环境影响导致肾脏发育过程中改变的具体分子变化尚不完全清楚。高通量组学技术的最新进展允许对生物样品的基因组、表观基因组、蛋白质组学和代谢组学方面进行全面分析。
近日,美国密苏里大学哥伦比亚分校Trupti Joshi团队假设IL-6诱导的炎症会改变发育中胎儿的基因表达,从而影响肾脏发育。研究人员结合 mRNA 测序、 miRNA 测序和全基因组亚硫酸盐测序 (WGBS)的多组学分析,以探讨宫内暴露于 IL-6 对新生幼儿基因表达的肾脏发育过程中的变化,并阐明关键的生物过程和网络。相关研究成果以“Employing Multi-Omics Analyses to Understand Changes during Kidney Development in Perinatal Interleukin-6 Animal Model”为题发表在《Cells》期刊上。

标题:Employing Multi-Omics Analyses to Understand Changes during Kidney Development in Perinatal Interleukin-6 Animal Model(多组学分析揭示围产期 IL-6 动物模型肾脏发育过程中的变化)
期刊:Cells
影响因子:5.1
技术平台:mRNA-seq、 miRNA-seq、WGBS(易基因金牌技术)
研究人员在妊娠中期对怀孕雌鼠给予IL-6或生理盐水处理。使用mRNA测序、miRNA测序和全基因组亚硫酸盐测序(WGBS)分析新生小鼠肾脏。采用多组学方法来量化mRNA基因表达、miRNA表达和DNA甲基化,使用先进的生物信息学和数据整合技术分析鉴定出19个在多个组学数据集中存在的关键候选基因,这些基因受表观遗传学和miRNA调控。研究人员为这些基因构建调控网络,揭示了诸如甘露糖型O-糖基化、细胞周期、凋亡和FoxO信号等通路的破坏。分析结果表明Atp7b基因受DNA甲基化和miR-223靶向调控,而Man2a1基因受DNA甲基化调控,涉及能量代谢。这些研究结果揭示这些基因可能在胎儿编程中发挥作用,由于妊娠炎症,可能导致晚年CKD发生。
分析数据:
- mRNA-seq测序,鉴定出2361个上调和2518个下调基因。
- miRNA-seq测序,鉴定出24个上调和13个下调的miRNA。
- WGBS共鉴定出81,261,444个甲基化区域,其中612个区域高甲基化,533个区域低甲基化。
- 多组学数据综合分析,共鉴定出19个关键基因,这些基因在多个组学数据集中存在,受表观遗传学和miRNA调控。
结果图形:
(1)暴露于宫内白细胞介素-6(IL-6)的新生小鼠肾脏的转录组分析
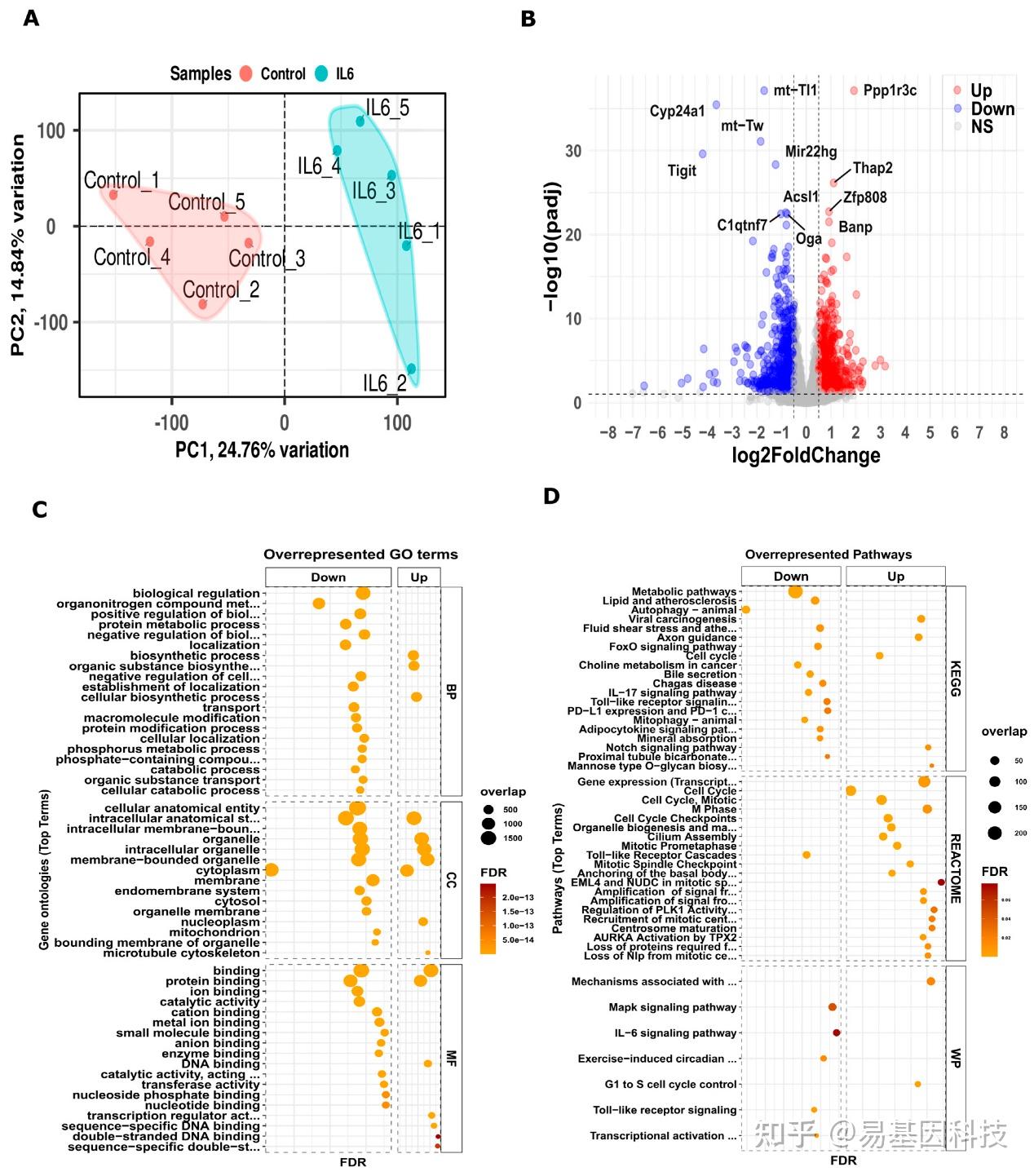
图1:暴露于发育期IL-6的新生小鼠肾脏转录组中的差异表达基因。
A. 对照组和IL-6样本的PCA分析,第一主成分(PC1)在x轴上,第二主成分(PC2)在y轴上。
B. 火山图,以log2FC在x轴上和p值在y轴上。红色和蓝色表示差异表达基因的变化。
C. 基因的GO富集分析。
D. KEGG、Reactome和Wiki通路中的富集通路。
(2)暴露于宫内IL-6的新生小鼠肾脏中的miRNA及其与靶基因的互作。
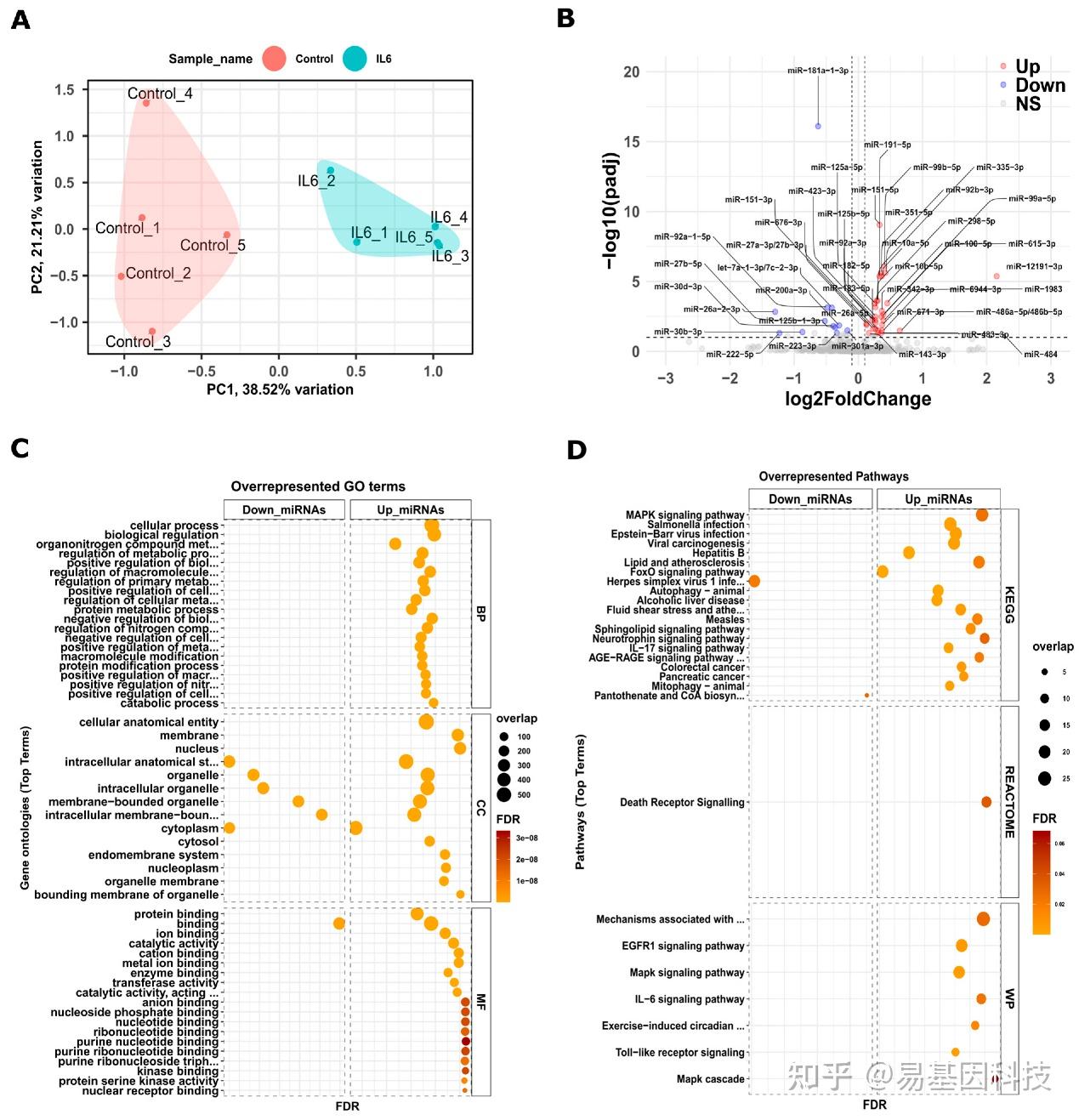
图2:暴露于发育期IL-6的新生小鼠肾脏中差异表达的miRNA。
A. 对照组和IL-6样本的PCA分析
B. 火山图,红色和蓝色表示差异表达的miRNA(DEmiRs)的变化,上调的miRNA用红点表示,下调的用蓝点表示。灰色点表示不显著。
C. 下调和上调的miRNA基因富集图。
D. KEGG、Reactome和Wiki通路中的富集通路。
(3)暴露于宫内IL-6的新生小鼠肾脏的全基因组亚硫酸盐测序(WGBS)分析
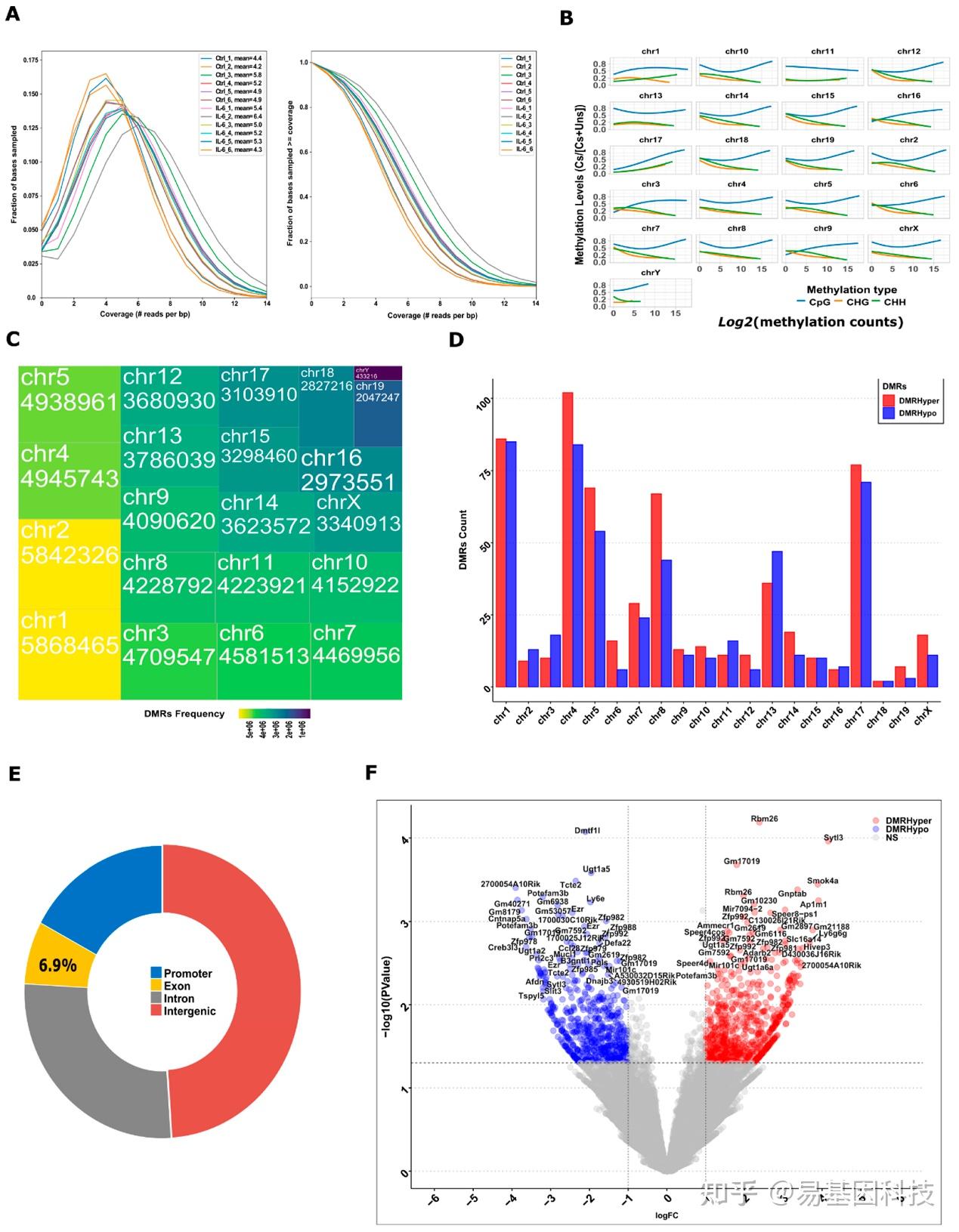
图3. 暴露于发育期IL-6的新生小鼠肾脏的全基因组甲基化分析。
A. 每个样本的碱基甲基化reads覆盖。
B. 基于甲基化CpG、CHG和CHH水平(范围在0.0~1.0)和甲基化计数的基因组中甲基化碱基的全基因组和染色体水平计数。CpG、CHG和CHH甲基化的染色体范围覆盖度。
C. 基因组中甲基化碱基计数在染色体间的分布。
D. 基于甲基化类别在单个小鼠染色体上的DMRs分布。基于甲基化类别在染色体上的DMRs分布。
E. 根据染色体位置将DMRs分为间隔区和内基因区。启动子和基因体区域差异甲基化基因的基因富集图。
F. IL-6中差异甲基化碱基火山图。红色和蓝色点分别表示高甲基化和低甲基化碱基。
(4)暴露于宫内IL-6的新生小鼠肾脏中的miRNA驱动调控网络
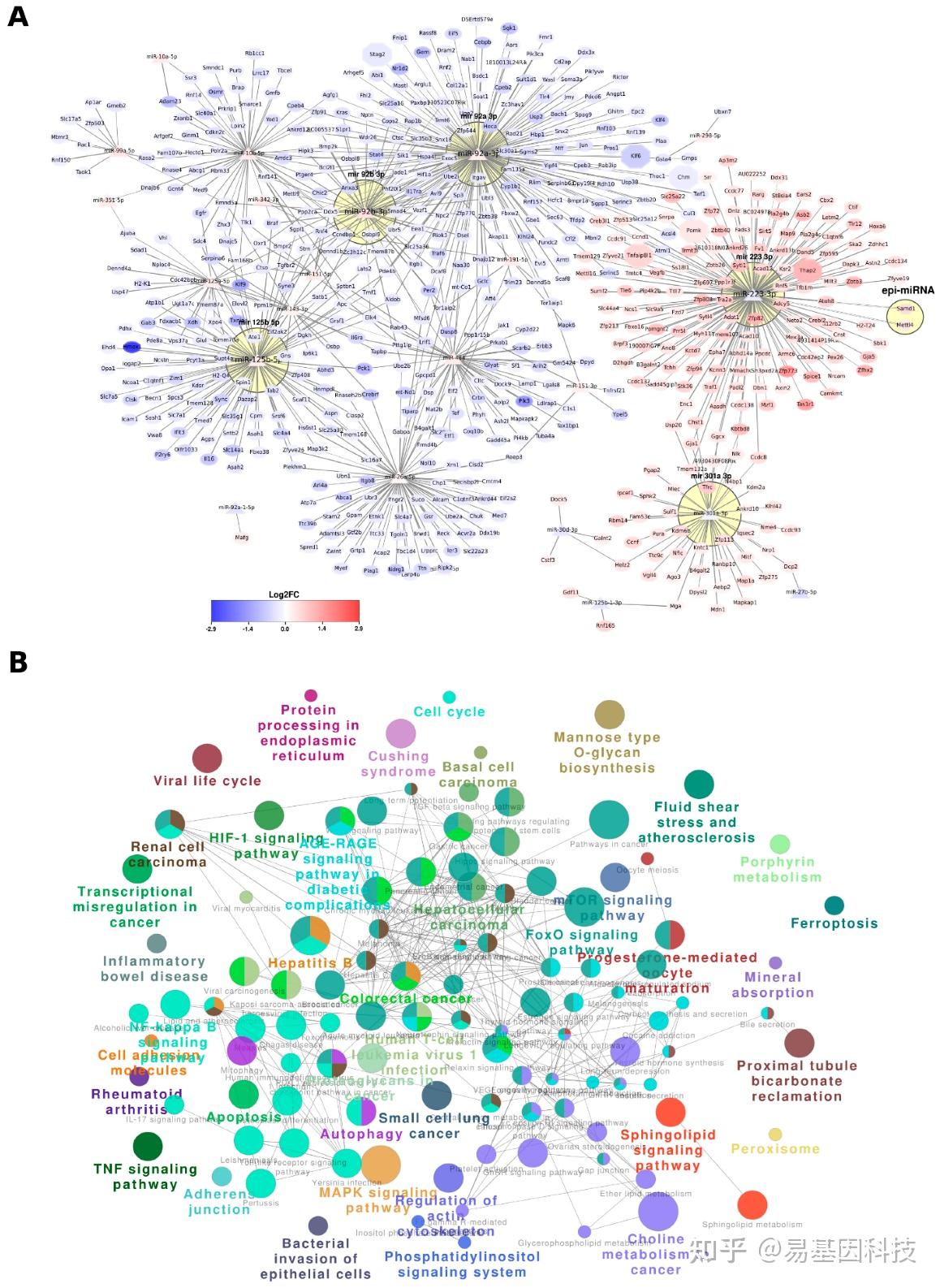
图4. miRNA调控网络
A. 基于多组学分析和靶基因构建miRNA的调控网络。使用反相关性,三角形节点代表miRNA,六边形形状代表与一组19个基因重叠的基因,圆形代表其他靶基因。miRNA簇用黄色圆圈注释,颜色范围基于差异表达的Log2FC值。
B. 从ClueGo分析中为KEGG和Reactome通路创建由miRNA调控的功能网络,统计显著性p值<0.05。网络中的每个簇用多种特定颜色填充,代表生物学功能,共有功能由节点的多种颜色表示。
(5)整合新生小鼠肾脏中三个多组学数据集:暴露于宫内IL-6的研究
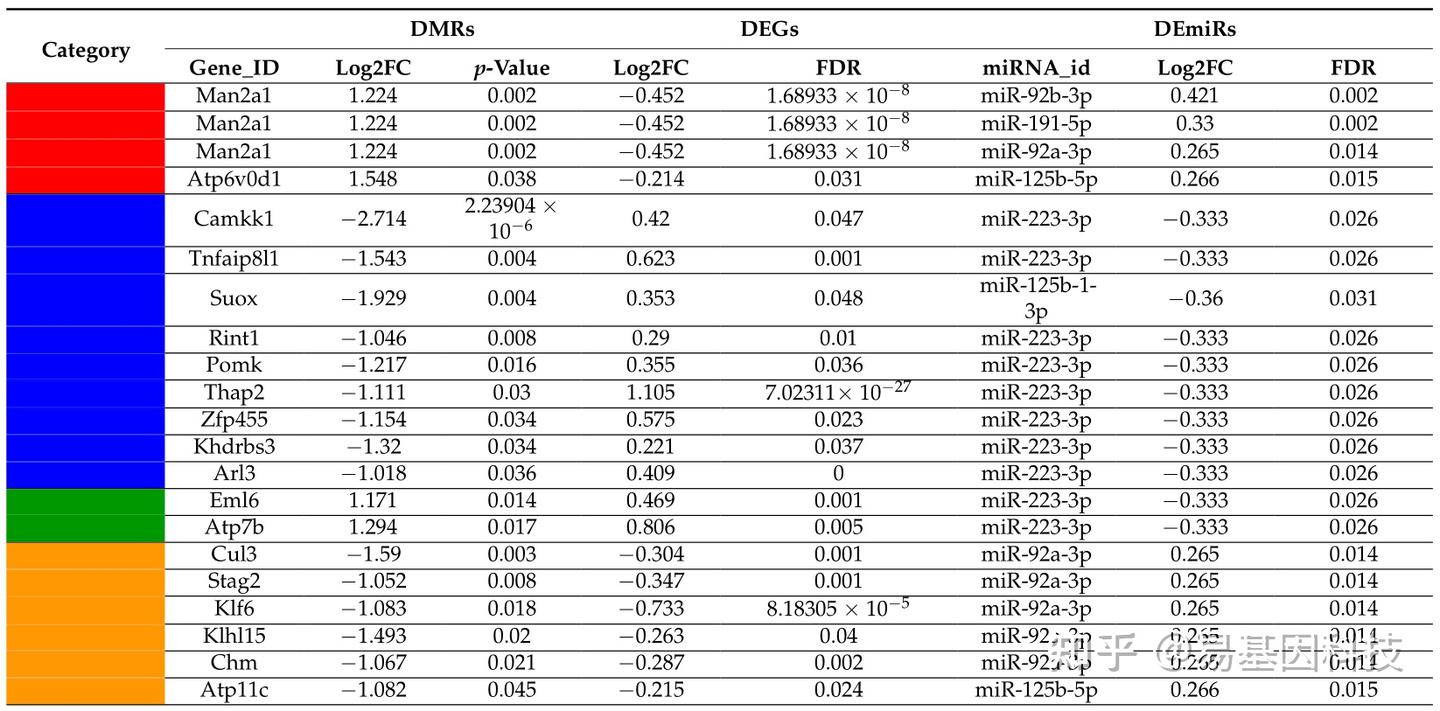
表1:在整合多组学数据集中鉴定出的19个差异表达基因(DEGs),以及其在启动子区域的甲基化状态和相关的靶向差异表达miRNA(DEmiRs)。表中将高甲基化DMRs和上调DEmiRs相关的下调基因显示为红色,将低甲基化DMRs和下调DEmiRs相关的上调基因显示为蓝色,将高甲基化DMRs和下调DEmiRs相关的上调基因显示为绿色,将低甲基化DMRs和上调DEmiRs相关的下调基因显示为橙色。
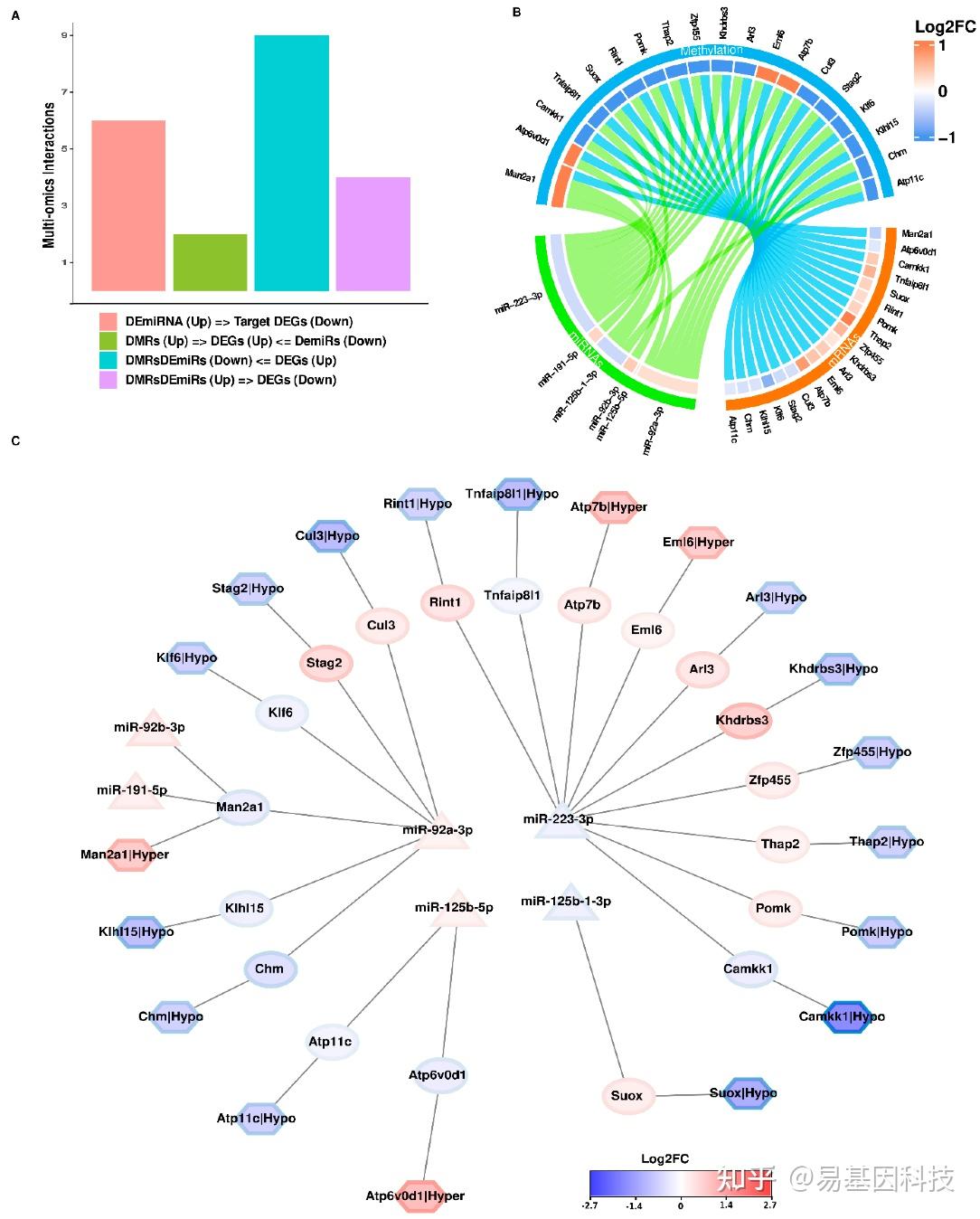
图5:对三组组学测序数据中IL-6处理效应的整合和比较分析。
A. 多组学数据集的总结,以及基因与其相关的甲基化水平和miRNA之间的差异甲基化/表达相互作用。
B. 多组学差异甲基化表达基因和miRNA的log2FC值圆形图。
C. 在整合其差异状态后构建的调控互作的调控网络。六边形节点表示差异甲基化基因(基于启动子),矩形形状表示DEGs,三角形表示DEmiRs。
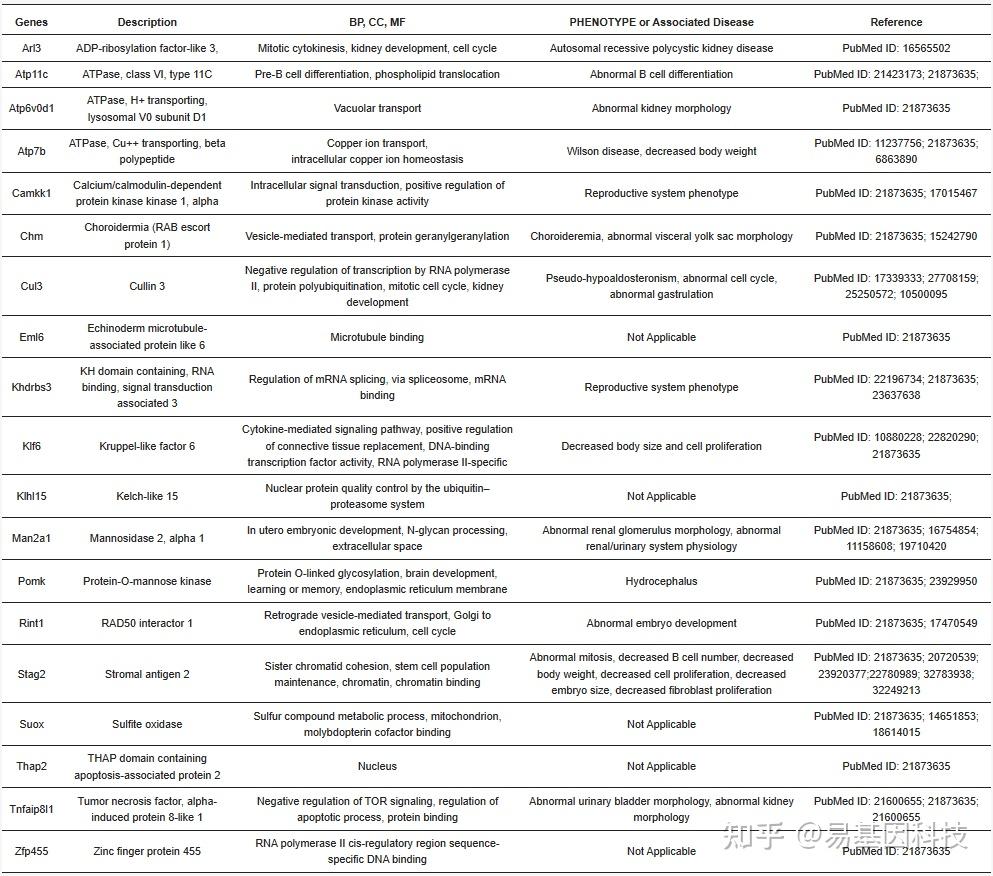
表2:在整合多组学数据集后鉴定出的19个基因的功能作用,这些基因的功能从生物过程(BP)、细胞组分(CC)、分子功能(MF)、表型或相关疾病中得出。
(6)对多组学数据集分析中鉴定的 19 个基因进行基于共表达的功能网络分析
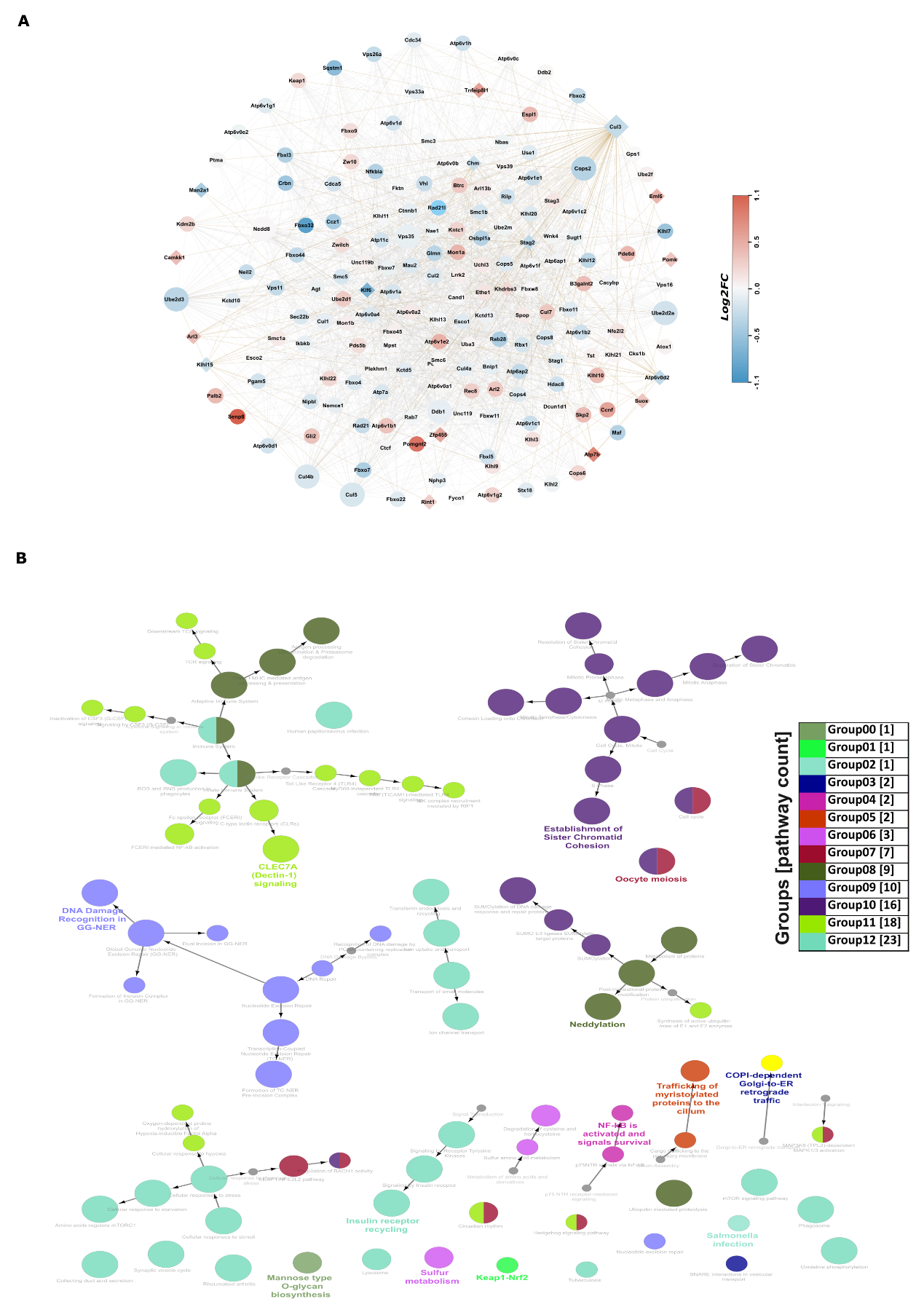
图6:多组学中19个基因的功能蛋白-蛋白网络。
A. 为这19个基因构建一个包含两层的蛋白质-蛋白质互作(PPI)网络,菱形节点表示多组学数据集中的基因,圆形节点表示与之相连的PPI。红色和蓝色比例基于RNA测序中基因的差异表达,节点大小基于外连接的数量。
B. 使用ClueGO中的KEGG和Reactome通路为PPI网络构建有方向的功能富集网络。
(7)整合多组学数据集后的结果验证
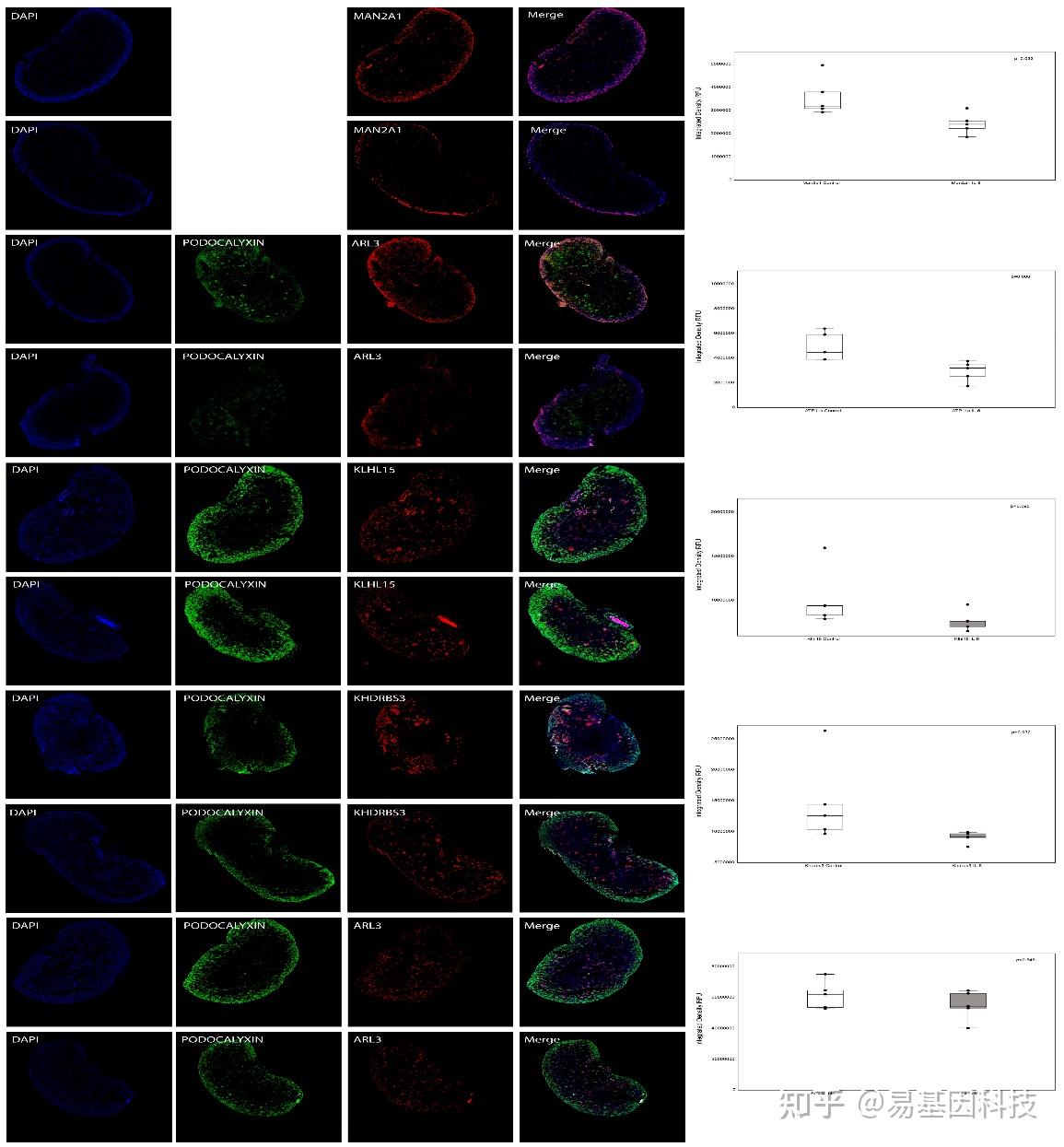
图7:母体暴露于IL-6或生理盐水(对照组)的新生小鼠肾脏的免疫荧光显微镜检测,每组n=5。展示了Man2a1(α-甘露糖苷酶2)、Klhl15(Kelch样蛋白15)、Khdrbs3(含有KH结构域的RNA结合信号相关蛋白3)、Atp11c(ATPase VI型11C)和Arl3(ADP-核糖基化因子样蛋白3)的免疫荧光染色结果。肾小球用podocalyxin(绿色荧光)染色,而Man2a1、Klhl15、Khdrbs3、Atp11c和Arl3用红色荧光染色。未对Man2a1进行podocalyxin染色。所有共聚焦图像均在固定的采集设置下拍摄。箱线图显示了荧光强度分析,中位数和箱子代表四分位范围(25%至75%),95%数据在须的范围内。Wilcoxon-Mann-Whitney检验评估两组之间的差异。
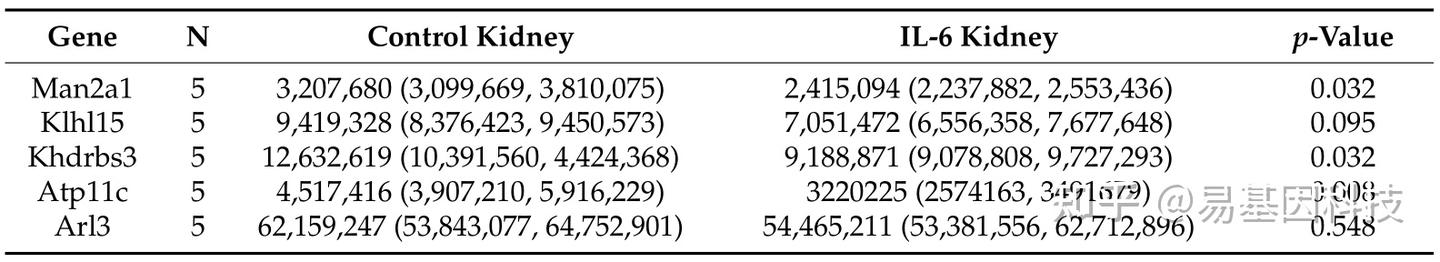
表3:用Image-J软件在共聚焦显微镜下对蛋白质进行免疫荧光染色的区域感兴趣(ROI)中的相对荧光强度单位(RFUs)的中位数和四分位范围。
研究局限:
- 研究在动物模型中进行,其结果需要在人类中进一步验证。
- 虽然鉴定出关键基因和调控网络,但这些基因如何具体影响肾脏发育和CKD机制仍需深入研究。
- 研究主要关注IL-6的作用,可能还有其他因素也参与肾脏发育和CKD进展,这些因素未在本研究中探讨。
易基因:DNA甲基化研究基本思路
DNA甲基化一般遵循四个步骤:
首先,进行整体全基因组甲基化变化的分析,包括平均甲基化水平变化、甲基化水平分布变化、降维分析、聚类分析、相关性分析等。
其次,进行甲基化差异水平分析,筛选具体差异基因,包括DMC/DMR/DMG鉴定、DMC/DMR在基因组元件上的分布、DMC/DMR的TF结合分析、时序甲基化数据的分析策略、DMG的功能分析等。
再次,将甲基化组学&转录组学关联分析,包括Meta genes整体关联、DMG-DEG对应关联、网络关联等。
最后,对筛选出的目标区域DNA甲基化进行验证,通常采用靶基因重亚硫酸盐测序(Target-BS)。

关于易基因全基因组重亚硫酸盐测序(WGBS)
全基因组重亚硫酸盐甲基化测序(WGBS)可以在全基因组范围内精确的检测所有单个胞嘧啶碱基(C碱基)的甲基化水平,是DNA甲基化研究的金标准。WGBS能为基因组DNA甲基化时空特异性修饰的研究提供重要技术支持,能广泛应用在个体发育、衰老和疾病等生命过程的机制研究中,也是各物种甲基化图谱研究的首选方法。
易基因全基因组甲基化测序技术通过T4-DNA连接酶,在超声波打断基因组DNA片段的两端连接接头序列,连接产物通过重亚硫酸盐处理将未甲基化修饰的胞嘧啶C转变为尿嘧啶U,进而通过接头序列介导的 PCR 技术将尿嘧啶U转变为胸腺嘧啶T。
应用方向:
WGBS广泛用于各种物种,要求全基因组扫描(不错过关键位点)
- 全基因组甲基化图谱课题
- 标志物筛选课题
- 小规模研究课题
技术优势:
- 应用范围广:适用于所有参考基因组已知物种的甲基化研究;
- 全基因组覆盖:最大限度地获取完整的全基因组甲基化信息,精确绘制甲基化图谱;
- 单碱基分辨率:可精确分析每一个C碱基的甲基化状态。

易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化)和表观转录组学(m6A、m5C、m1A、m7G、ac4C)、染色质结构与功能组学技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900。
参考文献:
Panzade G, Srivastava T, Heruth DP, Rezaiekhaligh MH, Zhou J, Lyu Z, Sharma M, Joshi T. Employing Multi-Omics Analyses to Understand Changes during Kidney Development in Perinatal Interleukin-6 Animal Model. Cells. 2024 Oct 9;13(19) pii: cells13191667. doi: 10.3390/cells13191667. PubMed PMID: 39404429.
相关阅读:
项目文章 | WGBS+RNA-seq揭示松材线虫JIII阶段形成过程中的DNA甲基化差异
Cell|易基因微量DNA甲基化测序助力中国科学家成功构建胚胎干细胞嵌合体猴,登上《细胞》封面


