易基因:Aging Cell/IF8:卵巢发育和衰老的m6A 甲基化揭示RNA稳定性和染色质状态调控
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
卵巢是女性重要的生殖器官,也是最早表现出衰老迹象的器官之一,通常在35岁左右开始,卵巢衰老(ovarian aging,OA)是导致与年龄相关的不孕问题的重要因素,包括卵泡数量和卵子质量的逐渐下降,对女性生育能力构成威胁。m6A是一种普遍存在的RNA表观遗传修饰,已在多种生理和病理背景下显示出重要作用。m6A与组蛋白修饰之间的调控机制以及m6A在卵巢发育和衰老中的作用尚不清楚。
2024年10月15日,南京医科大学黄伯贤团队以“The N6-methyladenosine landscape of ovarian development and aging highlights the regulation by RNA stability and chromatin state”为题在老年病学高分SCI《Aging Cell》上发表科研成果,研究通过m6A MeRIP-seq等实验揭示卵巢发育和衰老过程中N6-甲基腺苷(m6A)甲基化谱,阐明了m6A修饰在OA进展中的表观遗传调控机制。

标题:The N6-methyladenosine landscape of ovarian development and aging highlights the regulation by RNA stability and chromatin state(卵巢发育和衰老的m6A 甲基化谱揭示RNA稳定性和染色质状态调控)
期刊:Aging Cell
影响因子:8
技术平台:MeRIP-seq等
研究首先通过m6A甲基化测序技术MeRIP-seq揭示了m6A修饰在卵巢衰老(OA)过程中高表达,这与m6A去甲基化酶FTO减少和m6A甲基化酶METTL16过表达相关。接下来,作者利用FTO基因敲除(KO)小鼠模型和KGN细胞系的研究,同样揭示了FTO缺失和METTL16过表达显著增加了m6A修饰水平。这些变化会导致甲基转移酶SUV39H1下调,进而下调H3K9me3表达。SUV39H1和H3K9me3的下调主要激活了LTR7和LTR12,随后激活ERV1,从而导致细胞增殖减少,而OA中的细胞凋亡、细胞衰老标志物和自噬标志物水平显著增加。总之,本研究为m6A在调控DNA表观遗传学中的角色提供了有趣的见解,包括H3K9me3和TEs,以及自噬,从而加速OA。
研究方法:
研究使用了多种技术,包括m6A RNA免疫沉淀测序(MeRIP-seq)、基因敲除(KO)、过表达(OE)和敲低(KD)等方法。
- 采用m6A RNA免疫沉淀测序(MeRIP-seq)分析10个人卵巢样本的m6A修饰水平。
- 使用FTO-KO小鼠模型和KGN细胞系来研究FTO缺失和METTL16过表达对m6A水平的影响。
- 通过western blot、免疫荧光染色、电子显微镜分析等技术来评估卵巢功能和衰老标志物。
结果图形
(1)卵泡发育和OA中m6A转录组范围内的整体差异分析
研究者对10个人类卵巢样本进行了m6A-MeRIP-seq分析,这些样本被分为四个阶段:胎儿期(Fet)、年轻期(Yng)、老年期(Old)和绝经期(Mop)。
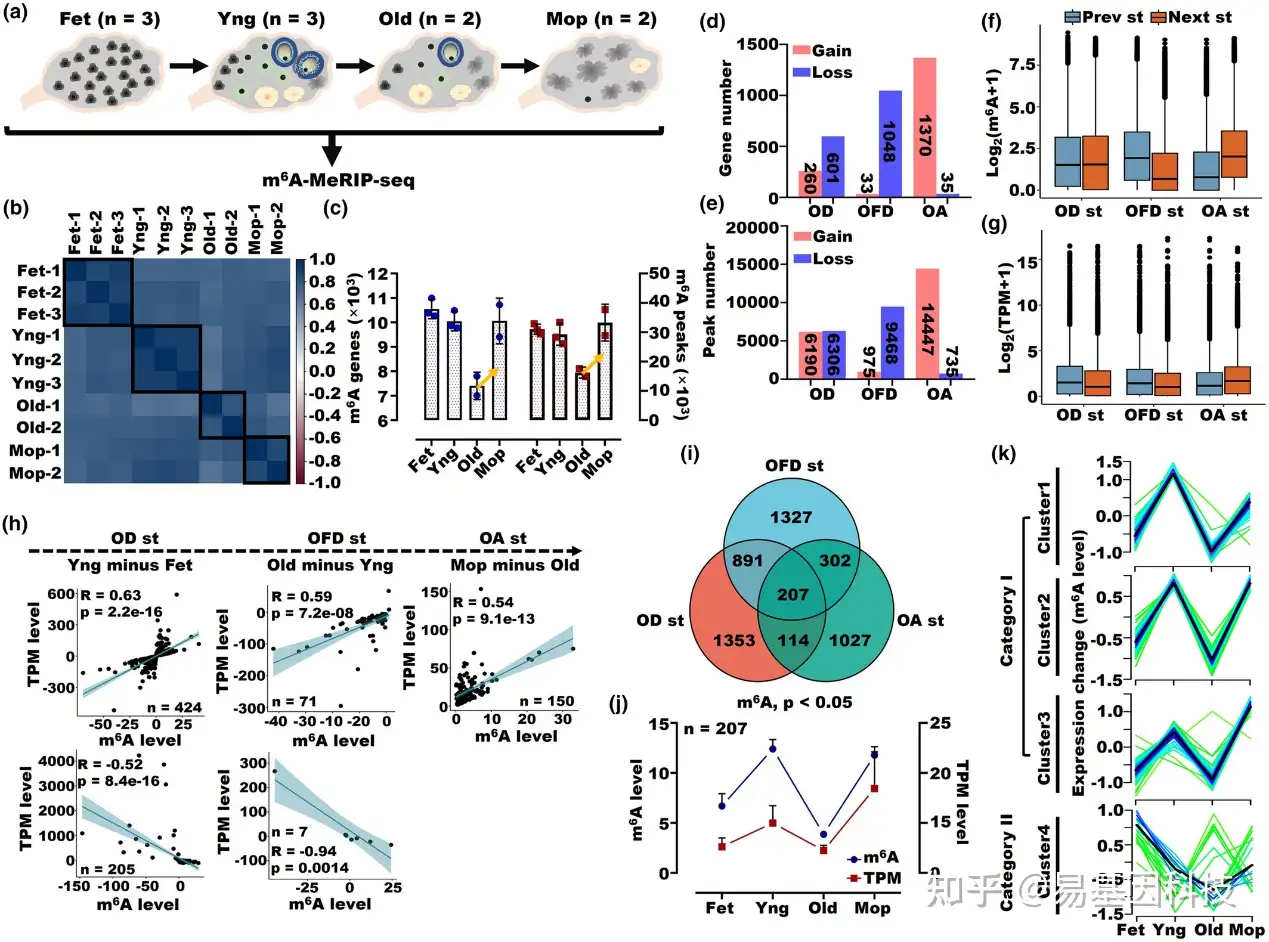
图1:在人卵巢不同阶段的转录组m6A的整体差异分析。
(a) 人卵巢动态微观结构和m6A MeRIP-seq测序示意图。
(b) 人卵巢匹配样本间m6A水平的皮尔逊相关热图。
(c) 在人卵巢不同阶段富集的m6A峰值和基因数量。
(d) 在卵巢发育(OD,从胎儿期到年轻期)、卵巢功能下降(OFD,从年轻期到老年期)和卵巢衰老(OA,从老年期到绝经期)期间获得和丢失m6A的基因数量。
(e) 在OD、OFD和OA期间获得和丢失的m6A峰值数量。
(f) OD、OFD和OA期间m6A基因表达水平箱线图。
(g) OD、OFD和OA期间mRNA表达水平的箱线图。
(h) OD、OFD和OA期间重叠的m6A和mRNA水平的系数相关性分析。
(i) OD、OFD和OA阶段差异表达的m6A基因的维恩图(p<0.05)。
(j) OD、OFD和OA阶段比较207个基因的m6A和mRNA水平。
(k) 模糊C均值聚类鉴定了m6A基因的四种不同的时间模式。x轴代表四个阶段,而y轴代表每个阶段的log2转换、标准化强度比率。
(2)在极端卵巢衰老期间,N6-甲基腺苷(m6A)在内源性逆转录病毒(ERVs)上的高富集情况
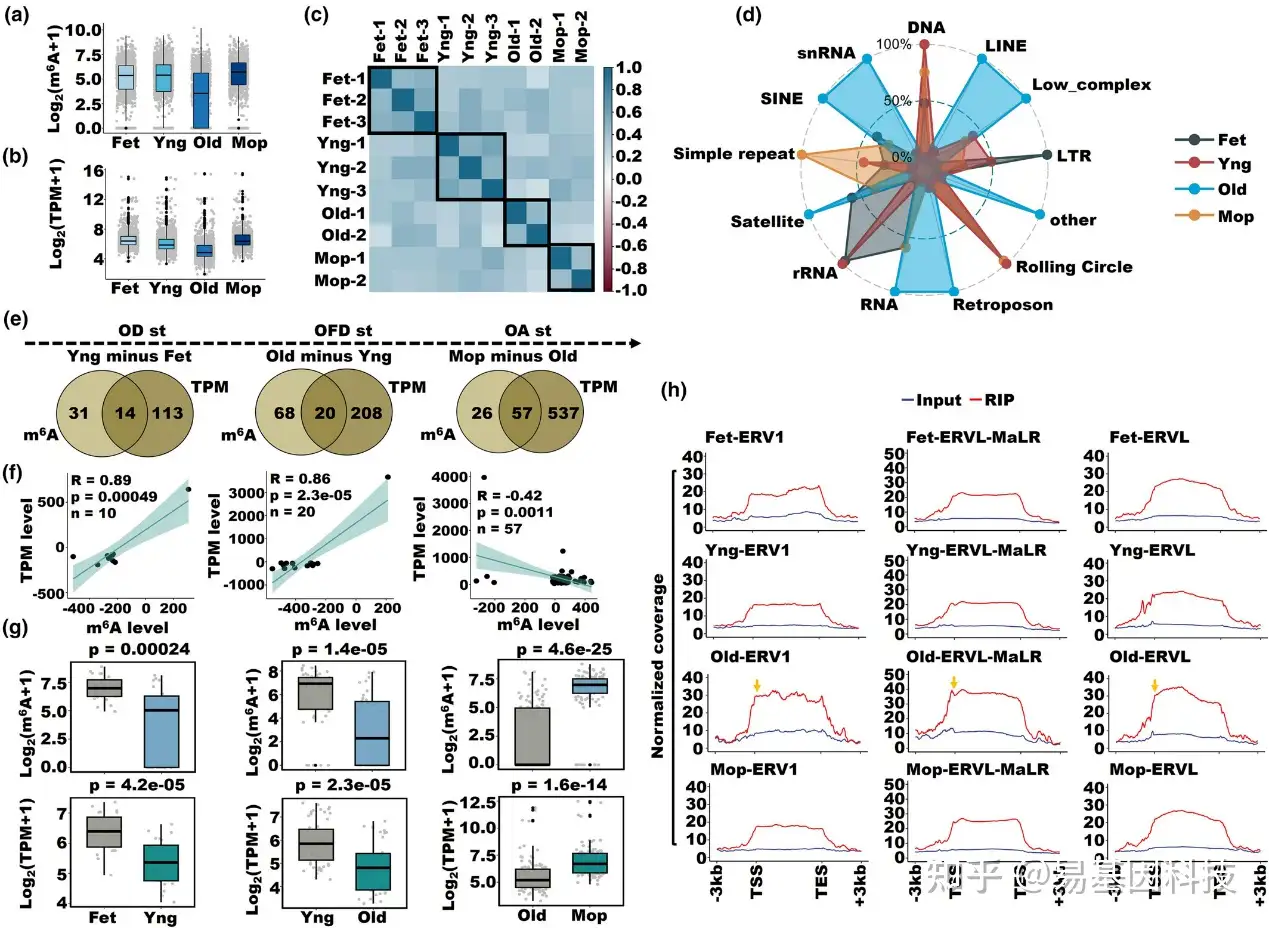
图2:在四个不同阶段的逆转录病毒RNA的m6A甲基化和转录组分析概况。
(a, b) 在胎儿期(Fet)、年轻期(Yng)、老年期(Old)和绝经期(Mop)中,逆转录病毒RNA的m6A和转录组的表达水平。
(c) 人卵巢匹配样本之间逆转录病毒RNA的m6A水平的皮尔逊相关热图。
(d) 在四个组中,带有m6A修饰的不同类型逆转录病毒RNA的百分比。
(e) 相邻阶段之间带有和不带有m6A修饰的逆转录病毒RNA的维恩图。
(f) 在卵巢发育(OD)、卵巢功能下降(OFD)和卵巢衰老(OA)期间,常见逆转录病毒与m6A和RNA表达水平之间的相关性分析。
(g) 在OD、OFD和OA期间逆转录病毒中m6A和RNA表达水平的箱线图。
(h) 在胎儿期、年轻期、老年期和绝经期中,ERV1、ERVL-MaLR和ERVL的m6A RIP和input信号的平均概况。
(3)FTO基因敲除介导m6A修饰增加,进而影响自噬通量和卵巢衰老(OA)。
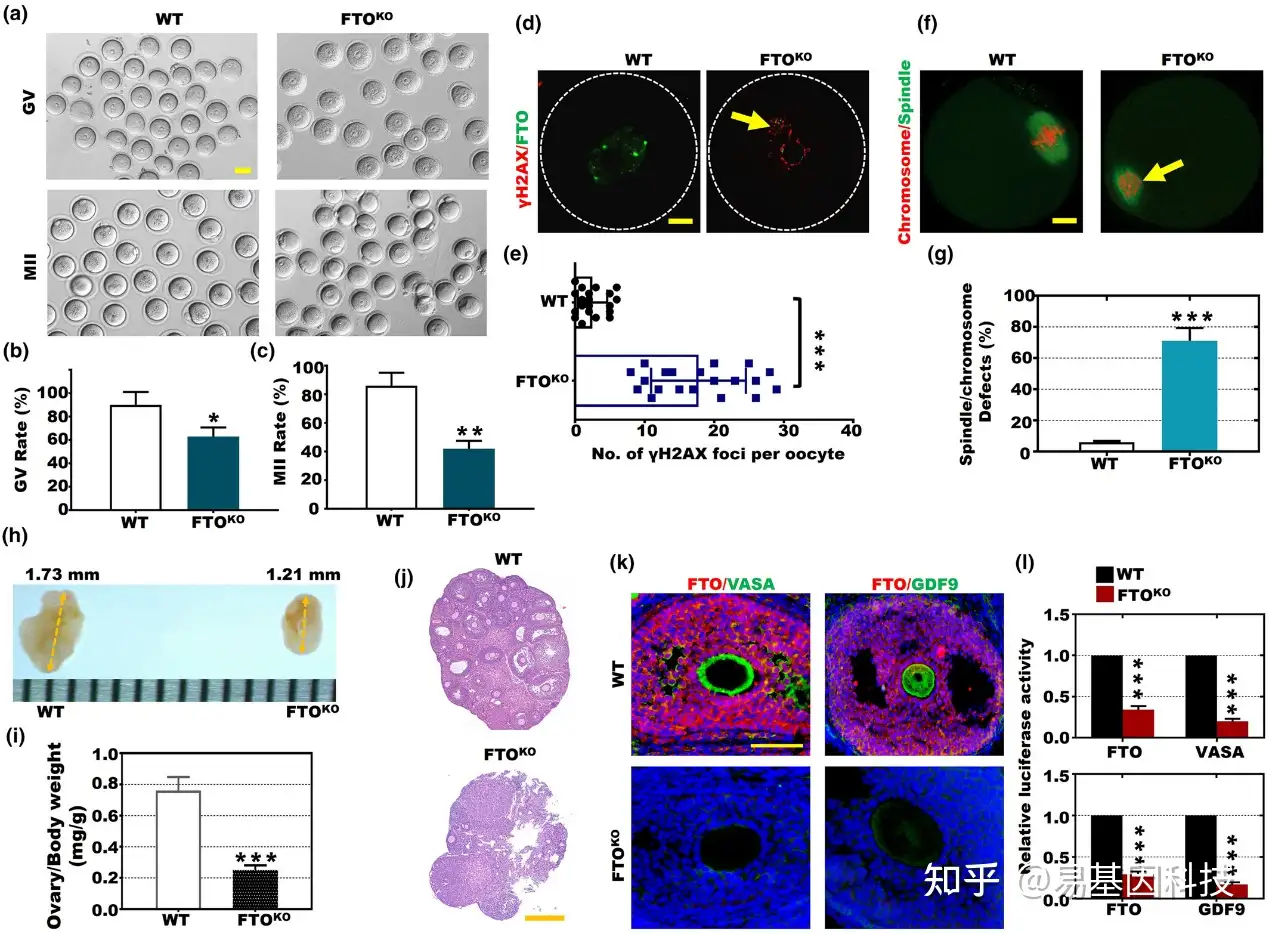
图3:FTO基因敲除(FTO-KO)影响卵母细胞(卵泡)发育潜力。
(a–c) 来自FTO-KO和野生型(WT)小鼠的GV期和MII期卵母细胞的数量。
(d) FTO-KO和WT卵母细胞中γ-H2AX(红色)和FTO(绿色)的染色图像。
(e) FTO-KO和WT卵母细胞中每个卵母细胞的γ-H2AX焦点数量(***p<0.001)。
(f) FTO-KO和WT卵母细胞中染色体(红色)和纺锤体(绿色)的染色图像。
(g) FTO-KO和WT卵母细胞中纺锤体和染色体缺陷的百分比(***p<0.001)。
(h) FTO-KO和WT小鼠的卵巢大小。
(i) FTO-KO和WT小鼠卵巢重量与体重的比例(***p<0.001)。
(j) FTO-KO和WT卵巢的HE染色(比例尺,500微米)。
(k, l) FTO-KO和WT组中FTO(红色)、VASA(绿色)和GDF9(绿色)的相对荧光素酶活性(***p<0.001)。
(4)FTO基因敲除诱导细胞凋亡并调控逆转录病毒RNA的m6A水平
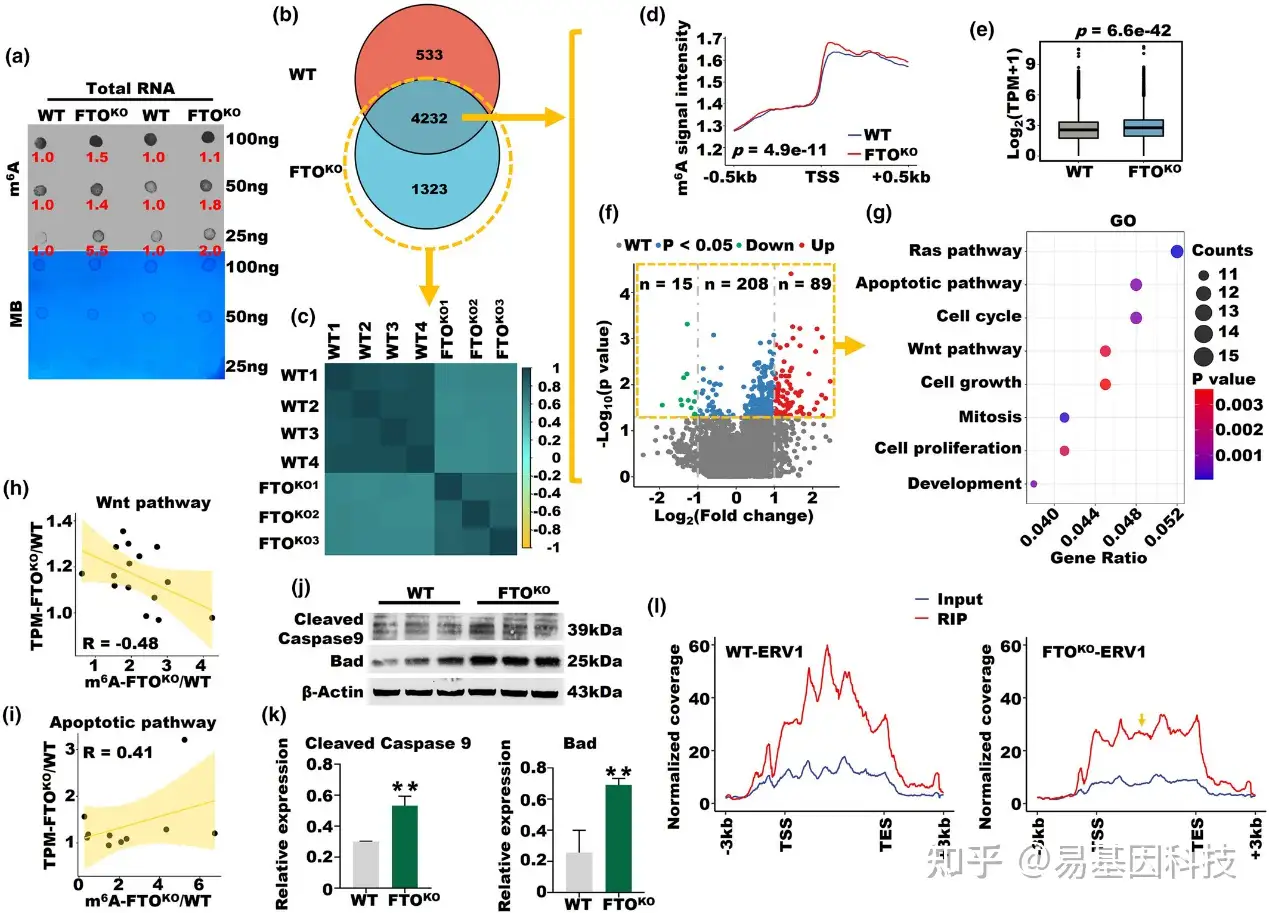
图4:FTO基因敲除(FTO-KO)介导细胞凋亡并影响逆转录病毒RNA m6A水平。
(a) 六月龄FTO-KO和野生型(WT)小鼠卵巢中总RNA样本的m6A斑点印迹。
(b) FTO-KO和WT小鼠之间m6A修饰基因的维恩图。
(c) FTO-KO组与WT小鼠相比的特异性m6A修饰基因皮尔逊相关性热图。
(d) FTO-KO和WT小鼠中4232个重叠基因在启动子区域的m6A信号强度。
(e) FTO-KO和WT小鼠中4232个重叠基因的mRNA表达水平的箱线图。
(f) 火山图显示FTOKO和WT小鼠中差异表达的m6A基因。x轴代表log2转换的倍数变化,而y轴代表log10标准化的p值。
(g) 312个差异表达的m6A修饰基因的GO分析。
(h, i) 在Wnt和凋亡信号通路中m6A和mRNA水平的皮尔逊相关系数。
(j, k) FTO-KO和WT小鼠中切割Caspase 9和Bad的蛋白表达(*p<0.05, ***p<0.001)。
(l) FTO-KO和WT小鼠中ERV1的m6A RIP和input信号的平均概况。
(5)FTO基因敲除调控卵巢衰老(OA)中的SUV39H1-H3K9me3-ERV轴
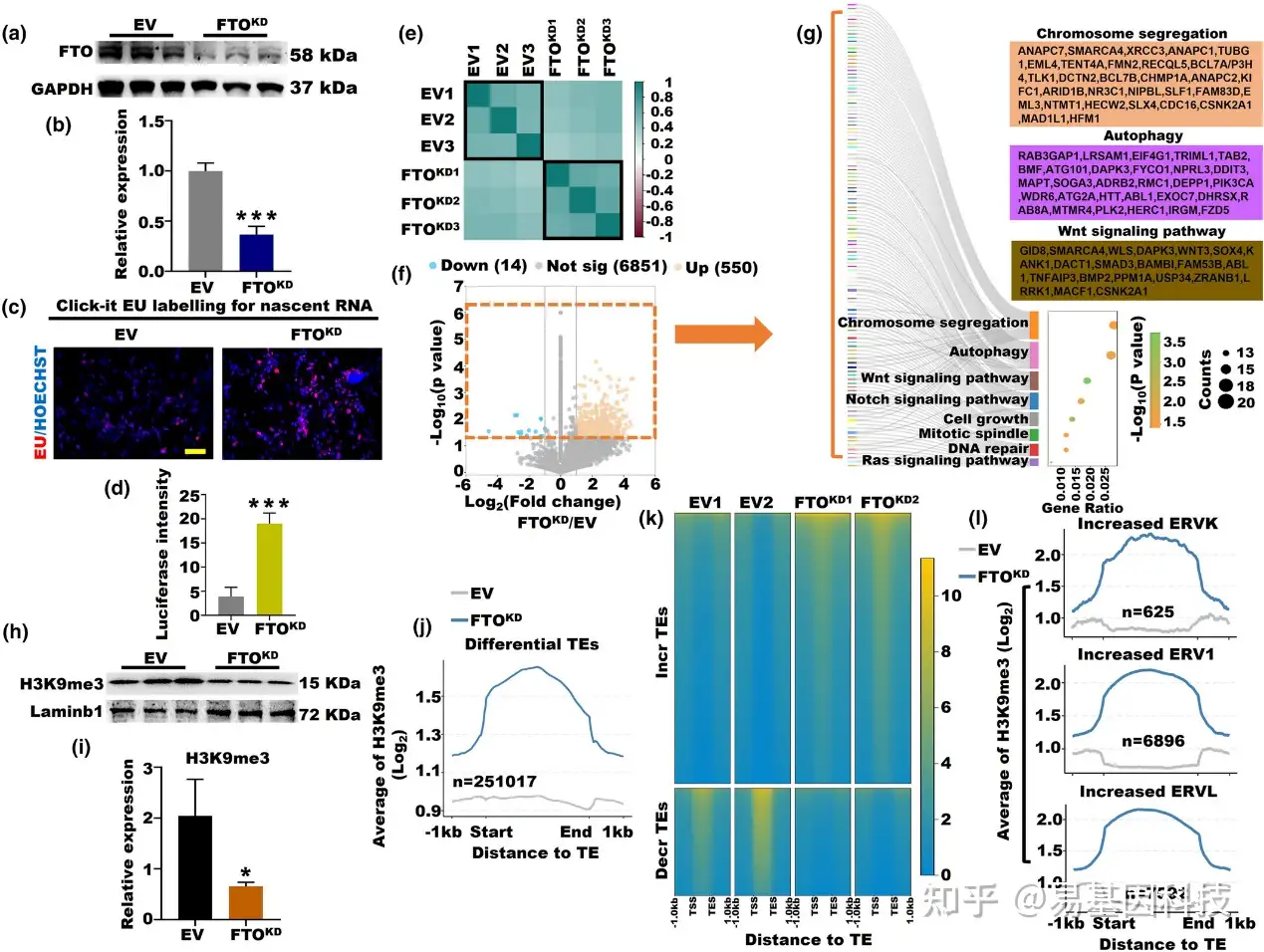
图5:FTO基因敲低(FTO-KD)在卵巢衰老期间影响了SUV39H1-H3K9me3-ERV轴。
(a, b) FTO-KD和空载体(EV)KGN细胞系中FTO蛋白的表达(***p<0.001)。
(c, d) FTO-KD和EV组新合成RNA的荧光素酶强度信号(***p<0.001)。
(e) FTO-KD和EV组中m6A修饰基因的皮尔逊相关性热图。
(f) FTO-KD和EV组中差异表达的m6A基因散点图。
(g) FTO-KD和EV组中差异表达的m6A修饰基因的GO分析。
(h, i) FTO-KD和EV KGN细胞系中H3K9me3蛋白的表达(*p<0.05)。
(j) FTO-KD和EV组中差异TEs上的H3K9me3信号的平均值。
(k) FTO-KD和EV组中增加和减少的TEs上的H3K9me3信号。
(l) FTO-KD和EV组中增加的ERVK、ERV1和ERVL上的H3K9me3信号的平均值。EV,empty vector。
(6)METTL16过表达在卵巢衰老(OA)中调控SUV39H1-H3K9me3-ERV轴。
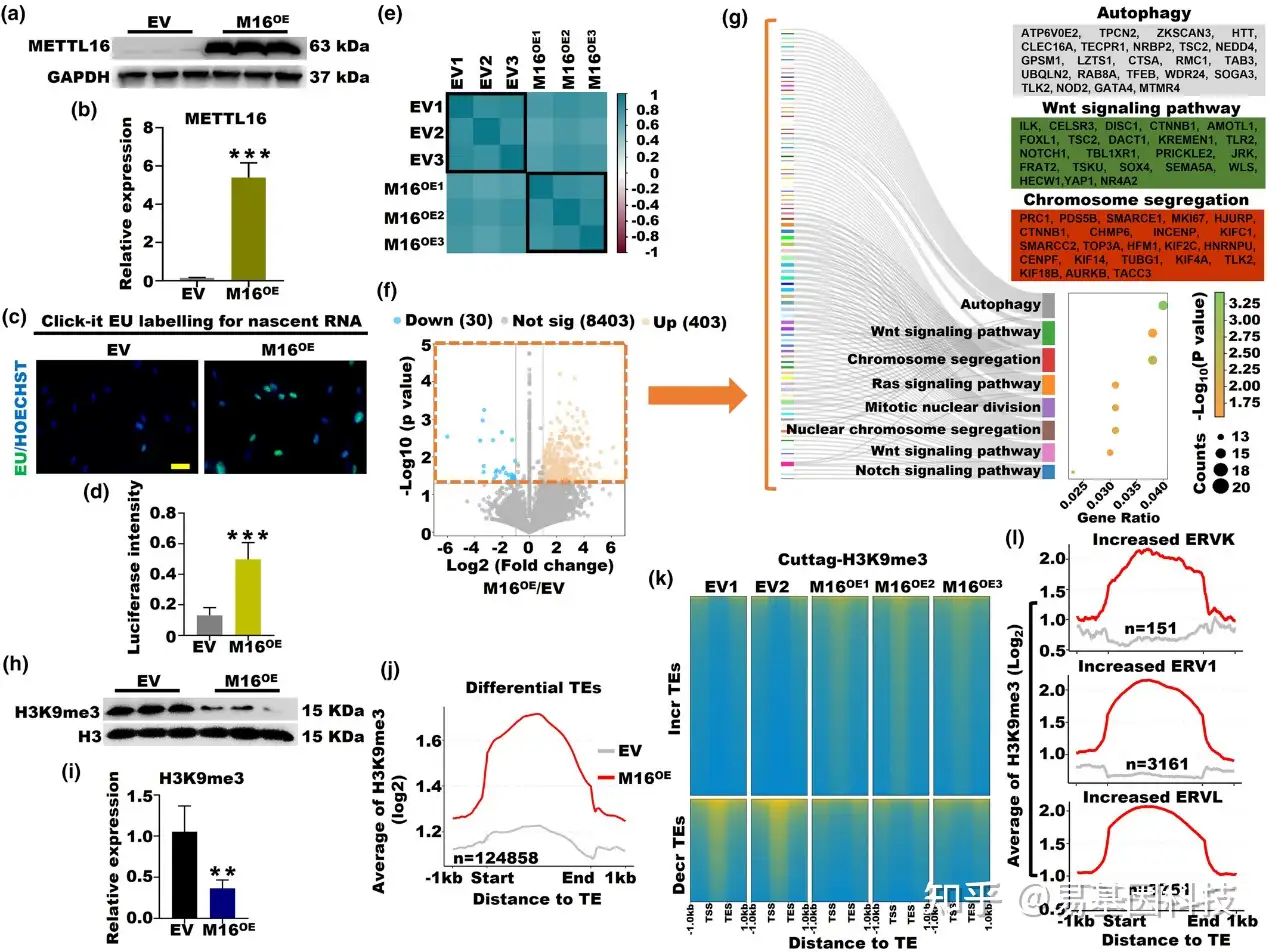
图6:METTL16过表达在卵巢衰老中调控SUV39H1-H3K9me3-ERVs轴。
(a, b) M16-OE和EV KGN细胞系中METTL16蛋白的表达(***p < 0.001)。
(c, d) M16-OE和EV组新合成RNA的荧光素酶强度信号(***p < 0.001)。
(e) M16-OE和EV组中m6A修饰基因的皮尔逊相关性热图。
(f) M16-OE和WT组中差异表达的m6A基因散点图。
(g) M16-OE和EV组中差异表达的m6A修饰基因的GO分析。
(h, i) M16-OE和EV KGN细胞系中H3K9me3蛋白的表达(**p < 0.01)。
(j) M16-OE和EV组中差异TEs上的H3K9me3信号的平均值。
(k) M16-OE和EV组中增加和减少的TEs上的H3K9me3信号。
(l) M16-OE和EV组中增加的ERVK、ERV1和ERVL上的H3K9me3信号的平均值。
(7)m6A高甲基化诱导ERV1激活,从而导致卵巢衰老(OA)。
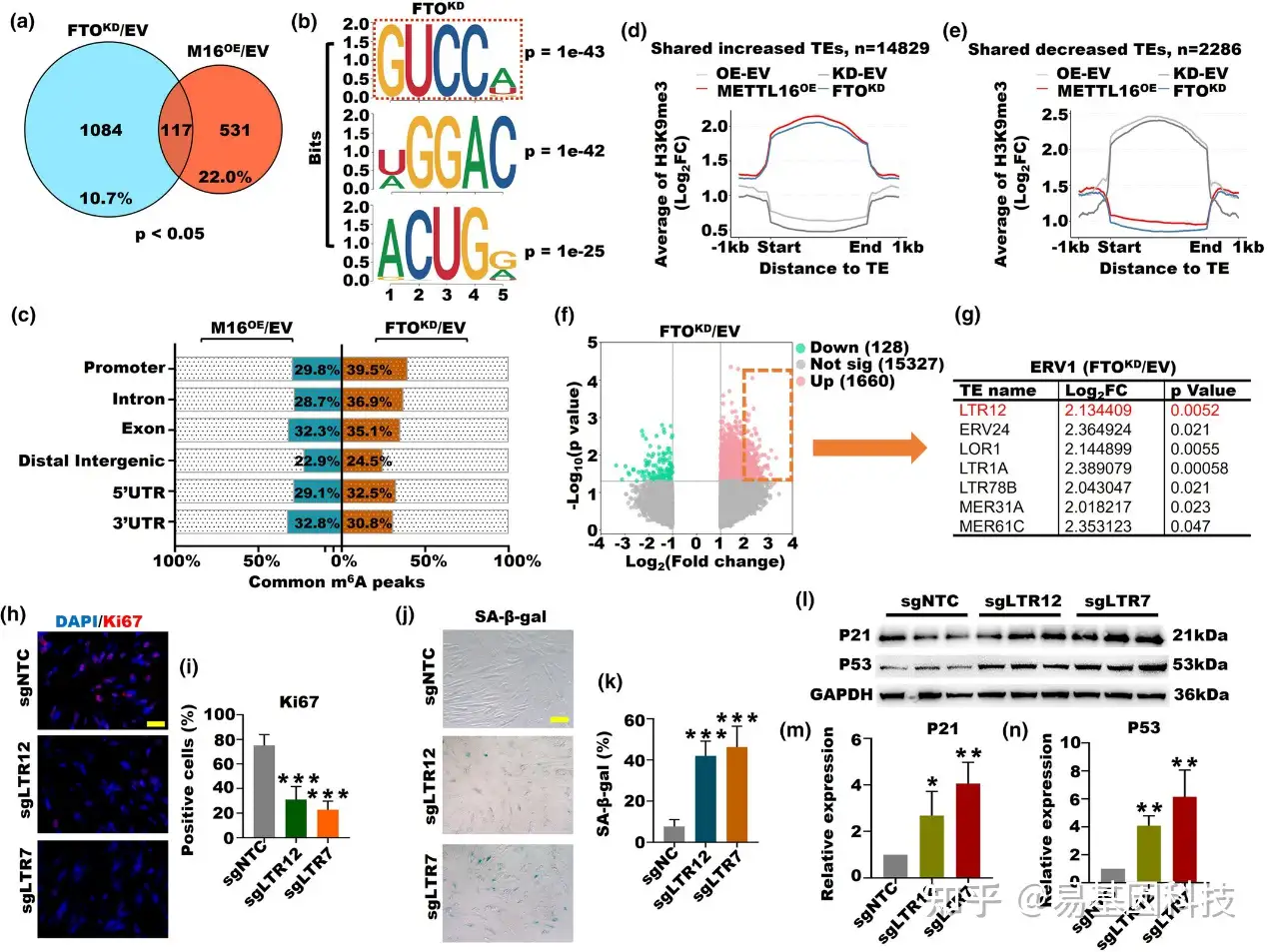
图7:由m6A高甲基化诱导的ERV1激活是卵巢衰老的诱导因子。
(a) FTO-KD和M16-OE组中差异表达的m6A修饰基因(p<0.05)的维恩图分析。
(b) FTO-KD组中前三大m6A motif。
(c) FTO-KD和M16-OE组在不同基因组区域共有m6A峰值比例。
(d) M16-OE和FTO-KD细胞系中共有增加的TEs上的H3K9me3信号平均值。
(e) M16-OE和FTO-KD细胞系中共有减少的TEs上的H3K9me3信号平均值。
(f) FTO-KD组中差异表达的TEs的散点图。
(g) FTO-KD组中表达变化的七个ERV1亚家族,其FC>2。
(h,i) sgLTR12和sgLTR7细胞中增殖标记KI67的免疫荧光染色(***p<0.001)。
(j,k) sgLTR12和sgLTR7细胞中衰老标记SA-β-gal的染色结果(***p<0.001)。
(l,m) sgLTR12和sgLTR7细胞中衰老蛋白p21和p53的表达(*p<0.05, **p<0.01)。
研究局限:
FTO作为一种RNA去甲基化酶,可以去除如N6-甲基腺苷(m6A)、N6-2-O-二甲基腺苷(m6Am)和N1-甲基腺苷(m1A)这样的甲基基团。本研究仅集中研究了FTO通过m6A修饰调控卵巢衰老(OA)的机制。未来的研究可以更深入地探讨FTO如何影响m6Am和m1A修饰,以阐明这一生理过程的多方面特征。
关于易基因RNA m6A甲基化测序(MeRIP-seq)技术
易基因MeRIP-seq技术利用m6A特异性抗体富集发生m6A修饰的RNA片段(包括mRNA、lncRNA等rRNA去除所有RNA),结合高通量测序,可以对RNA上的m6A修饰进行定位与定量,总RNA起始量可降低至10μg,最低仅需1μg总RNA。广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症发生与发展、药物应答等研究领域;可应用于动物、植物、细胞及组织的m6A检测。
大样本量m6A-QTL性状关联分析,传统MeRIP单个样品价格高,通常难以承担。易基因开发建立MeRIP-seq2技术,显著提成IP平行性,实现不同样本间相对定量,降低检测成本。
易基因提供适用于不同科研需求的MeRIP技术:
- m6A甲基化-常量mRNA 甲基化测序(MeRIP-seq)
- m6A甲基化-常量mRNA +lncRNA甲基化测序(lnc-MeRIP-seq)
- m6A甲基化-微量mRNA +lncRNA甲基化测序(Micro-lnc-MeRIP-seq)
- 高通量m6A甲基化-常量mRNA甲基化测序(MeRIP-seq2)
技术优势:
- 起始量低:样本起始量可降低至10-20μg,最低仅需1μg总RNA;
- 转录组范围内:可以同时检测mRNA和lncRNA;
- 样本要求:可用于动物、植物、细胞及组织的m6A检测;
- 重复性高:IP富集重复性高,最大化降低抗体富集偏差;
- 应用范围广:广泛应用于组织发育、干细胞自我更新和分化、热休克或DNA损伤应答、癌症的发生与发展、药物应答等研究领域。
研究方向:
m6A甲基化目前主要运用在分子机制的理论性研究
- 疾病发生发展:肿瘤、代谢疾病(如肥胖/糖尿病)、神经和精神疾病(如阿尔兹海默症/抑郁症)、炎症…
- 发育和分化:早期胚胎发育、个体/组织/器官生长发育、干细胞分化与命运决定、衰老
- 环境暴露与响应:污染、抗逆、生活方式
关于m6A甲基化研究思路
(1)整体把握m6A甲基化图谱特征:m6A peak数量变化、m6A修饰基因数量变化、单个基因m6A peak数量分析、m6A peak在基因元件上的分布、m6A peak的motif分析、m6A peak修饰基因的功能分析
(2)筛选具体差异m6A peak和基因:差异m6A peak鉴定、非时序数据的分析策略、时序数据的分析策略、差异m6A修饰基因的功能分析、差异m6A修饰基因的PPI分析、候选基因的m6A修饰可视化展示
(3)m6A甲基化组学&转录组学关联分析:Meta genes整体关联、DMG-DEG对应关联、m6A修饰目标基因的筛选策略
(4)进一步验证或后期试验
易基因提供全面的表观基因组学(DNA甲基化、DNA羟甲基化)和表观转录组学(m6A、m5C、m1A、m7G、ac4C)、染色质结构与功能组学技术方案(ChIP-seq、ATAC-seq),详询易基因:0755-28317900。
参考文献:
Hu X, Lu J, Ding C, Li J, Zou Q, Xia W, Qian C, Li H, Huang B. The N6-methyladenosine landscape of ovarian development and aging highlights the regulation by RNA stability and chromatin state. Aging Cell. 2024 Oct 15:e14376. doi: 10.1111/acel.14376. PubMed PMID: 39410722.
相关阅读:
项目文章:MeRIP-seq+RNA-seq揭示家禽(鸡)脂肪沉积中的m6A RNA甲基化调控机制
项目文章 | MeRIP-seq揭示m6A修饰在肺动脉高压(PAH)发病机制中的潜在作用和新治疗靶点



