易基因:m6A/m5C/m1A/m7G/ac4C/Ψ等8种RNA修饰的生物学功能和潜在机制
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
RNA修饰近来已成为热门话题,它们通过影响RNA生成、转运、功能和代谢等过程,是细胞生物学的关键调节因子。本文介绍了包括N6-甲基腺苷(m6A)、5-甲基胞嘧啶(m5C)、N1-甲基腺苷(m1A)、N7-甲基鸟苷(m7G)、N4-乙酰胞嘧啶(ac4C)、假尿苷(Ψ)、尿苷化和腺苷-肌苷(A-to-I)RNA编辑在内的8种RNA修饰的生物学功能和作用机制,这些修饰由RNA修饰酶(“writers”,“erasers”和“readers”)进行添加、去除、识别和编辑,影响包括RNA生成、转运、功能和代谢的生物学进程,进而调控细胞功能。最后,还总结整理了各种癌症中免疫细胞相关的RNA修饰。
m6A(N6-methyladenosine)
m6A修饰在真核生物中已成为最普遍且含量最丰富的mRNA修饰(m6A/A = 0.1–0.6%)。它以全长序列出现,但在mRNA的终止密码子附近和3'非翻译区(3'UTR)内富集,这些区域具有共有motif RRACH(R=G或A;H=A、C或U)。此外,m6A修饰也存在于大多数非编码RNA中,包括核糖体RNA(rRNAs)、小核RNA(snRNAs)、小核仁RNA(snoRNAs)、microRNA(miRNAs)、长链非编码RNA(lncRNAs)和环状RNA(circRNAs)。这种修饰在RNA的多种生物学功能和调控中起着重要作用。
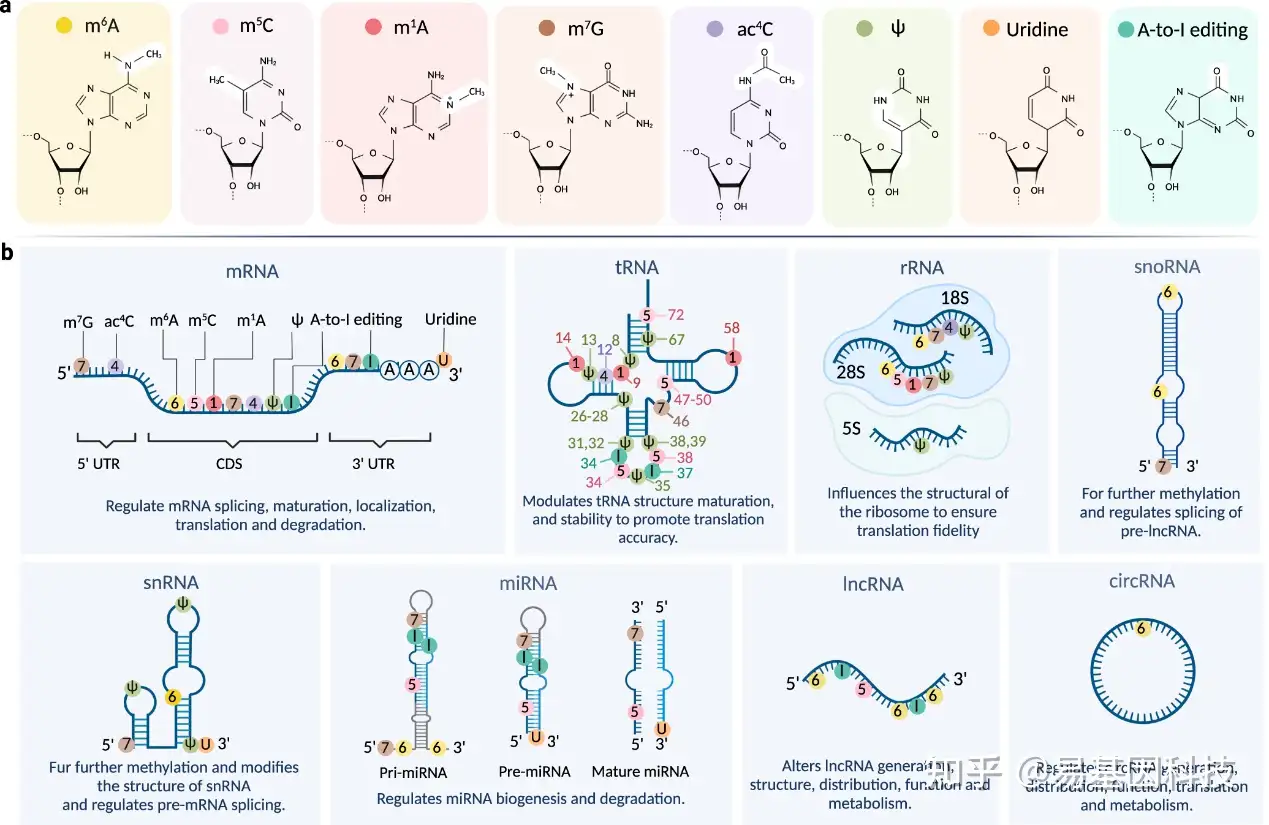
图1:RNA修饰及其在不同RNA亚型上的分布。
- 八种RNA修饰的化学结构。
- RNA修饰在不同RNA亚型上的分布,在相应的修饰位点标记。
m6A修饰在mRNA中沉积主要由m6A甲基转移酶复合体(MTC)介导(图2和表1)。关键的MTC组分包括类似甲基转移酶3(METTL3)、METTL14、Wilms肿瘤1相关蛋白(WTAP)、类病毒m6A甲基转移酶相关蛋白(VIRMA,也称KIAA1429)、Cbl原癌基因样蛋白1(HAKAI)、含锌指CCCH型蛋白13(ZC3H13)和RNA结合基序蛋白15/15B(RBM15/15B)。其中,METTL3被认为是唯一具有自身催化能力的S-腺苷甲硫氨酸(SAM)依赖性甲基转移酶,能够与METTL14形成紧密的异源二聚体进行催化,而“writers”则作为调控因子。含锌指CCCH型蛋白4(ZCCHC4)和METTL5分别在28S和18S rRNA上介导m6A形成,以加速整体翻译效率(图3和表1)。在U6 snRNA中,m6A由METTL16介导参与RNA剪接调控(图4和表1)。
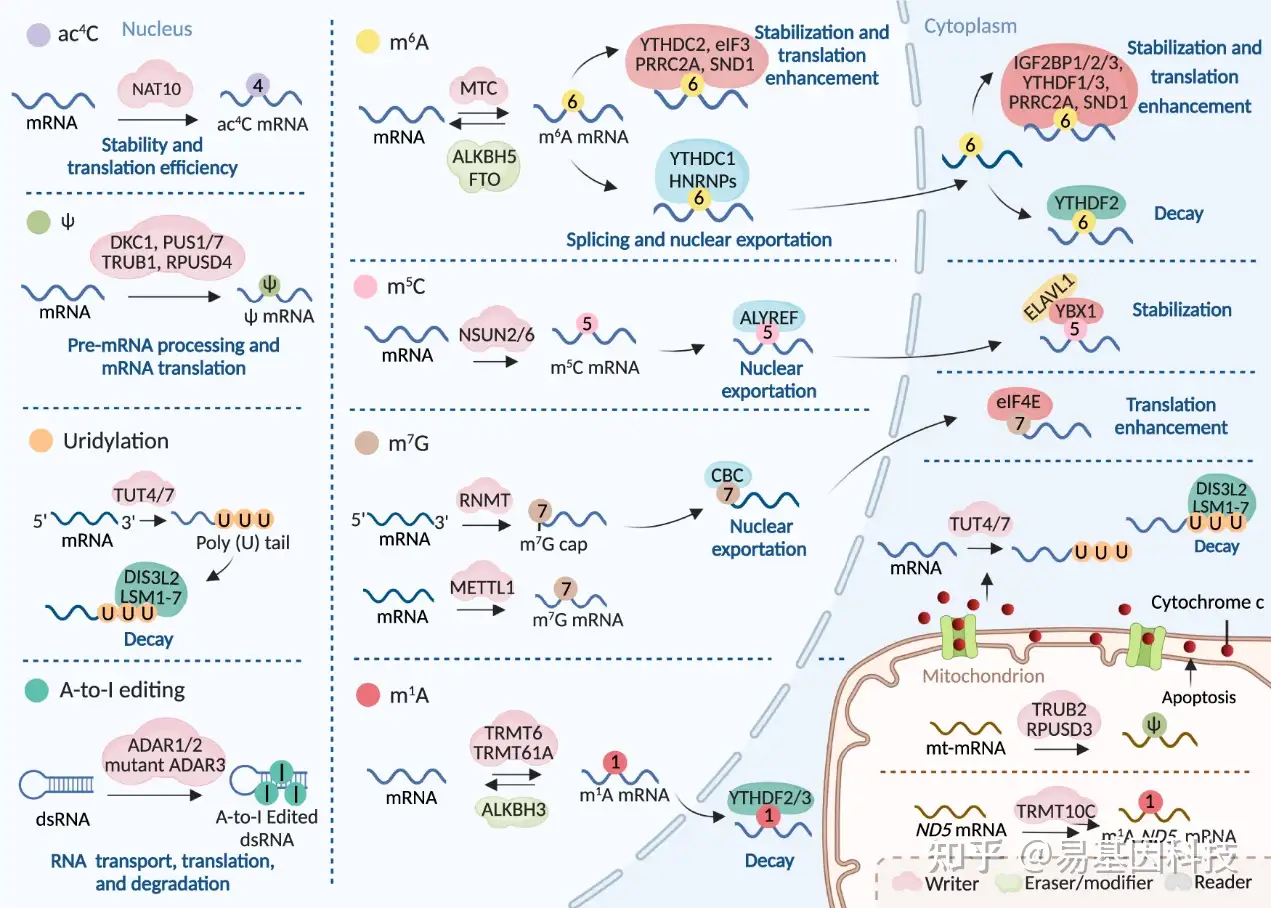
图2:RNA修饰机制及其在mRNA中的分子功能。
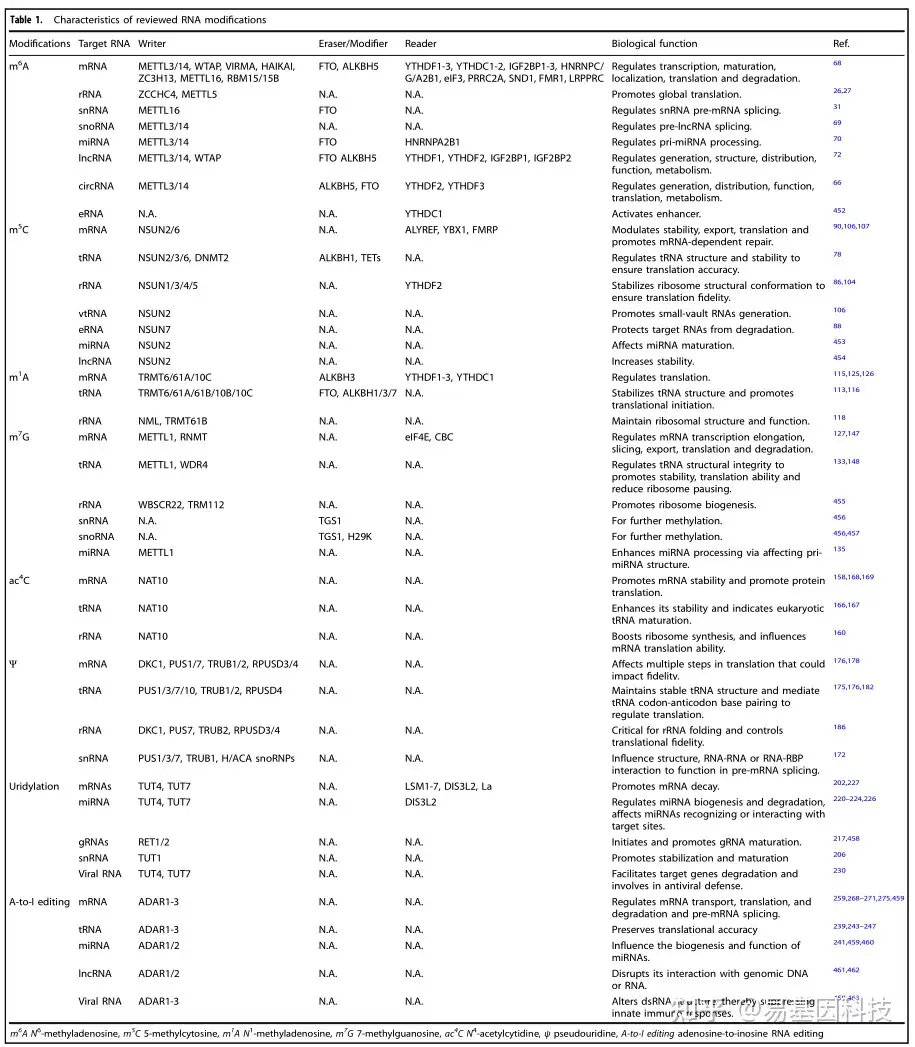
表1:RNA修饰特征
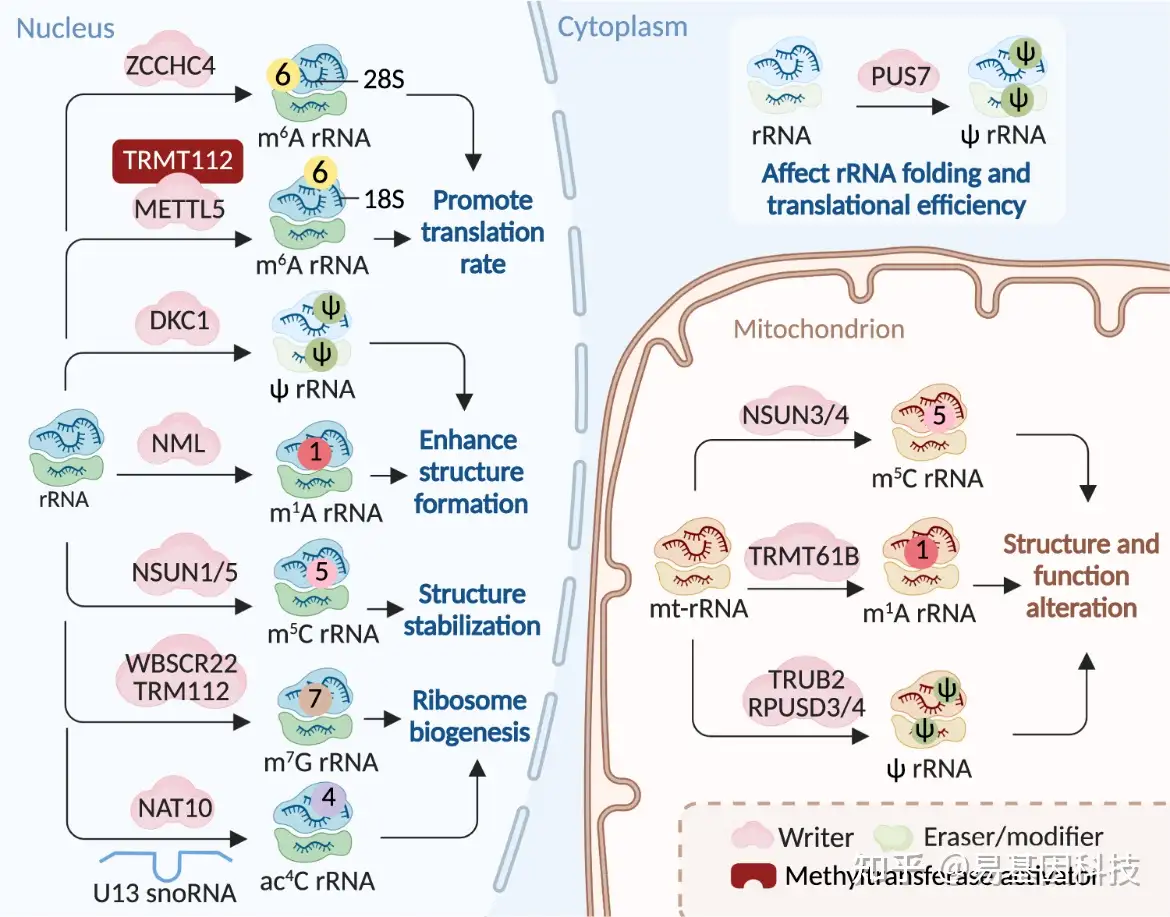
图3:RNA修饰机制及其在rRNA中的分子功能。RNA修饰通过各自的"writers"在rRNA上进行添加。在rRNA上发生的修饰会改变RNA结构,从而调节核糖体功能,进而影响翻译效率。相同修饰可以由细胞不同部位的不同writers添加。此外,核糖体不同亚基上的m6A修饰可以由不同的writers催化。一些writers还需要与甲基转移酶激活因子形成异二聚体复合体以在细胞中获得代谢稳定性,如METTL5-TRMT112。
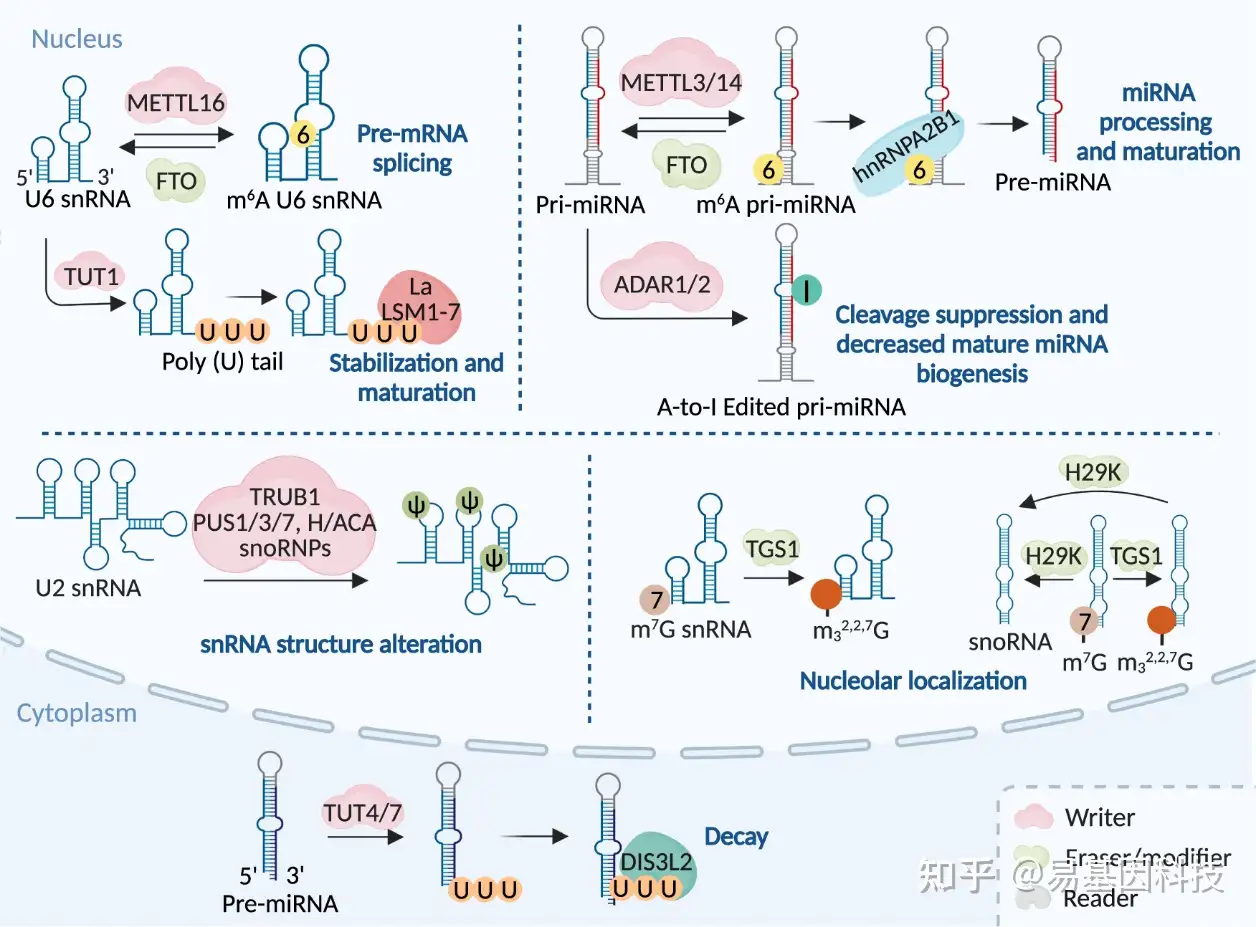
图4:RNA修饰机制及其在剪接体snRNA、snoRNA和miRNA中的分子功能。特定RNA修饰通过相应"writers"在snRNA、snoRNA和miRNA上进行添加。snRNA和miRNA上m6A修饰可以通过FTO去除,而snRNA和snoRNA上的m7G修饰可以通过H29K去除,使非编码RNA上的RNA修饰动态可逆。此外由TGS1修饰因子进一步修饰的m7G添加在snRNA和snoRNA上,可以形成m2,2,7G 。RNA修饰通过改变这些非编码RNA的结构来影响其功能,从而在各种生理过程中实现微调。
到目前为止,已经鉴定出两种m6A erasers,它们都属于铁(II)/α-酮戊二酸依赖性双加氧酶超家族的AlkB家族。第一种eraser是脂肪量和肥胖相关蛋白(FTO),它能够介导mRNA和snRNA中m6A和m6Am残基的去甲基化,以及tRNA中m1A残基的去甲基化(图2、图4、图5和表1)。另一种m6A eraser是AlkB同源物5(ALKBH5),它仅能氧化逆转mRNA中的m6A修饰(图2和表1)。
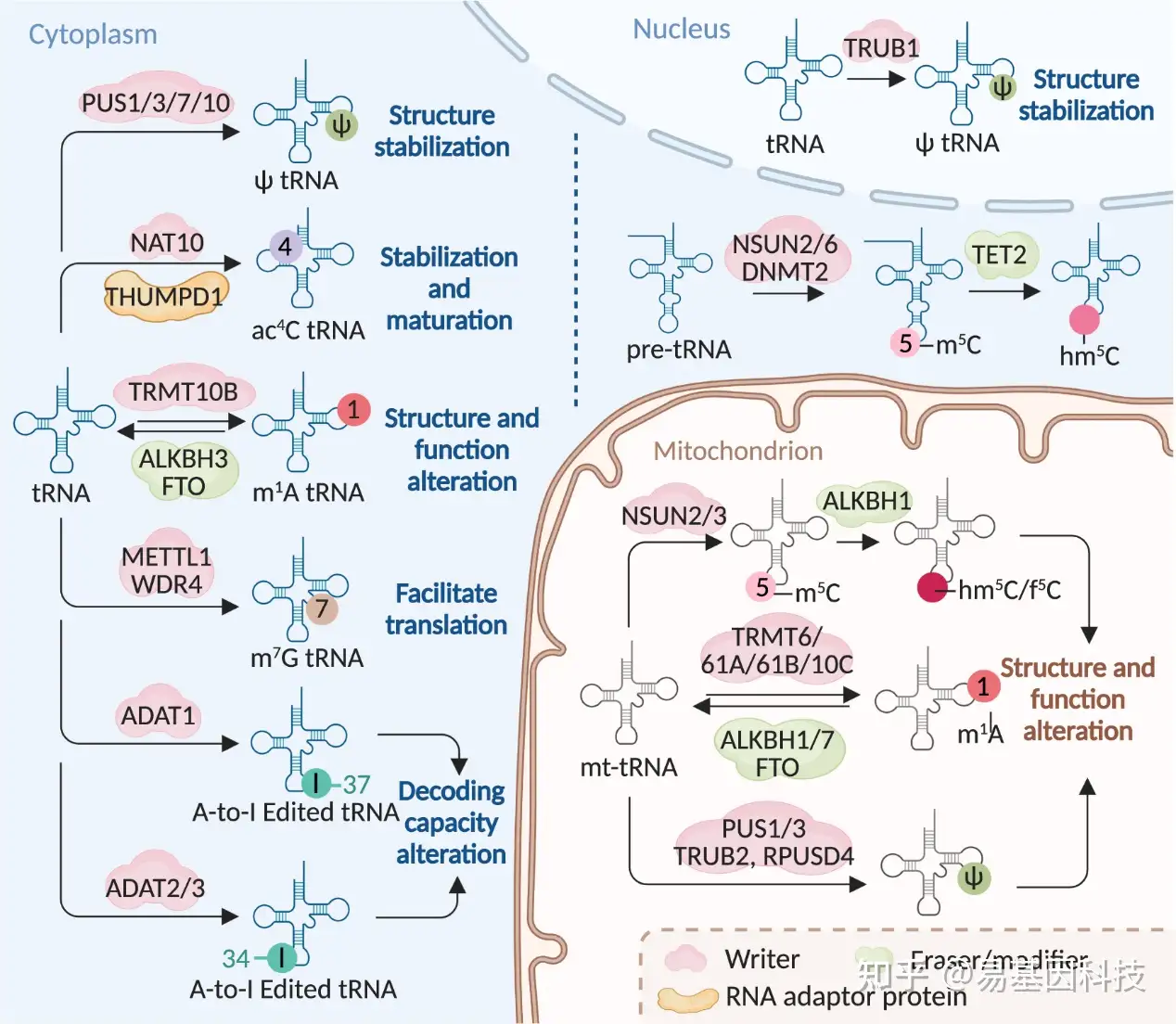
图5:RNA修饰机制及其在tRNA中的分子功能。RNA修饰通过指定的"writers"在tRNA上进行添加,而m1A修饰可以通过ALKBH3和FTO去除,pre-tRNA上的m5C修饰则可以被TET2转化为hm5C或f5C。这些tRNA上的修饰可以改变tRNA结构,从而调节其功能,影响翻译效率。tRNA上相同的修饰可以由细胞不同部位的不同writers安装。不同的writers可以在tRNA的不同位置添加A-to-I编辑。ac4C的writers NAT10在接头Tan1/THUMPD1的协助下修饰tRNA。
许多reader蛋白以各种方式影响m6A RNA命运,很大程度上取决于其亚细胞定位。最广泛研究的reader是YT521-B同源性(YTH)结构域家族成员,它们共鉴定m6A YTH结构域,但对RNA命运产生不同的影响。YTH结构域家族包括YTHDF1-3和YTHDC1-2。YTHDF1和YTHDF3通过与翻译机制互作,积极促进蛋白合成,而YTHDF2则招募RNA降解酶或接头蛋白,触发其目标mRNA快速降解。YTHDC1不仅促进m6A修饰的染色质相关调控RNA衰减,影响开放染色质状态和下游转录,而且还通过招募和调节前mRNA剪接因子来介导mRNA剪接。YTHDC2可能以m6A依赖或不依赖性方式参与mRNA稳定和翻译。类胰岛素生长因子2 mRNA结合蛋白(IGF2BPs,包括IGF2BP1-3)通过K同源结构域识别m6A,增强mRNA稳定性和翻译。异质核糖核蛋白(HNRNP)家族成员,包括HNRNPC、HNRNPG和HNRNPA2B1,能够鉴定pre-mRNA和/或原始(mi)RNA上的m6A,以介导剪接和/或细胞核质转运。真核起始因子3(eIF3)在细胞应激诱导下,通过招募43S复合体促进无帽翻译。富脯氨酸卷曲螺旋2A(PRRC2A)链球菌核酸酶和含tudor结构域的1(SND1)作为m6A readers,促进修饰RNA稳定。特别是m6A通过促进共转录R环形成参与转录终止,以防止Pol II的reads活性,目前尚不清楚其他readers是否参与此过程。m6A在各种RNA分子中的具体作用见图2-4和表1。
总的来说,m6A修饰通过影响不同RNA的转录、成熟、定位、功能和代谢,在各种细胞过程中发挥调节作用。在mRNA中,m6A可以影响转录、成熟、定位、翻译和降解,最终影响编码的蛋白质。在rRNA中,18S rRNA中的m6A1832修饰和28S rRNA中的m6A4220修饰对整体翻译必不可少。在snRNA和snoRNA中,m6A修饰可能调节snRNA pre-mRNA或pre-lncRNA的剪接过程。在miRNA中,m6A通过招募miRNA微加工复合体蛋白DGCR8(依赖于HNRNPA2B1)来促进pri-miRNA加工。在lncRNA和circRNA中,m6A已被证实可以调节生成、结构、分布、功能和代谢,并且在具有编码潜力的circRNA中,m6A也是一个关键的翻译启动子。
尽管m6A已经被广泛研究,但仍有一些重要问题需要解决。例如,m6A是一种广泛存在的修饰,可以影响各种类型的RNA,现有的研究主要集中在m6A对mRNA的影响上,而其对非编码RNA的影响可能是一个很好的研究兴趣点。当前研究表明,m6A对RNA稳定性的影响是双向的,即增加稳定性或促进降解。对于这个问题,需要充分考虑RNA中m6A的修饰位点以及不同readers(如YTHDF2和IGF2BPs)之间的不平衡。m6A可能通过介导pre-mRNA剪接,影响circRNA生成和circRNA-mRNA不平衡,由于最近对circRNA的研究热潮,这也是一个潜在的研究焦点。尽管现有的抑制因子可以通过抑制writers来干扰m6A水平,但它们通常具有非特异性,并且影响整体m6A水平。探索基因特异性的m6A干扰更具有重要意义。
m5C(5-methylcytosine)
m5C甲基化发生在胞嘧啶残基的第5位,是DNA和RNA共有的一种修饰。自1958年被鉴定以来,m5C被描述为在tRNA、rRNA、mRNA、增强子RNA(eRNA)和miRNA中广泛存在的表观转录组标记,尤其在真核生物的tRNA和rRNA中含量最丰富(图1)。
在真核生物中,m5C甲基化由NOL1/NOP2/SUN结构域(NSUN)家族成员、NSUN1-7和DNA甲基转移酶样蛋白2(DNMT2)引入(表1)。特定的m5C"writers"催化不同的RNA亚群。目前所知,细胞质tRNA由NSUN2、NSUN6和DNMT2甲基化,而线粒体tRNA由NSUN2和NSUN3催化(图5和表1)。rRNA在细胞核内由NSUN1和NSUN5甲基化,在线粒体中由NSUN4催化(图3和表1)。mRNA由NSUN2和NSUN6甲基化,而ncRNA和eRNA分别由NSUN2和NSUN7修饰(图2和表1)。
最近,一些m5C erasers或修饰因子(modifiers)在RNA分子中受到关注。已知的erasers / modifiers包括TET蛋白家族(TET1-3)和α-酮戊二酸依赖性双加氧酶ABH1(ALKBH1),它们具有将m5C氧化成5-羟甲基胞嘧啶(hm5C)的活性。在DNA中,TET蛋白依次将m5C转化为hm5C、5-甲酰胞嘧啶(f5C)和5-羧胞嘧啶,后两者被胸腺嘧啶DNA糖基化酶识别和去除。而在RNA中,TET蛋白仅被报道能将m5C转化为hm5C。ALKBH1能将m5C依次转化为hm5C和f5C,这一过程在线粒体中对线粒体功能必需(图5)。
与m6A修饰类似,m5C也涉及结合蛋白来改变修饰RNA命运。首个被鉴定m5C修饰的mRNA reader是RNA和出核因子结合蛋白2(ALYREF),这是一个著名的蛋白复合体,有助于mRNA出核(图1和表1)。Y盒结合蛋白1(YBX1)是一种位于细胞质的reader,通过招募ELAV样RNA结合蛋白1(ELAVL1)(mRNA稳定性维持蛋白),以增强m5C修饰mRNA的稳定性。此外,YTHDF2,也是一种m6A reader蛋白,能够直接结合RNA中的m5C,调节m5C在编码和非编码RNA中的分布,并通过调节m5C水平影响rRNA成熟。
总体而言,m5C在稳定非编码和编码RNA中发挥重要作用。在tRNA中,m5C调节RNA结构和稳定性,是翻译精确所必需。在rRNA中,m5C甲基化稳定了核糖体的结构构象,确保翻译准确性,并招募了应对氧化应激的mRNA亚集到poly核糖体上。m5C在mRNA中对调控稳定性、出核和翻译至关重要。例如,一组具有高甲基化m5C位点的mRNA通过NSUN2或YBX1依赖性方式稳定,从而影响膀胱癌的发生或斑马鱼的胚胎发育。NSUN2增强了ALYREF对细胞周期蛋白依赖性激酶抑制剂1A(CDKN1A)mRNA的鉴定,在功能上促进了1T3-L3前脂肪细胞中CDKN1A mRNA的出核和翻译。
鉴于m5C在维持真核生物tRNA和rRNA的结构和稳定性方面的重要性,而真核 tRNA 和 rRNA 是维持几乎所有类型真核细胞正常生理机能的重要分子,因此将m5C作为治疗方法可能还有很长的路要走。幸运的是,不同RNA具有不同的writers,靶向特定writers可以影响特定RNA功能。例如,最近的一项研究表明,靶向NSUN3以调节线粒体RNA m5C的位点特异性修饰,在抗癌症转移中显示出治疗效果。
m1A(N1-methyladenosine)
在20世纪60年代被鉴定出来的m1A是腺苷在N1位点的甲基化,已在tRNA、rRNA、mRNA和lncRNA中被发现。m1A与m6A修饰密切相关,不仅因为m1A在碱性条件下可以重排为m6A(Dimroth重排),而且它们还共有一些调控因子(图1)。
目前报道的人类m1A"writers"包括核糖体甲基化酶(NML,也称为RRP8)(rRNA)、tRNA甲基转移酶6非催化亚基(TRMT6)-RNA甲基转移酶61A(TRMT61A)复合体(mRNA和线粒体tRNA)、TRMT61B(线粒体tRNA和rRNA)、TRMT10B(tRNA)和TRMT10C(线粒体tRNA和mRNA)。m1A erasers,包括FTO(tRNA)和ALKBH家族成员ALKBH1(线粒体tRNA)、ALKBH3(tRNA和mRNA)和ALKBH7(线粒体tRNA),与一些m6A erasers重叠或密切相关。因此,一些m6A readers,即包括YTHDF1-3和YTHDC1在内的YTH结构域家族蛋白,已被证实能够鉴定m1A修饰(图2、3、5和表1)。
总的来说,m1A影响RNA碱基对,进而影响目标RNA分子的结构和功能。人类rRNA和tRNA中存在许多不同的m1A修饰位点。例如,28S rRNA位1322的m1A促进60S核糖体亚基形成,位947的m1A对线粒体核糖体结构和功能至关重要。tRNA位58的m1A对tRNA结构、稳定性和翻译启动至关重要;这一位点m1A缺失可能促进tRNA衍生小RNA(tDRs)产生,增强核糖体组装并引起恶性表型。在mRNA中,m1A分布在每个mRNA片段中,包括编码序列(CDS)、5'UTR和3'UTR,其作用似乎取决于区域或亚细胞位置。在起始密码子附近,m1A可能通过改变二级/三级结构或readers对翻译启动位点(TISs)的识别来调节翻译启动,从而促进翻译。线粒体中5'UTR或CDS中的m1A抑制翻译,可能是通过影响核糖体扫描或翻译(图2、3、5和表1)。
由于m1A与m6A共有一些调控因子,如YTHDF1-3和YTHDC1,m6A的研究方向可以为m1A提供参考。由于m1A修饰可以影响RNA碱基对,它可能影响miRNA与其他RNA结构(如mRNA 3'UTR、lncRNA和circRNA)的结合。竞争性内源RNA(ceRNA)调控网络近年来受到广泛关注,m1A修饰可能为这一理论增添新的概念。
m7G(N7-methylguanosine)
m7G指的是在鸟嘌呤N7位发生的RNA甲基化,存在于所有鸟苷的约0.4%中,其水平与m1A修饰相似。m7G因形成成熟mRNA、snRNA和snoRNA的5'帽结构(m7GPPPN)而闻名;此外,它在mRNA的5'UTR、CDS和3'UTR所有三个转录片段以及pre-mRNA中都富集。m7G也存在于非编码RNA中,如tRNA的46位、18S rRNA的G1575/G1639位,包括成熟miRNA和pre-miRNA中(图1)。
RNA鸟嘌呤-7甲基转移酶(RNMT)、METTL1-WD重复域4(WDR4)复合体和Williams-Beuren综合征染色体区域22蛋白(WBSCR22,也称为BUD23)被认为是m7G的"writers"。RNMT由RNMT激活小蛋白(RAM)激活下,对有效的帽甲基化必需。METTL1通过与WDR4或其他合作伙伴形成复合体,具有tRNA、内部mRNA和pri-miRNA/miRNA的m7G甲基转移酶活性。需要甲基转移酶接头蛋白TRM112,WBSCR22特别地在18S rRNA中甲基化m7G。在大多数非编码RNA中,m7G帽在成熟过程中可能因片段化或进一步修饰为m2,2,7G三甲基鸟苷而丢失。例如,三甲基鸟苷合酶1(TGS1)可能作为一个修饰因子,将snRNAs和snoRNAs的m7G帽高甲基化为m2,2,7G帽结构,导致它们在核焦点中聚集。m7G帽可以被eIF4E和由CBP80和CBP20组成的帽结合复合体(CBC)识别,从而影响RNA成熟、出核和翻译(图2-5和表1)。
mRNA上的m7G帽调节mRNA过程的多个阶段,包括pre-mRNA剪接、出核、转录扩展、翻译和降解,并间接增加核糖体合成和翻译效率。在内部mRNA上,m7G甲基化可能影响mRNA翻译。tRNA中的m7G通过维持tRNA结构完整性来重塑mRNA翻译体,促进其稳定性、翻译能力,并减少核糖体停顿。然而,m7G对rRNA的影响尚未深入研究。在miRNA中,m7G通过拮抗pri-miRNA中的G-四链体结构促进miRNA加工(图2-5和表1)。
众所周知,m7G在mRNA中广泛存在,是翻译过程中的关键调控因子,因此,它可能不是人类疾病中的有效治疗靶标。m7G调控因子在不同的RNA和疾病中的作用可能不同。例如,tRNA上的m7G修饰促进肺癌进展,而let-7 miRNA上的m7G修饰则可能抑制进展。m7G修饰促进肝细胞癌和膀胱癌进展,但在畸胎瘤中则产生相反效果。
ac4C(N4-acetylcytosine)
除了m5C和hm5C,ac4C是胞嘧啶上的另一种保守修饰,是目前在真核生物RNA中描述的唯一一种乙酰化。像许多RNA修饰一样,ac4C最初是在tRNA和rRNA中被鉴定,随后在mRNA中也被发现。在rRNA中,ac4C分布在哺乳动物18S rRNA解码位点附近的34号和45号螺旋;tRNA中,ac4C分布在真核生物的tRNASer/Leu的D-stem上。在mRNA中,ac4C位点沉积主要在编码序列(CDS)和5'非翻译区(5'UTR) 区域(图1)。
N-乙酰转移酶10(NAT10)是一种ATP依赖性RNA乙酰转移酶,目前被认为是ac4C的唯一"writer"。它在18S rRNA、tRNA和广泛的mRNA中催化ac4C修饰。在人类rRNA或tRNA中形成ac4C需要另外两个蛋白质:第一个是box C/D snoRNA U13,它对18S rRNA乙酰化至关重要,主要通过及时的pre-rRNA折叠来实现。另一个是含有THUMP结构域1蛋白(THUMPD1)的特异性RNA接头蛋白,具有可以与NAT10互作并协同参与tRNA乙酰化的RNA结合基序(图2、3、5和表1)。
在18S rRNA中,ac4C对pre-rRNA加工和核糖体合成至关重要,可能通过将18S rRNA 3'端转变为富含碱基修饰的环境来影响翻译能力,从而与mRNA或tRNA互作。tRNA中ac4C形成的功能尚未完全理解,但tRNA的ac4C可以促进其稳定性,并被认为是由于快速的tRNA降解通路,作为真核生物tRNA成熟过程的监测指标。此外,ac4C可以影响mRNA翻译。mRNA CDS区域上的ac4C显著增强了mRNA的稳定性并促进蛋白翻译,可能是通过影响其在翻译过程中与相应tRNA的互作。然而,5'UTR上的ac4C修饰主要通过直接和间接介导的精确位点特异性来影响翻译起始:强AUG起始密码子附近的ac4C修饰可以抑制翻译,而弱翻译起始启动位点下游的ac4C修饰则可以促进翻译(图2、3、5和表1)。
作为一种新发现的RNA修饰,ac4C在很大程度上仍然未知,特别是它的调控因子和分子功能。目前只确认了一个writer,还没有鉴定出erasers和readers。已有报道显示ac4C在rRNA、tRNA以及mRNA的CDS和UTR区域中的功能,然而相关的研究还很少。需要进行更多的调查研究。
Ψ(Pseudouridine)
大约70年前发现的Ψ(假尿苷)是尿苷的C5-糖苷异构体,其中杂环的C5原子与戊糖的C1'原子相连。Ψ存在于几乎所有类型的RNA中,包括编码和非编码RNA,在物种间高度保守(图1)。
在人类中已经鉴定出13种Ψ的“writers”,其中之一是Dyskerin假尿苷合成酶1(DKC1),它是H/ACA snoRNP复合体的催化亚基,该复合体催化rRNA假尿苷化,需要RNA介导发挥其催化活性。其余12种writers是不依赖RNA的单个假尿苷合酶(PUSs):PUS1、PUSL1、PUS3、TRUB1、TRUB2、PUS7、PUS7L、RPUSD1-4和PUS10;这些酶具有特定的细胞定位和RNA靶标。到目前为止,还没有已知的Ψ erasers和readers。erasers缺失可能是由于由核糖和碱基形成的相对惰性的C-C键,导致假尿苷化过程不可逆(图2、5和表1)。
以往研究表明,Ψ在RNA生物发生、结构、稳定性和功能中发挥着功能作用,参与调控基因表达。tRNA包含许多假尿苷化位点,这些位点对维持稳定的tRNA结构、介导tRNA密码子-反密码子碱基配对至关重要,因此参与翻译过程。Ψ还通过改变tRNA来源片段的性质来抑制异常蛋白质合成。与tRNA情况类似,Ψ也丰富地存在于各种rRNA区域,有助于稳定结构形成。此外,Ψ有助于核糖体加工和功能,以确保蛋白质合成中的翻译准确性。在snRNA中,Ψ被预测影响结构和RNA-RNA或RNA-RBP互作,以在前mRNA剪接中发挥作用。Ψ还参与调节pre-mRNA加工、mRNA结构、稳定性、翻译准确性和终止,这是除tRNA和rRNA修饰之外的另一种翻译调控机制(图2、5和表1)。
尽管Ψ在几十年前就已经被发现,但它对多种细胞过程的贡献才刚刚开始被揭示。与ac4C类似,新事物总是需要时间来理解。阐明Ψ的erasers和readers将是未来的关键研究方向之一。特别是,Ψ已经被应用在生成高效的COVID-19 mRNA疫苗中,这是这种修饰的临床应用,并且对进一步研究具有潜在价值。
尿苷化(Uridylation,U-tail)
除了普遍的同源poly (A)尾巴之外,由非模型加成组成的尿苷化似乎是3' RNA末端第二大最常见的修饰。尿苷化可以发生在包括mRNAs在内的所有真核RNA类别上,以及包括U6剪接体RNA、gRNA、siRNA、miRNA、Piwi互作RNA(piRNA)、rRNA和tRNA在内的非编码RNA上。尿苷化还靶向病毒RNA标记(图1)。
在不同的底物中,尿苷化由不同的末端尿苷酸转移酶(TUTases)催化,这些酶属于非典型末端核苷酸转移酶(TENTs)家族。在核内U6 snRNA中,U6 TUT酶(TUT1)在3'端特别添加或恢复至少四个尿苷。TUT4和/或属于TENT3亚家族的TUT7是其他细胞尿苷化的主要"writers"。尚未报道尿苷化erasers和修饰因子(modifiers),而尿苷化readers包括LSM1-7复合体(靶向寡尿苷化)、DIS3L2(靶向寡尿苷化和多尿苷化)和La蛋白(图2和表1)。
尿苷化从多个方面改变RNA命运,包括RNA成熟、功能、稳定性和衰变。尿苷化对U6 snRNA成熟和3'稳定至关重要,以执行剪接功能并启动gRNA成熟。尿苷化在miRNA中的功用多样。例如,TUT介导的pre-miRNA尿苷化是miRNA生物生成的关键步骤,涉及修复或移除有缺陷的pre-miRNA、arm转换和Dicer加工。尿苷化在miRNA 3'端可以鉴定非典型靶位点;另一方面可能通过直接影响miRNA 3'UTR互作来消除靶基因抑制。此外,尿苷在3'端添加促进miRNA降解,同样也适用于其他小RNA,如siRNAs和piRNAs。许多研究表明,尿苷化促进了5'-3'mRNA或3'-5' mRNA衰变,主要通过招募去腺苷酸酶、脱帽酶和外切核酸酶介导。尿苷化还通过各种机制调节翻译效率,例如mRNA不稳定以及rRNA和tRNA周转。此外,病毒RNA尿苷化参与抗病毒防御。尿苷化的ncRNAs在外泌体中过表达,表明尿苷化介导RNA分选到外泌体中(图2、4和表1)。
尿苷化可以作用于真核细胞中几乎所有类别的RNA,进一步鉴定"writers"及其辅助因子在鉴定特定RNA底物方面以及调节去尿苷化和决定尿苷化转录本命运的erasers和readers,无疑是深入理解调控网络的关键。尿苷化的细胞类型和疾病特异性模式在揭开尿苷化在细胞生物学中的作用方面也至关重要。
腺苷-肌苷(A-to-I)RNA编辑(Adenosine-to-inosine editing)
A-to-I编辑是一种通过脱氨作用将腺苷转换为肌苷的RNA分子修饰,是在哺乳动物中普遍存在的一种共转录和转录后修饰。A-to-I编辑广泛发生在pre-mRNA、mRNA、非编码RNA(如miRNA、lncRNA)以及tRNA中,甚至在病毒RNA中也存在。A-to-I RNA编辑通常靶向由倒置Alu重复元件形成的双链RNA发夹结构,这些结构主要位于内含子和非翻译区域,而在编码外显子中较少。
A-to-I编辑是腺苷残基直接转换为肌苷残基过程,这不是一个传统的“writer”过程,因此A-to-I编辑的“writer”也是编辑器。腺苷脱氨酶tRNA特异性1(ADAT1)负责在真核生物tRNA中将腺苷37脱氨化为肌苷,而某些tRNA上34位的A-to-I转换由ADAT2和ADAT3催化。其他A-to-I编辑事件由作用于RNA的腺苷脱氨酶(ADAR)家族成员催化,这些在哺乳动物中保守。ADARs拥有相似的功能域结构,包括双链RNA结合域(dsRBDs)和一个较大的催化腺苷脱氨酶域。ADAR有三个成员:ADAR1和ADAR2脱氨双链(ds)RNA,而ADAR3可以结合dsRNA以及单链(ss)RNA。ADAR3缺乏编辑活性,可能通过与其他ADARs竞争性结合dsRNA来降低这些酶的效率。
与其它附加化学修饰不同,A-to-I编辑可能不会受到erasers、modifiers和readers的进一步调控。通常这种特定腺苷编辑可以诱导转录组多样性,并影响靶RNA功能。尽管A-to-I编辑在编码区域发生的概率相对较低,但研究表明它通过改变蛋白质密码子影响蛋白质翻译和功能。例如,在结直肠癌中,RHOQ转录本的A-to-I编辑导致RHOQ蛋白136位的天冬酰胺被丝氨酸替代,从而导致RHOQ活性增加和癌症侵袭潜力增强。在UTR中,A-to-I RNA编辑可以调节包括转运、翻译和降解在内的RNA过程。例如,ADAR1直接编辑XIAP和MDM2 mRNA的3'UTR,以促进这些mRNAs的核保留。A-to-I编辑有助于招募稳定化的RNA结合蛋白人抗原R(HuR)到CTSS mRNA的3'UTR,从而增强CTSS mRNA的稳定性和翻译。此外,3'UTR中的A-to-I RNA编辑有抑制miRNAs与靶基因互作的潜力,以阻碍转录后抑制活性。内含子中的A-to-I RNA编辑通常调控可变剪接过程。例如,ADAR1缺失可能导致ABCB1基因内含子27的可变剪接,产生带有保守内含子的转录本,导致无意义介导的mRNA衰减和ABCB1 mRNA稳定性降低。miRNA中的A-to-I RNA编辑可能影响miRNA的生物生成和功能。A-to-I RNA编辑还抑制内含子中的Alu元件形成双链RNA结构,导致线性mRNA和circRNAs的生成变化。
一些报告表明,pri-miRNA或pre-miRNA中的A-to-I RNA编辑可能引起局部结构构象变化,导致片段化抑制和成熟miRNA生物生成减少。相反,一些A-to-I RNA编辑可能不干扰或促进miRNA生物生成。特别是ADARs也可能作为RNA结合蛋白与pre-miRNA直接结合,通过不依赖于相邻A-to-I编辑事件的方式促进miRNA加工。成熟miRNAs或siRNAs中的A-to-I编辑可能影响它们对靶mRNA的选择和沉默效率。在lncRNAs中,A-to-I编辑可以影响它们的二级结构、稳定性和与其他分子的互作。例如,lncRNAs中的A-to-I RNA编辑可能影响lncRNA-miRNA互作,因此改变它们的miRNA海绵功能。在tRNAs中,A-to-I编辑与它们的解码能力密切相关。在病毒RNA中,A-to-I RNA编辑可以直接靶向RNA病毒的基因组或转录组来调控病毒致病性以及宿主先天免疫反应。
尽管如此,这个领域还有很多问题有待解答。编辑器如何选择A-to-I编辑的靶位点?尽管以前的研究已经鉴定了许多人类RNA分子中的A-to-I编辑位点,但这些编辑对绝大多数RNA位点的意义仍然不清楚。由于A-to-I编辑可以通过多种机制调控基因表达,它可能是协助或替代RNA干扰的潜在方法。除了影响miRNA-3'UTR和miRNA-lncRNA互作外,A-to-I编辑还可能影响miRNA-circRNA互作,这尚未得到验证。对RNA编辑的进一步研究可能为精确基因编辑提供经验。
小结:
- m6A修饰:在真核生物中最普遍和丰富的mRNA修饰,通过m6A甲基转移酶复合体(MTC)介导,涉及多种细胞过程,包括转录、成熟、定位、翻译和降解。
- m5C修饰:在tRNA和rRNA中丰富,由NSUN家族成员和DNMT2引入,影响RNA结构和稳定性。
- m1A修饰:在多种RNA类型中存在,与m6A修饰密切相关,影响RNA分子结构和功能。
- m7G修饰:在成熟mRNA的5'帽结构中形成,对RNA成熟、出核和翻译有重要作用。
- ac4C修饰:在rRNA、tRNA和mRNA中发现,由NAT10介导,促进mRNA稳定性和翻译。
- Ψ修饰:在几乎所有类型的RNA中存在,对RNA的生物发生、结构、稳定性和功能有重要作用。
- 尿苷化修饰:在eukaryotic RNAs的3'末端发生,影响RNA的成熟、功能、稳定性和衰变。
- A-to-I编辑:在RNA分子中将腺苷转化为肌苷,由ADAR家族成员催化,影响mRNA的转运、翻译和降解。
近年来,免疫细胞异常在人类疾病中的研究进展迅速,RNA修饰在免疫细胞的多个生物学过程中发挥作用,包括发育、分化、激活、迁移和极化,从而调节免疫反应,并参与某些免疫相关疾病。m6A、m5C、m1A、m7G、ac4C、Ψ、尿苷化修饰和腺苷-肌苷(A-to-I)RNA编辑在内的RNA修饰在免疫细胞生物学中的关键作用。通过调节免疫细胞的生物学过程,RNA修饰可以参与免疫相关疾病的发病机制,如癌症、感染、炎症和自身免疫疾病。
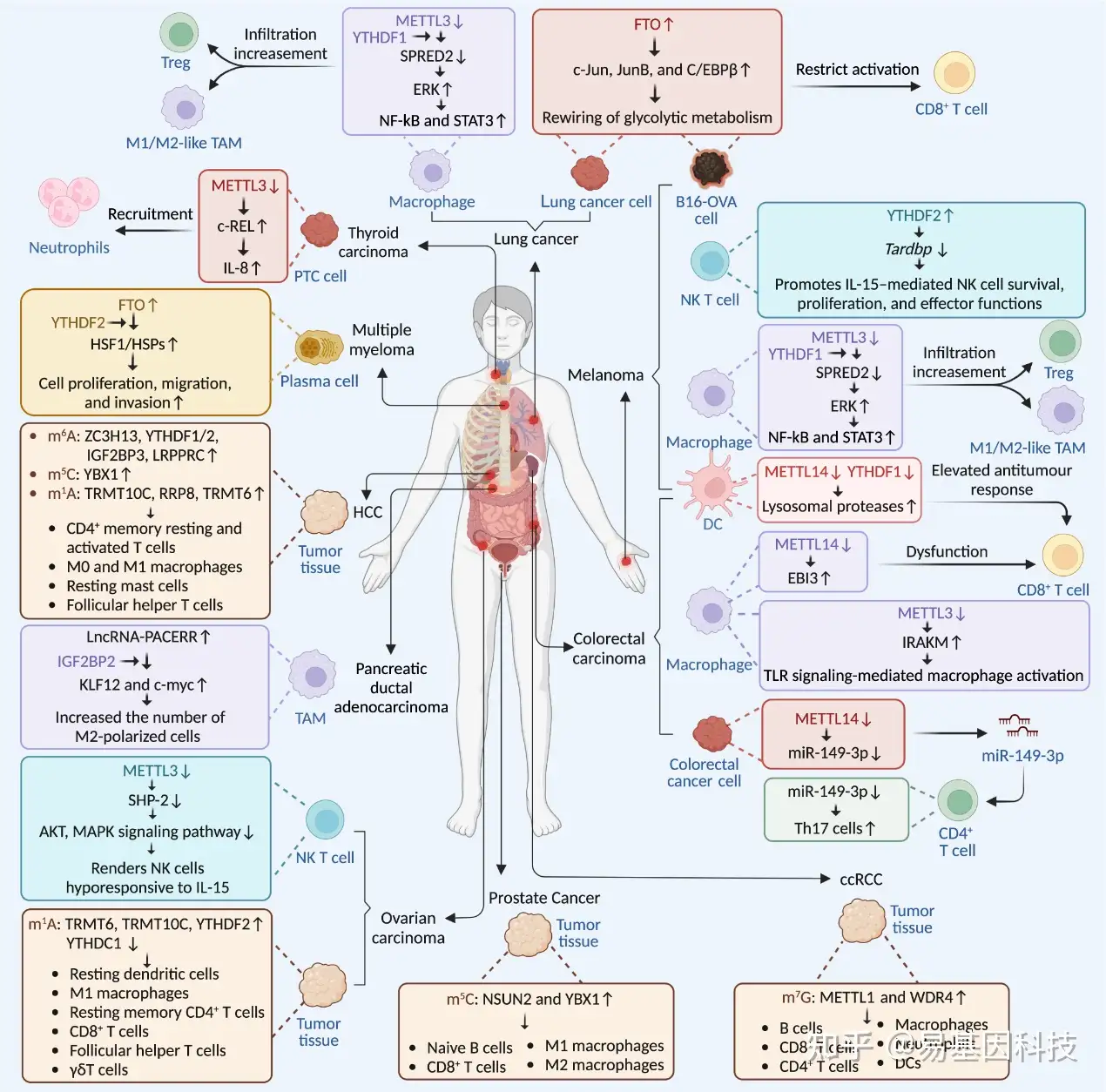
图6:各种癌症中免疫细胞相关的RNA修饰
参考文献:
Cui L, Ma R, Cai J, Guo C, Chen Z, Yao L, Wang Y, Fan R, Wang X, Shi Y. RNA modifications: importance in immune cell biology and related diseases. Signal Transduct Target Ther. 2022 Sep 22;7(1):334. pii: 10.1038/s41392-022-01175-9. doi: 10.1038/s41392-022-01175-9. PubMed PMID: 36138023.
相关阅读:
1. MeRIP-seq揭示m6A修饰在肺动脉高压(PAH)发病机制中的潜在作用和新治疗靶点
3. 90天见刊,易基因m6A RNA甲基化(MeRIP)+转录组组学研究
5. 高通量测序后的下游实验验证方法——m6A RNA甲基化篇
7. 干货:m6A RNA甲基化MeRIP-seq测序分析实验全流程解析
8. m6A peak鉴定经典点软件exomPeak原理解析
9. MeRIP-seq综合分析肺腺癌中的转录组m6A甲基化组
10. RNA m⁶A甲基化测序(MeRIP-seq)技术介绍
11. Adv Sci:NSUN2介导m5C修饰代谢重编程促进肿瘤进展 揭示治疗新选择
12. NAR:RCMS编辑系统在特定细胞RNA位点的靶向m5C甲基化和去甲基化研究
13. 干货:手把手教你做RNA m5C甲基化测序分析(RNA-BS)
15. m1A RNA甲基化测序(MeRIP-seq/m1A-seq)



