易基因:表观遗传学和表观转录组修饰在植物金属和准金属暴露中的作用 | 抗逆综述
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
非必需金属(non-essential metal)和准金属(metalloid,也称类金属)对土壤的污染是全球许多地区面临的严重问题。这些非必需金属和准金属对影响作物产量和人类健康的所有生物体均有毒性。作物暴露于高浓度的这些金属中会导致矿物质稳态失调、光合作用效率降低、细胞分裂抑制、氧化应激、基因毒性影响,以及随后的生长阻碍。植物可以激活表观遗传和表观转录组机制来维持细胞和生物体稳态。表观遗传学修饰包括胞嘧啶和腺嘌呤DNA碱基修饰模式变化、细胞非编码RNA变化、组蛋白变体和共价组蛋白尾部修饰重塑。其中一些表观遗传学变化是持久的,可能有助于后代的应激记忆和调控应激耐受性。在新兴的表观转录组学领域,表观转录组修饰(细胞转录本中核苷酸的化学共价修饰)是基因表达的更快速调控因子。尽管在理解植物对生物和非生物胁迫的表观遗传学变化方面取得了重大进展,但缺乏对植物对金属的表观遗传响应的全面综述。虽然表观转录组学在植物发育过程和胁迫响应中的作用正在显现,但对金属响应的表观转录组修饰尚未得到综述。本文描述了对环境、植物和人类健康构成最严重威胁的非必需金属镉(Cd)、铅(Pb)、汞(Hg)、铝(Al)和准金属砷(As)对植物中全基因组和位点特异性DNA甲基化、组蛋白修饰和表观转录组修饰的影响。本研究对于理解植物如何响应金属暴露胁迫至关重要,并且可能为减轻金属污染对农业和环境的有害影响提供策略。
DNA甲基化
镉(Cd)
镉(Cd)的特点是相对较高的流动性,因此很容易被植物吸收并在植物器官内转运。暴露于镉金属会导致水分和矿物质稳态失调,降低叶绿素水平和光合作用效率。镉诱导氧化应激,从而导致脂质过氧化以及蛋白质和核酸氧化的增加,表现为微核和染色体畸变水平升高。此外,暴露于镉的植物还表现出超微结构变化、种子发芽减少和生长减缓。
镉处理植物的DNA甲基化水平和模式取决于植物种类、应用的金属浓度和处理时间。MSAP-PCR结果表明,在拟南芥(Arabidopsis thaliana L.)中,用Cd处理导致外部胞嘧啶甲基化增强,而内部胞嘧啶没有观察到显著差异。在曼陀罗(Datura stramonium L.)植株的甲基化敏感扩增多态性分析(MSAP)结果表明,土壤和叶面施用Cd都导致DNA甲基化增加。在濒危蕨类植物中华水韭(Isoetes sinensis)中,镉和铅诱导半甲基化,即DNA单链上的胞嘧啶甲基化。另一方面,在金属处理的植物中观察到完全甲基化水平降低,即双链DNA上内部和外部胞嘧啶甲基化。在大豆(Glycine max L.)中,无论是在处理后还是在恢复期七天后,Cd都不会影响ELISA检测的整体DNA甲基化水平。在红麻(Hibiscus cannabinus L.)中,与亲本品种福红992(CP085)和P3A(CP089)相比,杂交F1表现出更高的镉耐受性和最低的DNA甲基化水平。在差异甲基化基因中,在编码富集亮氨酸重复序列受体样激酶(LRR-RLK)、NRT1/PTR家族蛋白质(NPF2.7)和DEAD-box-ATP依赖性RNA解旋酶51(DHX51)的基因中观察到对Cd响应的低甲基化,而在编码海藻糖磷酸磷酸酶(TTP-D)、NADP依赖性苹果酸酶(NADP-ME)和NAC结构域蛋白质(NAC71)基因在对镉响应中也表现出差异表达,尽管这种模式与甲基化模式没有直接关系。LRR-RLK和NAC71下调,而NPF2.7、DHX51、TTP-D和NADP-ME上调。另一项研究比较了金属超积累植物Noccaea caerulescens L.和非超积累植物Arabidopsis thaliana的响应。尽管N.caerulescens积累的镉是A.thaliana的三倍多,但后者对镉响应显示出显著更高DNA损伤程度和更高的DNA氧化标记物7,8-二氢8-氧代-2-脱氧鸟苷(8-oxo-dG)水平。methy-sens彗星分析结果显示,镉诱导N.caerrulescens的DNA甲基化,伴随MET1高表达。而A. thaliana植物的特征是DNA甲基化减少、MET1表达降低和DRM2诱导。在超积累植物中观察到DNA甲基化增强可能有助于DNA保护和更高的金属耐受性。水稻(Oryza sativa L.)的全基因组重亚硫酸盐测序(WGBS)揭示了近2400个差异甲基化区域(DMR),其中基因上游区域的高甲基化是最典型响应。甲基化基因功能分析表明大多属于“细胞过程”、“代谢过程”和“刺激响应”。
DNA甲基化模式变化可能通过参与甲基化或去甲基化过程的酶调控表达或活性来反映。在海草Zostera marina中,镉暴露导致CMT3和DRM2甲基化酶表达增加,ROS1去甲基化酶表达减少,可能导致DNA 5mC水平增加。对远端短柄藻(Brachypodium distachyon)的转录组学分析表明,Cd诱导了拟南芥Aly1和Aly2的直系同源Bradi4g26905基因。编码的ALY蛋白参与mRNA转运和DNA甲基化。在金属超积累菌A.helleri的两个不同种群中(源自意大利的I16种群和生长在波兰的PL22种群),也观察到DNA甲基化调控基因表达的镉依赖性变化。而I16和PL22种群植物表现出相反的效果。PL22的 Cd暴露导致参与DNA甲基化的MET1、WIM1、DRM2基因以及与编码组蛋白赖氨酸N-甲基转移酶(KRYPTONITE,KYP)、组蛋白H3mK9去甲基化酶(BONSAI甲基化1,IBM1增加)和组蛋白去乙酰化酶8(HDA8)的组蛋白修饰相关的基因的表达增加,且伴有染色质浓缩。相反,种群I16表现出所有上述基因的表达降低。在拟南芥中,WGBS分析显示,Cd诱导DNA甲基化,主要在CHG和CHH环境中,并显著抑制去甲基化酶ROS1、DML2和DML3的表达。ROS1、DML2和DML3表达缺失突变体具有较高的金属耐受性和较低的镉吸收。在Amaranthus cruentus中,在最佳条件下并响应金属处理评估八种甲基化酶(AcDRM2a、AcDRM2b、AcCMT1、AcCMT2a、AcCMT2b、AcCMP3、AcMET1a和AcMET1b)和两种去甲基化酶的表达(AcDML2a和AcDML2b)。最显著的响应表现在根中,这是金属作用的第一个位点。暴露于镉、铅和锌诱导了所有分析基因的表达。AcCMT1、AcCMT2a、AcDRM2b、AcMET1和AcDML2a以及AcDML2b的强烈诱导也对组合Cd/Zn和/或Cd/Pb处理响应。在叶片中,最显著响应表现在Pb胁迫下刺激AcDRM2a的表达。上述研究证明,镉暴露与DNA甲基化/去甲基化机制中编码酶的基因表达变化有关。然而,目前尚不清楚这种变化是构成调控作用,还是Cd作用的副作用。如果是Cd作用的副作用,则可能是金属毒性的症状,导致DNA甲基化的巨大变化,进而导致影响植物整体功能的许多基因表达的变化。
镉吸收可能依赖于转运蛋白基因甲基化状态和表达水平变化。在玉米(Zea mays L.)中,镉导致Met1、Met2a、Met2b、Met3a、Met3b、Met3c和Met4甲基转移酶的表达显著增加,同时IRT1、ZIP1、ZIP2和ZIP6转运蛋白的甲基化水平增加。在小麦(Triticum aestivum L.)中,比较了耐金属品种和敏感品种响应情况,在Cd、Pb和Zn处理下,耐金属品种的几个转运蛋白基因的启动子区甲基化水平较低。这些变化伴随着TaABCC2、TaABCC3、TaABCC4和TaHMA2转运蛋白基因的高表达。这种情况下,转运蛋白基因甲基化减弱可能促进了金属外排和液泡隔离,从而增强了耐受性。
铅(Pb)
根据有毒物质和疾病登记局(ASTDR)的数据,铅是继砷之后的第二种有毒重金属/准金属,其在生物系统中的作用尚未完全阐明。据报道,铅毒性的影响包括水分平衡紊乱、种子发芽减少、植物生长减缓、膜损伤、气孔闭合和氧化损伤。铅毒性还表现在对参与光合作用、氮和核酸代谢的几种酶的抑制上,如δ-氨基戊二酸脱水酶(ALAD)、核酮糖-1,5双磷酸盐(Rubisco)、磷酸烯醇丙酮酸羧化酶(PEPC)、谷氨酰胺合酶、硝酸还原酶、脱氧核糖核酸酶和核糖核酸酶。
关于植物对铅胁迫的表观遗传学响应的报道相对较少。在玉米中,研究了镉、锌和铅对选定转运蛋白基因启动子DNA甲基化的影响。研究结果表明,铅暴露导致ZIP2和ZIP8启动子的甲基化水平增加。同时,观察到组蛋白去乙酰化酶基因(ZmHD1b、ZmHDA102、ZmHDA110、ZmHDL2a、ZMHD2b、ZmHDD 2c、ZmHD A106)表达降低。由组蛋白乙酰化和某些启动子的DNA甲基化驱动的染色质图谱变化调控特定转运蛋白表达,反过来又影响植物对矿物质的吸收和体内平衡。同一项研究表明,Pb处理导致玉米植株的茎中钙(Ca)水平增加,根系和茎中的镁(Mg)水平增加,根中的Ca水平和叶片中的Mg水平下降。
在萝卜(Raphanus sativus L.)植物中也报道了铅对转运蛋白基因甲基化和表达的影响。WGBS揭示了Pb处理和对照中11930个差异甲基化区域(DMRs),其中高甲基化是最典型的响应。甲基化主要在CG环境中(约49%),其次是CHH(约29%)和CHG(约26%)。甲基化对基因表达有不同的影响——在76个高甲基化区域和38个低甲基化区域中下调,而72个高DMR和42个低DMR被上调。铅处理导致编码转运蛋白和转录因子的几个基因的甲基化和表达发生显著变化。在RsABCF5、RsABCG14和RsZIP11转运蛋白基因和RsWRKY46转录因子中甲基化增加并伴有表达受阻。在编码MATE外排蛋白、重金属转运蛋白(HMT)和ZFP转录因子的基因中,5mC水平降低,表达增强。
铝 (Al)
铝(Al)是地壳中含量最丰富的金属,是酸性土壤中主要的植物毒性物质,归因于其在低pH下具有高度的生物可利用性。铝的主要作用部位是植物根部。铝暴露会导致细胞壁增厚、细胞分裂受阻,从而阻碍根系生长,同时导致对营养物质和水分吸收减少。铝对一些必需离子(如钙(Ca2+)和钾(K))转运蛋白的抑制作用进一步增强了铝诱导的营养缺乏。铝植物毒性的其他症状包括叶片黄化和卷曲、光合作用减弱和活性氧(ROS)水平升高。
Gallo-Franco等人最近对植物对Al的表观遗传学响应进行了综述:在包括拟南芥、小麦、玉米、烟草(Nicotiana tabacum L.)和高粱(sorghum bicolor L.Moench)在内的多种植物对Al响应发生DNA甲基化水平变化。一般来说Al诱导DNA去甲基化。如在较低耐铝性的小黑麦品系中DNA甲基化略有下降。耐铝品系的DNA甲基化略增加。以上结果通过反相高效液相色谱法(RP-HLPC)观察,而不是通过甲基化敏感扩增片段长度多态性(metAFLP)或MSAP方法。
对栽培品种(Oryza sativa)和更耐铝的野生品种(O. glumaepatula)水稻进行全基因组甲基化比较。O.sativa中鉴定4633个差异甲基化区域(DMRs),其中38%区域甲基化增加,62%区域低甲基化。而O. glumaepatula中,72%DMR高甲基化,38%低甲基化。O.sativa的21个和O. glumaepatula的37个DMR相关基因(DAG)与Al响应基因相关,约70个DMR位于与Al响应基因附近的转座元件(TEs)中。
大麦植物(Hordeum vulgare L.)通过HvAACT1(Al激活的柠檬酸盐转运蛋白1)上游序列中逆转录转座子插入的DNA去甲基化来应对Al胁迫,这增强了HvAACT2在根中的表达,从而促进了Al外部解毒。总的来说,这些研究表明DNA甲基化机制参与了铝耐受,然而需要进一步研究来了解具体的机制成分。
汞(Hg)
汞(Hg)暴露可能导致应激耐受性的长期遗传变化,这些变化至少部分依赖于表观遗传修饰。因此植物可以获得所谓的应激记忆,不仅影响它们的应激响应,也影响后代响应。例如拟南芥中,经铜(Cu)和镍(Ni)处理导致后代对这些金属以及甲基甲烷磺酸盐和盐胁迫的耐受性更高。在水稻中观察到可遗传的甲基化模式变化,暴露于铜(Cu)、镉(Cd)、铬(Cr)和汞(Hg)的植物在与TE和蛋白质编码基因相关的序列中显示出CGH的DNA低甲基化。DNA甲基化调控伴随着染色质调控相关基因表达变化——-主要是甲基化相关基因(MET1-2,CMT3-2)表达下调,并诱导去甲基化过程(DME)相关基因表达上调。在汞应激下分析了响应的可遗传性。在汞胁迫后的第一代中观察到三种甲基化模式:与亲本植物相同的模式、进一步低甲基化或低甲基化逆转。其中,增强的低甲基化是最常见的模式。DNA甲基化模式至少部分地由S1和S2代遗传。除了甲基化变化外,第二代植物对汞的耐受性更高,表现为生长抑制和叶绿素损失减弱。
在另一项关于水稻的研究中报告了几种基因表达的可遗传变化。经Cu、Cd、Cr、Hg处理的植物显示出Tos17、Osr42、HSP70、OsHMA1、osHMA2、OsHMA5-OsHMA9以及同源框(homeobox)和延伸因子编码基因的诱导表达。表达模式至少部分由来自Hg处理植物的S1和S2代的后代遗传。为了阐明转录本丰度变化是否与DNA甲基化有关,分析了Tos17 TE的甲基化模式。结果表明,Hg诱导的甲基化模式与对照相关,且可遗传后代。然而数据表明Tos17表达模式与甲基化之间没有直接的相互关系,TE在暴露于Hg的植物以及后代植物中保持无活性。
使用WGBS分析了水稻甲基化组中汞依赖性变化。该研究使用Hg敏感和Hg抗性品系,其中Hg抗性品系选自OsMET1基因突变的植物。测序结果表明,高甲基化是对Hg的主要响应。CHH变化最频繁,CG位点表现出最高稳定性;抗汞系的变化更为动态。在Hg处理下差异甲基化的基因包括与信号通路、应激响应和翻译过程相关基因。引用的研究表明,汞会影响植物DNA甲基化状态。然而其模式取决于应用条件,即使在同一植物中(如水稻),一些研究显示Hg依赖性低甲基化,而其他研究显示高甲基化。此外所提供的数据表明,甲基化模式可以被下一代植物遗传,并可能与它们对金属的耐受性增强有关。
砷(As)
砷(As)在地壳中含量适中,可以以各种氧化形式存在,其中AsV和AsIII是植物最具生物利用度和植物毒性的物种。AsIII通常比AsV更具毒性,因为AsIII可以与影响其结构和功能的蛋白质巯基结合。AsV还通过细胞通路中磷酸盐的竞争和替代负作用于植物代谢。重要的是,As可以积累在植物的可食用部分,严重影响人类健康。砷对水和作物的污染是全球一些地区面临的严重问题,约20亿人受到砷污染。长期暴露于高水平砷与皮肤癌、肝癌、肺癌、泌尿道癌、前列腺癌和血癌等多种癌症相关。
As暴露的影响还包括表观遗传变化。例如在超积累植物Cretan brake fern(Pteris cretica L.)中,As导致DNA甲基化降低,但这种响应仅在老叶中观察到。而幼叶中甲基化状态不变,且与施用的As浓度无关。有假设认为,与金属类似,砷的吸收受DNA甲基化调控。甲基胞嘧啶结合蛋白VIM1(Variant In Methylation/Orthrus)过表达导致拟南芥中As耐受性较高,而这种类金属水平较低。与野生型植物相比,VIM1缺失突变体表现出更高的As积累和更严重的毒性症状。更详细的分析表明,VIM1介导转运蛋白基因启动子的DNA甲基化,导致其表达降低并导致As吸收减少。
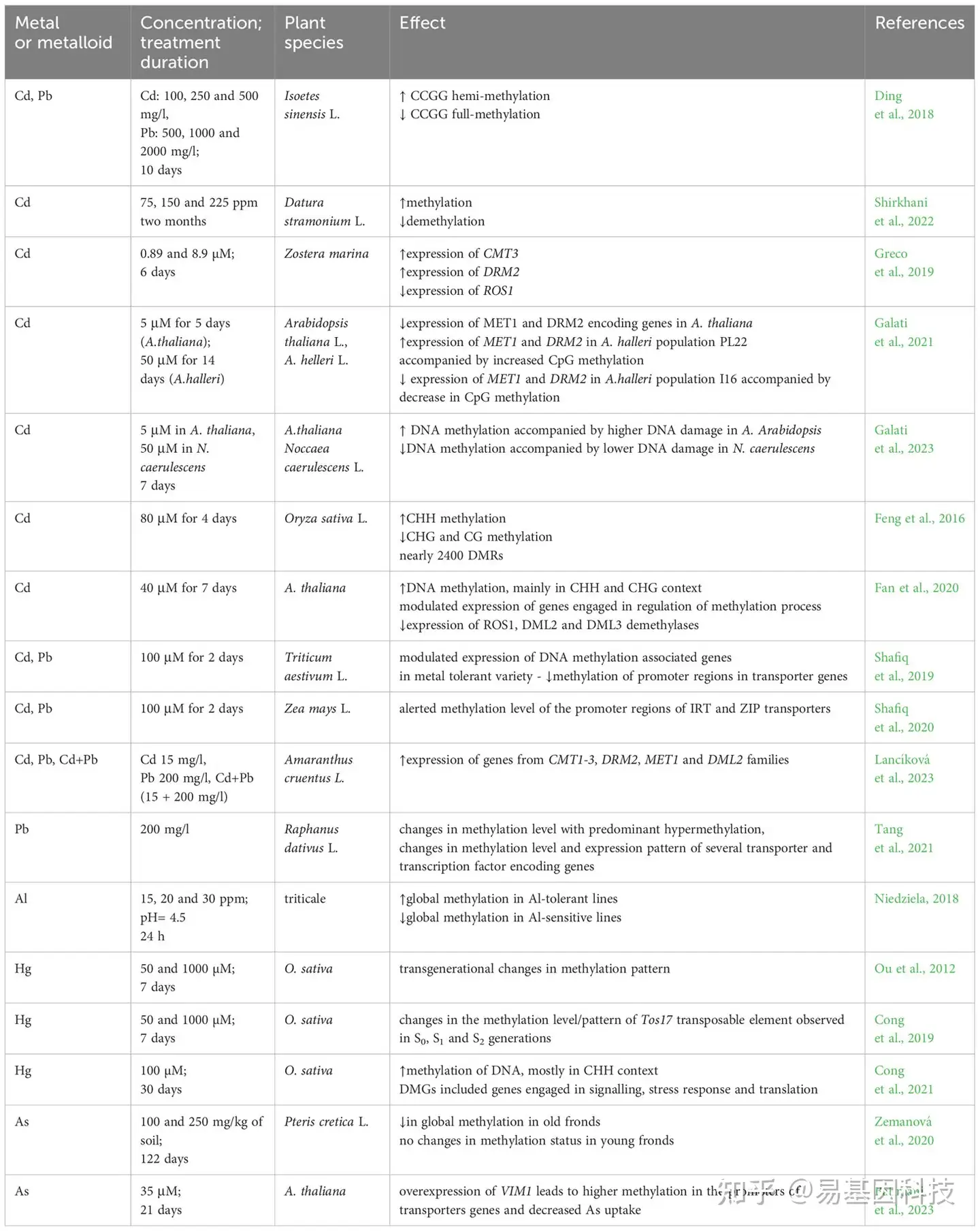
表1:金属和准金属对DNA甲基化水平和模式的影响
DNA甲基化水平上必需和非必需金属处理的示例:CMT-染色质甲基化酶,DMGs-差异甲基化基因,DML-Demeter样蛋白,DRM-结构域重排甲基化酶,IBM-组蛋白H3mK9去甲基化酶,HDA-组蛋白去乙酰化酶,KYP-组蛋白赖氨酸N-甲基转移酶,MET-甲基转移酶,ROS1-沉默阻遏蛋白,VIM1-甲基化/Orthrus变体。
组蛋白修饰
暴露于非必需金属在不同水平上调控组蛋白表达,包括转录本和蛋白质丰度。例如在大麦中,敏金属品系表现为镉依赖性的H2A、H2B、H3和H4组蛋白编码转录本水平下调,而在耐金属品系中未观察到变化。在大豆细胞悬浮液中,镉诱导H2A组蛋白的积累。金属调控参与组蛋白修饰相关基因的表达,例如在棉花(Gossypium L.)和玉米中,与组蛋白乙酰化和去乙酰化相关的几个基因在镉胁迫下高表达。表达模式在同一种植物的不同品系中可能不同。Cd处理导致A.halleri PL22中编码KYP、IBM1和HDA8的转录本丰度增加,但I16中的转录本丰度降低。蚕豆(Vicia faba)根分生组织细胞的免疫荧光技术也证明了组蛋白修饰变化。在所有三个分析的细胞周期阶段(G1、S和G2)中,与对照相比,Cd处理的植物观察到组蛋白3在赖氨酸79位(H3K79Me2)的去甲基化减少,这与复制起始事件相关。镉暴露导致组蛋白3在苏氨酸45(H3T45Ph)的磷酸化减弱,这是一种参与DNA复制过程的修饰。而在S细胞周期阶段,Cd处理的植物中观察到组蛋白3赖氨酸56(H3K56Ac)乙酰化水平增加。
金属胁迫过程中组蛋白修饰的可能作用也在突变体植物中被报道。Jumonji-C结构域蛋白(JMJ)属于组蛋白去甲基酶,在Hg、Pb和Cu处理下,SIJMJ524基因在番茄植株中表达增加。SIJMJ524基因在拟南芥中的过表达调控了拟南芥对镉的耐受性,幼苗表现出耐受性降低趋势,而较老植株则表现出耐受性增强趋势。Cd处理下,SIJMJ524过表达植株表现出金属吸收(ZIP1、IRT1、COPT2、NRAMP1)和转运(ABCC1、PDR1、GSH1、GSH2)基因表达上调。而一些转运和解毒相关基因表达减弱,如植物螯合蛋白合成酶(PCS1,PCS2)和谷胱甘肽还原酶(GR1)基因。酚类化合物是参与植物胁迫防御富集的次生代谢物,通过参与金属结合、木质素合成和壁增厚或抗氧化功能的SIJMJ524过表达调控酚类物质合成。突变体植株黄酮积累量较高,苯丙氨酸解氨酶(PAL)和黄酮醇合酶(FLS)基因表达增加。另一方面,DFR(二氢黄酮醇4-还原酶)和CHI(查尔酮异构酶)表达降低。
表观转录组学变化
尽管70年前就首次描述了植物RNA修饰,但直到过去十年中才出现新技术的应用,研究进展缓慢。最近的研究表明,经过修饰的核苷酸可以改变转录本半衰期、翻译效率以及细胞和植物器官内的转运。然而对于RNA修饰在植物胁迫响应中的作用,特别是对金属和类金属的作用,人们知之甚少。
腺苷在N6位(m6A)甲基化是植物中最常见和最广泛的核苷酸修饰。腺苷甲基化机制中的拟南芥突变体是胚胎致死的,这一事实凸显了其在植物发育过程中的深远意义。在成熟的拟南芥植物中,腺苷甲基化减弱导致维管束、毛状体、根、莲座叶、根和花的发育受到干扰。最近研究表明m6A与衰老相关。在植物的胁迫响应中报告了m6A模式变化。在金属胁迫下研究了Cd和Pb处理后大豆和暴露于Cd的大麦中的m6A。大麦7天镉暴露通常会导致腺苷甲基化,在435个差异表达基因(DEGs)中,大多数(319个)表现出甲基化增加和RNA丰度增加。上调的甲基化转录本编码的蛋白质参与信号传导(MAPK信号、激素信号)、苯丙酸通路、蔗糖和淀粉代谢、糖酵解和糖异生及转运(ABC转运蛋白)。GO分析表明,DEG参与氧化还原过程、转移酶和氧化还原酶活性以及跨膜转运。在大豆中,镉处理导致转录本中m6A的水平增加。甲基化转录本与植物激素信号、MAPK信号和病原互作等逆境和信号通路有关。此外,m6A转录本在蔗糖和淀粉、脂肪酸、氨基酸和氨酰tRNA的代谢通路中富集。高甲基化和下调的基因包括参与多胺分解代谢的基因,这些转录本表达减少导致多胺积累,并可能构成应激保护机制之一。有趣的是,在动物研究中发现了转录甲基化和组蛋白修饰之间的相关性。例如H3K36me3被转录甲基化机制识别,导致m6A沉积在新转录的RNA中。此外,还发现了组蛋白修饰蛋白的表达与转录甲基化的关系。还发现m5C与其甲基化机制之间的互作可能会影响染色质构象。
应激(包括金属胁迫)的典型响应之一是ROS稳态失调,可能导致氧化损伤。另一方面,ROS也可以作为信号分子参与应激信号转导和基因表达调控。在核糖核酸上也可发生氧化,从而形成8-羟基鸟苷(8-OHG)。在大豆幼苗中,Cd和Pb短期处理可诱导总RNA和/或poly(A)RNA中8-OHG的积累。且响应快速,仅在金属暴露数小时后即可观察到,且先于氧化应激症状。然而,这种早期8-OHG形成在植物中的确切作用仍有待揭示。
一些研究表明,转录本修饰可能在植物对金属响应中发挥重要作用。这一假说得到了其他RNA修饰,即5-甲基胞嘧啶(m5C)和8-硝基鸟苷(8-NO2-G)在植物胁迫响应中的支持。RNA m5C甲基转移酶的敲除导致拟南芥中m5C水平降低,对氧化胁迫的敏感性提高,水稻的耐热性降低。以水稻为例,突变体的特点是光合作用相关基因表达较低。转录本上m5C水平变化导致光合作用装置无法适应胁迫条件。此外,光合作用过程的功能失调导致ROS积累增强并形成氧化依赖性损伤。接种病原菌Phytophthora infestans后,马铃薯植株总RNA和mRNA中的8-NO2-G修饰水平增加。与敏感品种相比,抗Phytophthora马铃薯品种的响应显著更高,表明转录本中8-NO2-G的积累与防御机制有关。此外,在植物病原菌结构(P. infestans)中也观察到8-NO2-G修饰,并且暴露于亚致死浓度的Cd诱导了这种类型的RNA修饰。
大多数RNA修饰的转运性质以及修饰转录本的快速转换表明,核苷酸修饰可能作为快速开关,调控植物代谢以适应发育和环境刺激的变化。然而这一假设需要更多的实验支持。
表观遗传学和表观转录组学变化与金属耐受性的关系
上述研究表明,非必需金属和类金属镉(Cd)、铅(Pb)、汞(Hg)、铝(Al)和砷(As)影响DNA甲基化水平和模式以及组蛋白和转录本修饰,从而引起表观遗传和表观转录组学变化。这些变化可能与金属耐受性提高有关。例如,与更敏感但关系密切的植物物种拟南芥(Arabidopsis thaliana)相比,金属超积累植物Noccaea caerulescens表现出更高的DNA甲基化水平和更低的DNA损伤。与亲本品种相比,红麻F1杂交种的差异甲基化模式和更高的金属耐性得到验证。此外,对拟南芥的研究表明,抑制DNA去甲基化过程可以增强对金属的耐受性。
可能存在多种依赖于表观遗传和表观转录组学变化的保护机制。首先,甲基化可能影响DNA对损伤的敏感性。甲基化沉默的拟南芥细胞悬浮培养物表现出较高的单碱基替换(SBS)率。盐胁迫进一步增强了这一效应。结果表明,DNA甲基化可能对突变具有保护作用。此外,还描述了组蛋白修饰与DNA损伤鉴定和修复之间的联系。
其次研究表明,在金属处理下差异甲基化的基因组区域包括转运蛋白基因。在拟南芥中,VIM1蛋白的过表达导致NIP3启动子区域的甲基化增强;1转运蛋白基因导致其表达降低,阻碍As吸收,从而在As处理下增加生长参数。类似的甲基化依赖机制也可能在植物对其他金属响应中发挥作用。此外,转运蛋白基因的表达可能受转录本甲基化调控。在大麦中,镉处理导致编码ABC和锌转运蛋白的基因的高甲基化和同时诱导表达。
最后,DNA和RNA甲基化导致应激信号和防御相关基因表达的调控。WGBS分析揭示了植物对Cd、Pb、Al和Hg处理的数千个差异甲基化区域。在水稻中,大部分(近70%)的镉敏感基因也存在差异甲基化。此外一些参与应激响应和解毒过程的基因,即编码脂氧合酶(LOX)或谷胱甘肽S-转移酶(GST,GSTU 35)基因,其特征是甲基化和转录水平的Cd依赖性增加。另一项对水稻的研究表明,在Hg处理下,与氧化应激相关的基因在抗Hg系中低甲基化,而在易感系中高甲基化。在耐镉性较高的红麻杂种F1中,金属暴露导致Nrf2.7基因甲基化程度降低,表达增强,Nrf2.7基因编码的NRT1/PTR家族蛋白参与硝酸盐、氨基酸和植物激素的转运。NPF2.7基因沉默导致对Cd响应产生更大的生长抑制和氧化应激增强,突出了其在植物金属耐受中的重要作用。转录本甲基化模式的变化也可能影响基因的表达。在大麦中,m6A富集主要与较高的转录本丰度相关。镉暴露导致WRKY和MYB家族的谷胱甘肽S-转移酶和应激相关转录因子的转录本甲基化,并伴随其水平升高。在MAPK和过氧化物酶编码基因中,在大多数情况下观察到类似的模式,虽然在个别基因中表现出低甲基化和转录水平下降。另一方面,在大豆中,50%差异甲基化和表达的转录本表现出高甲基化和下调。高甲基化和下调的基因包括硫氧还蛋白过氧化物酶、过氧化物酶、多胺氧化酶以及与植物激素和钙信号相关的基因。
重要的是,DNA甲基化和基因表达模式中的金属依赖性变化可以遗传给下一代,影响他们未来的应激响应。在水稻中,Hg处理的DNA甲基化模式至少部分地传递到S1和S2代。此外植物表现出基因表达的遗传变化和对金属的更高耐受性。
然而与耐受相关的DNA甲基化变化仅限于特定位点。整体的全基因组DNA甲基化变化可能是甲基化/去甲基化相关基因异常表达的结果。这种变化包括基因表达的巨大改变和植物功能失调。此外,推测DNA甲基化的整体调控可能引起基因组的稳定性失调,并导致染色体重排。在人类中,甲基化的整体缺失与面部异常综合征(ICF)发生有关。DNA甲基化变化也可在其他疾病中观察到,包括癌症、心血管疾病、II型糖尿病、狼疮和精神分裂症。因此,植物中金属可能作为“毒甲基化(toxicomethylomic)”因子影响甲基化/去甲基化过程的基因表达。同时又会导致整体甲基化状态变化、众多基因表达失调,并影响基因组的稳定性。
结论
大量文献提供了非必需金属和类金属影响细胞DNA甲基化状态的证据。然而DNA甲基化变化的确切模式取决于各种因素,包括植物种类、应用处理的金属、金属浓度和处理持续时间。此外金属敏感品系和耐受金属品系之间,如在小黑麦或水稻中,甚至在亲本和杂种F1之间,观察到显著差异(表1)。金属对组蛋白修饰的影响研究相对较少,但对必需金属的影响被证明在转录和转录后水平上调控与组蛋白生物合成和修饰相关的基因的表达。因此,组蛋白修饰(甲基化和乙酰化)模式也受金属调控。表观转录组学变化是植物胁迫生物学领域中相对较新的研究方向。近期第一个表观转录组学文献报告结果表明,Cd暴露可调控大麦和大豆植株中转录本m6A甲基化的模式。Cd和Pb处理也会导致氧化依赖性RNA修饰8-羟基鸟苷(8-OHG)水平的早期增加,尽管8-OHG在金属响应中的作用仍有待阐明。表观遗传和表观转录组学变化有助于增强植物对金属的耐受性,例如通过保护DNA免受损伤、调控与金属转运相关的基因表达、细胞信号和胁迫防御,从而阻碍金属吸收和更有效的细胞间分布以及积累保护性化合物(例如黄酮类化合物)。
图1总结了植物对金属的表观遗传和表观转录组学响应。虽然在理解植物表观遗传和表观转录组学变化对金属(包括非必需金属)响应的作用方面取得了重大进展,但仍有许多问题有待解决。
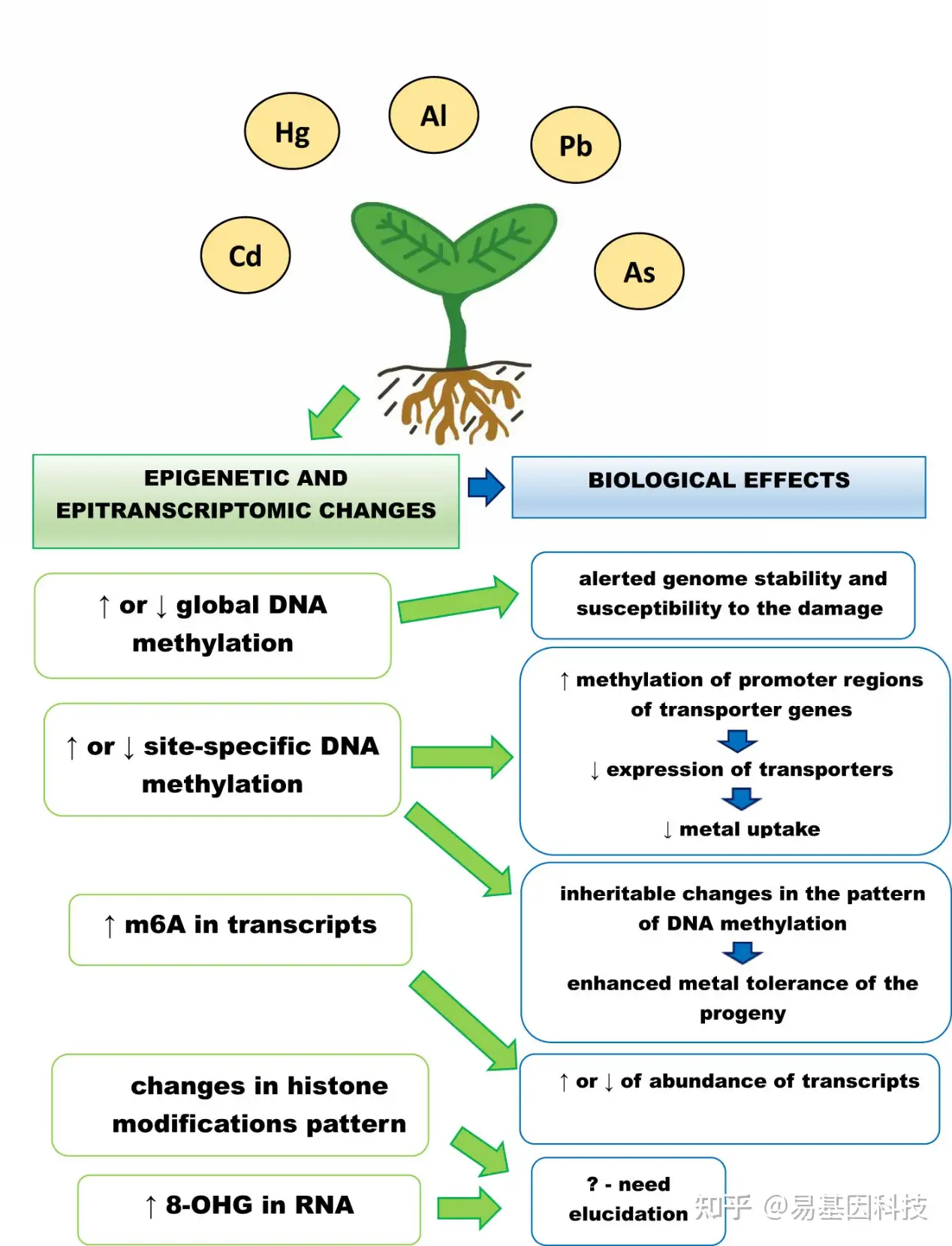
图1:植物对金属的表观遗传和表观转录组响应。
↑ - 水平增加,↓ -水平降低,m6A–腺苷在N6位甲基化,8-OHG – 8–羟基鸟苷。
暴露于金属导致整体和位点特异性DNA甲基化水平变化,取决于植物物种、应用的金属、金属浓度和处理持续时间。转运蛋白启动子区域甲基化增加导致其表达降低和金属吸收减少。
DNA甲基化变化模式可遗传给后代,可能与其增强的金属耐受性有关。金属暴露还会引起组蛋白修饰模式变化和RNA修饰水平的增加:m6A和8-OHG。这些变化的确切作用仍不清楚。然而,m6A增加和高丰度的甲基化转录本相关,如参与信号传导、转运和碳水化合物代谢。
首先,大多数情况下尚不清楚表观遗传变化是金属毒性的症状还是与获得应激耐受相关的调控效应。一方面,有假设指出特定区域或转录本的表观遗传和表观转录组学修饰参与信号和应激防御网络的激活。此外,研究表明,特定DNA区域甲基化影响转运蛋白基因表达,并可能调控金属吸收和细胞内沉积。另一方面,与甲基化/去甲基化过程相关的基因表达中的金属依赖性改变可能导致DNA甲基化水平的整体变化,从而导致基因表达的巨大变化。这将干扰正常的植物功能,并被视为毒性症状。此外,DNA甲基化水平的整体变化影响遗传物质的稳定性,并可能导致其更易受到损害。表观遗传和表观转录组学修饰的有利或不利影响可能取决于一些内部和外部因素,包括植物种类、发育阶段、应用的金属类型和应激强度。上述假设需要实验支持。
其次,导致参与DNA甲基化/去甲基化过程的基因的控表达通路尚未阐明,尽管有假设指向ROS和RNS的作用。对美洲商陆(pokeweed)(Phytolaca americana)的一项研究表明,NADPH氧化酶抑制剂(ROS生成的主要成分)的应用导致CMT2、CMT3、MET1和ROS1表达降低。RNS还可能对组蛋白修饰和DNA甲基化状态发挥调控作用。例如,最近在马铃薯免疫中记录了一氧化氮对调控DNA(去)甲基化基因的相关影响(与组蛋白甲基化对话)。在拟南芥中,一氧化氮通过抑制组蛋白去乙酰化酶活性在与应激响应相关基因上诱导组蛋白高乙酰化得到验证。
microRNAs(miRNAs)可以介导DNA甲基化。金属在拟南芥(Arabidopsis thaliana)、菜豆(Phaseolus vulgaris)、苜蓿(Medicago truncatula)、油菜(Brassica napus)、水稻(Oryza sativa)和烟草(Nicotiana tabacum)等多种植物中诱导miRNA表达上调或下调。在金属胁迫下,miRNA是参与金属吸收和螯合、信号传导、基因调控和解毒过程的调控因子。然而,这些RNA物种在金属依赖性甲基化中的作用仍不清楚。这一领域需要进一步探索,特别是考虑到miRNA在其他胁迫条件下可以调控DNA甲基化。在大麦中,干旱诱导的24mer靶向HvCKX2.1启动子区,进一步分析揭示了干旱导致HvCKX2.1甲基化增加,指出可能存在miRNA依赖性甲基化过程。
因此,需要开展更多的实验工作以深入了解暴露于金属的植物表观遗传和表观转录组学修饰的机制和作用。这些结果可以通过调控表观遗传和/或表观转录组学通路,或选择具有特定表观遗传修饰模式的植物进行进一步育种,从而培育出更耐受的植物。
易基因科技提供全面的表观遗传学研究整体解决方案,详询易基因:0755-28317900。
参考文献:
Chmielowska-Bąk J, Searle IR, Wakai TN, Arasimowicz-Jelonek M. The role of epigenetic and epitranscriptomic modifications in plants exposed to non-essential metals. Front Plant Sci. 2023;14:1278185. doi: 10.3389/fpls.2023.1278185. PubMed PMID: 38111878.
相关阅读:
【Nat Immunol】新兴表观遗传学标记物:DNA羟甲基化方法综述和最新应用!
表观遗传学与脑卒中:DNA甲基化的作用及衰老对血脑屏障修复的影响



