5mC DNA甲基化介导茶树组织功能分化和重要风味物质合成调控|植物研究
大家好,这里是专注表观组学十余年,领跑多组学科研服务的易基因。
在植物中,5mC DNA甲基化修饰(简称5mC甲基化)是一个重要而保守的表观基因标记,参与基因组稳定性、基因转录调控、发育调控、非生物胁迫响应、代谢物合成等多种调控。茶树(Camellia sinensis(L.)O.Kuntze)是一种缺乏成熟遗传转化系统的非模式作物,迄今为止,对这种重要饮料植物的表观遗传学维度的研究很少。5mC甲基化在茶树生长发育(采前加工)以及采前和采后加工中风味物质合成中的作用尚不清楚。
2023年08月01日,中国农业科学院农业基因组所孔维龙为第一作者和通讯作者、中国农业科学院农业基因组所张兴坦研究员为共同通讯作者在《Hortic. Res.》杂志在线发表了题为“5mC DNA methylation modification-mediated regulation in tissue functional differentiation and important flavor substance synthesis of tea plant (Camellia sinensis L.)”的研究论文,该研究利用全基因组重亚硫酸盐测序(WGBS)和对应的转录组测序分析等实验揭示了5mC DNA甲基化修饰介导的茶树组织功能分化和重要风味物质合成调控机制。

标题:5mC DNA methylation modification-mediated regulation in tissue functional differentiation and important flavor substance synthesis of tea plant (Camellia sinensis L.)(5mC DNA甲基化修饰介导的茶树组织功能分化和重要风味物质合成调控)
发表期刊:Horticulture Research
发表日期:2023年08月01日
影响因子:IF 8.7/ 1区
技术:全基因组重亚硫酸盐测序(WGBS)、RNA-seq、代谢组等
样品及方法:
以国家品种“铁观音”乌龙茶为材料,采叶标准为一芽二叶或三叶。所有新鲜的叶子都在下午4点左右采摘(新鲜样本)。收获后的鲜叶先在阳光下萎凋35分钟,然后转移到室内萎凋15分钟(萎凋处理样本)。萎凋后,用摇床以25 r/min对茶叶进行三次摇动(摇动处理样本)。随机采集100g样品作为新鲜、萎凋和摇动的三个处理样品,每个处理设置三个独立的生物学重复。共收集9个样本进行代谢组、RNA-seq和WGBS-seq测序。
摘要
本研究应用无偏好性的全基因组重亚硫酸盐测序(WGBS)对乌龙茶采摘后加工过程中的四个关键采前组织(根、叶、花和果)和两个加工叶片进行了全面的DNA甲基化分析。分析结果表明,四个关键组织之间的差异性5mC甲基化与组织功能分化密切相关,并且与非组织特异性表达基因相比,负责组织特异性功能的组织特异性基因维持相对较低的5mC甲基水平。根中CsAlaDC和TS/GS基因的低甲基化修饰为根中茶氨酸(theanine)的显性合成提供了分子基础。此外,对采集后叶片的5mC DNA甲基化组学、代谢组学和转录组学的综合分析表明,乌龙茶加工过程中风味代谢物含量变化与相应代谢物合成基因的转录水平变化密切相关,且这些重要合成基因的转录水平变化受5mC甲基化严格调控。进一步研究结果表明,加工过程中的一些关键基因受5mC甲基化调控,促进α-法尼烯(α-Farnesene)、橙花叔醇(nerolidol )、脂质(lipids)和茶多酚(catechins)等味觉物质的重要香气代谢物含量变化。本研究结果不仅阐明了5mC甲基化在采前和采后加工中重要风味物质合成中的关键作用,还为未来茶叶品质的改善或全组织高茶氨酸品种的选育提供了表观突变相关基因靶点。
研究结果:
(1)5mC甲基化在茶树采前组织功能分化中起重要调控作用
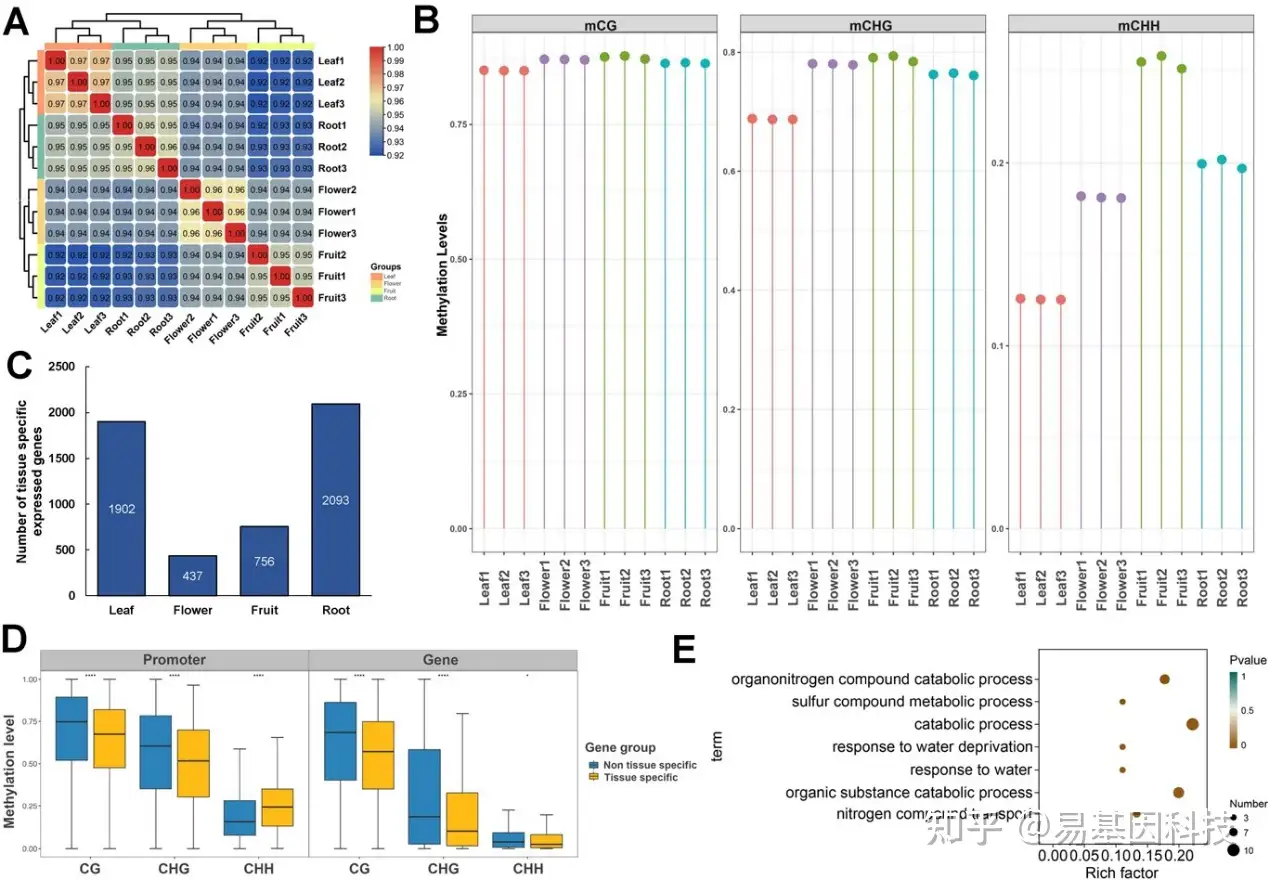
图1:茶树的四个关键采前组织中不同5mC甲基化水平
(A)不同组织的WGBS-seq数据的Pearson相关系数热图。
(B)组织中CHH、CHG和CG的甲基化水平。
(C)组织特异性表达基因数量。
(D)组织特异性和非组织特异性表达基因5mC甲基化水平差异。
(E)根组织特异性低甲基化基因的GO注释。
(2)5mC甲基化参与调控茶树根系中显性茶氨酸合成和非生物胁迫响应
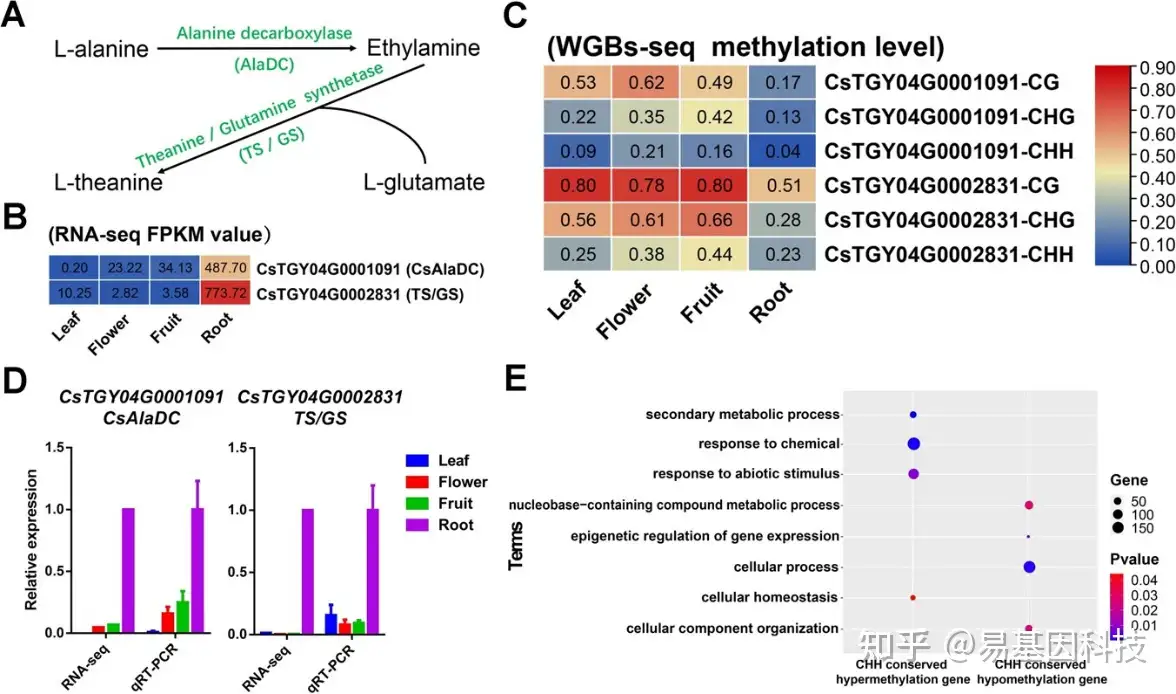
图2:5mC甲基化参与调控茶树根系中显性茶氨酸合成和非生物胁迫响应。
(A) 茶氨酸合成的关键底物和基因。
(B) CsAlaDC和TS/GS基因在四种茶树组织中的表达水平。
(C) 四种茶树组织中CsAlaDC和TS/GS基因的甲基化水平。
(D) CsAlaDC和TS/GS基因在四种茶树组织中的相对表达水平。
(E) 保守CHH高甲基化基因和低甲基化基因的GO注释。
(3)乌龙茶采后加工过程中应激引起的代谢物变化
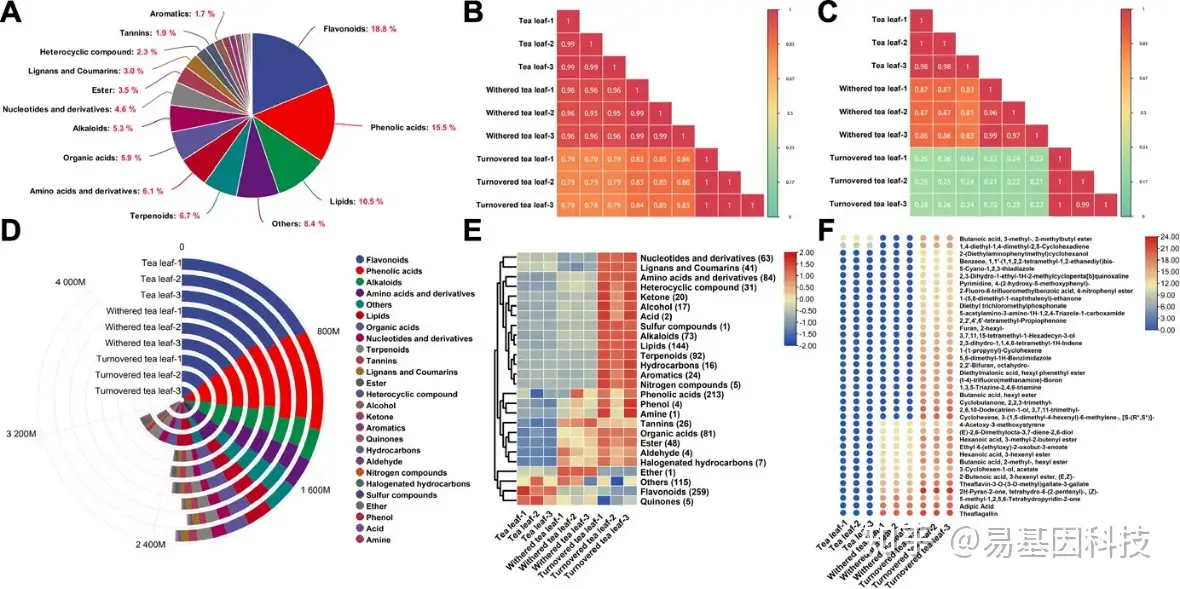
图3:乌龙茶采后加工过程中代谢物的变化。
(A) 1377种次生代谢物的分类。
(B) UPLC–MS/MS检测非挥发性代谢物含量的相关结果。
(C) GC–MS检测挥发性代谢物含量的相关性结果。
(D) 三个加工处理点所有代谢物的总含量变化。
(E) 三个加工处理点不同类别代谢物含量的变化。
(F) 各加工点新出现的代谢物。
(4)乌龙茶采后加工过程中差异代谢物及差异表达基因的鉴定
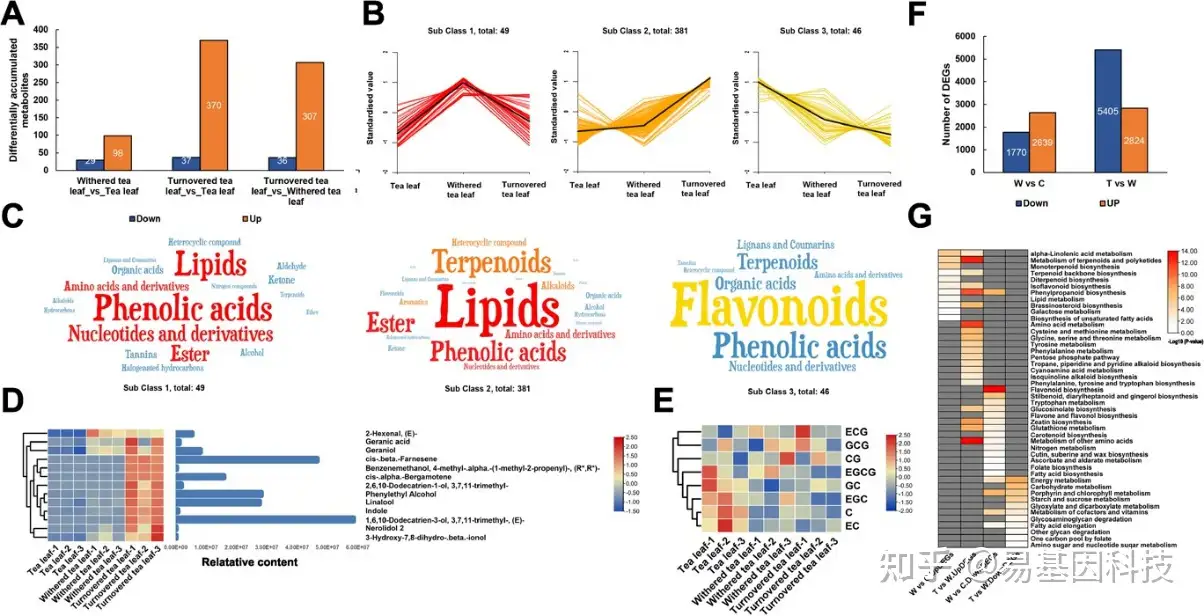
图4:乌龙茶采后加工中的差异代谢物(DMs)和差异表达基因(DEGs)。
(A) 不同加工处理点之间的次生代谢物差异。
(B) 所有差异次生代谢物的K-均值聚类。
(C) 各子类的词云图(Word cloud map)。
(D) 主要香气物质含量变化热图。
(E) 重要茶多酚含量变化热图。
(F) 不同处理点之间的DEG数量。
(G) DEG的KEGG富集通路。
C:新鲜茶叶;W:萎凋处理茶叶;T:摇动处理茶叶。
(5)乌龙茶采后加工中的单碱基分辨5mC甲基化模式
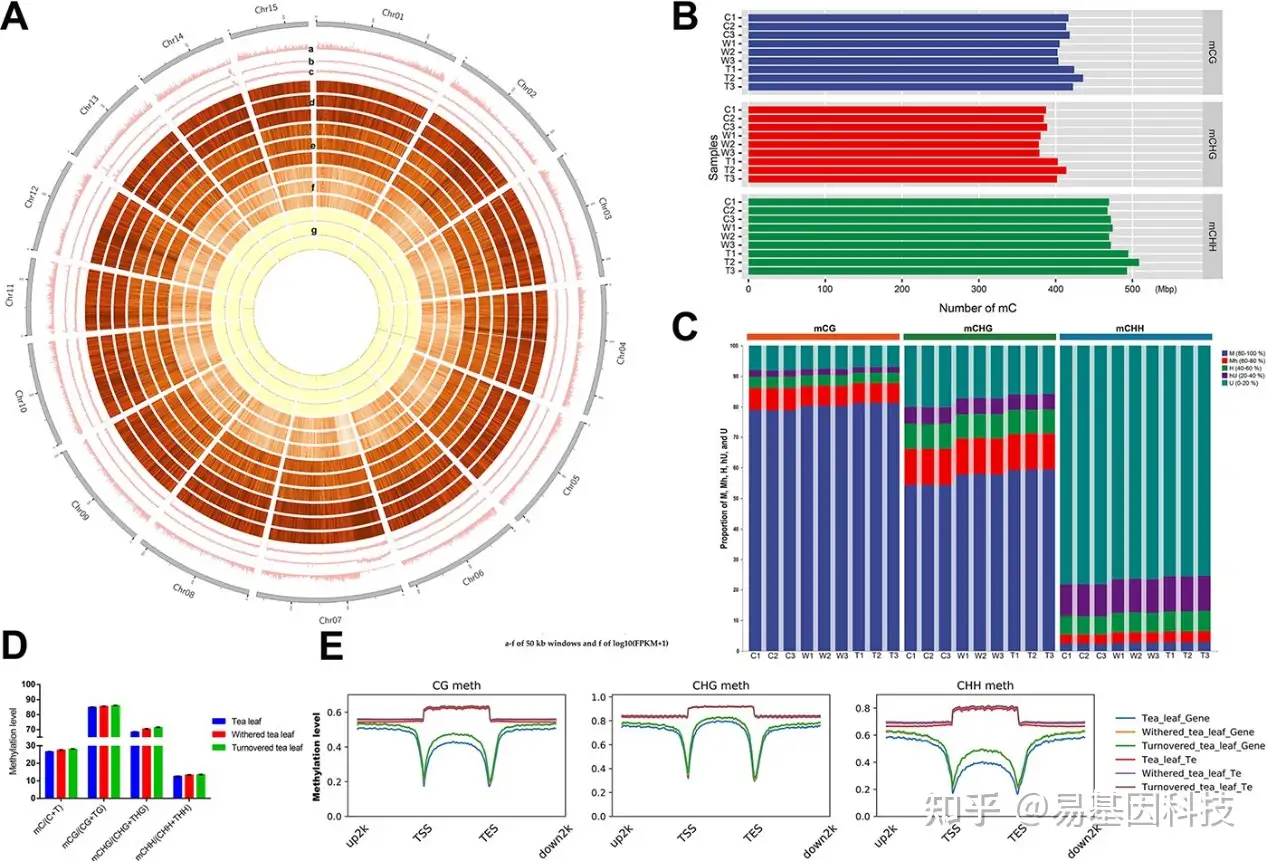
图5:乌龙茶三个重要加工处理点的单碱基分辨5mC DNA甲基化图谱。
(A) 基因密度(a)、转座子密度(b)、GC含量(c)、CG、CHH和CHG 5mC甲基化水平(d-f)和基因表达水平(g)的Circos图。在d–g中,从外到内依次为:新鲜茶叶、萎凋处理茶叶和摇动处理茶叶。
(B) 乌龙茶三个重要加工处理点的DNA甲基化水平。
(C) 乌龙茶三个加工处理点的甲基化胞嘧啶数量。
(D) 每个加工点5mC甲基化水平分类。
(E) 三个不同加工点的基因和转座子甲基化水平。
C和D中:C1–C3,新鲜茶叶;W1–W3,萎凋处理茶叶;T1–T3,摇动处理茶叶。
(6)5mC甲基化参与采后加工中风味物质相关基因表达的表观调控
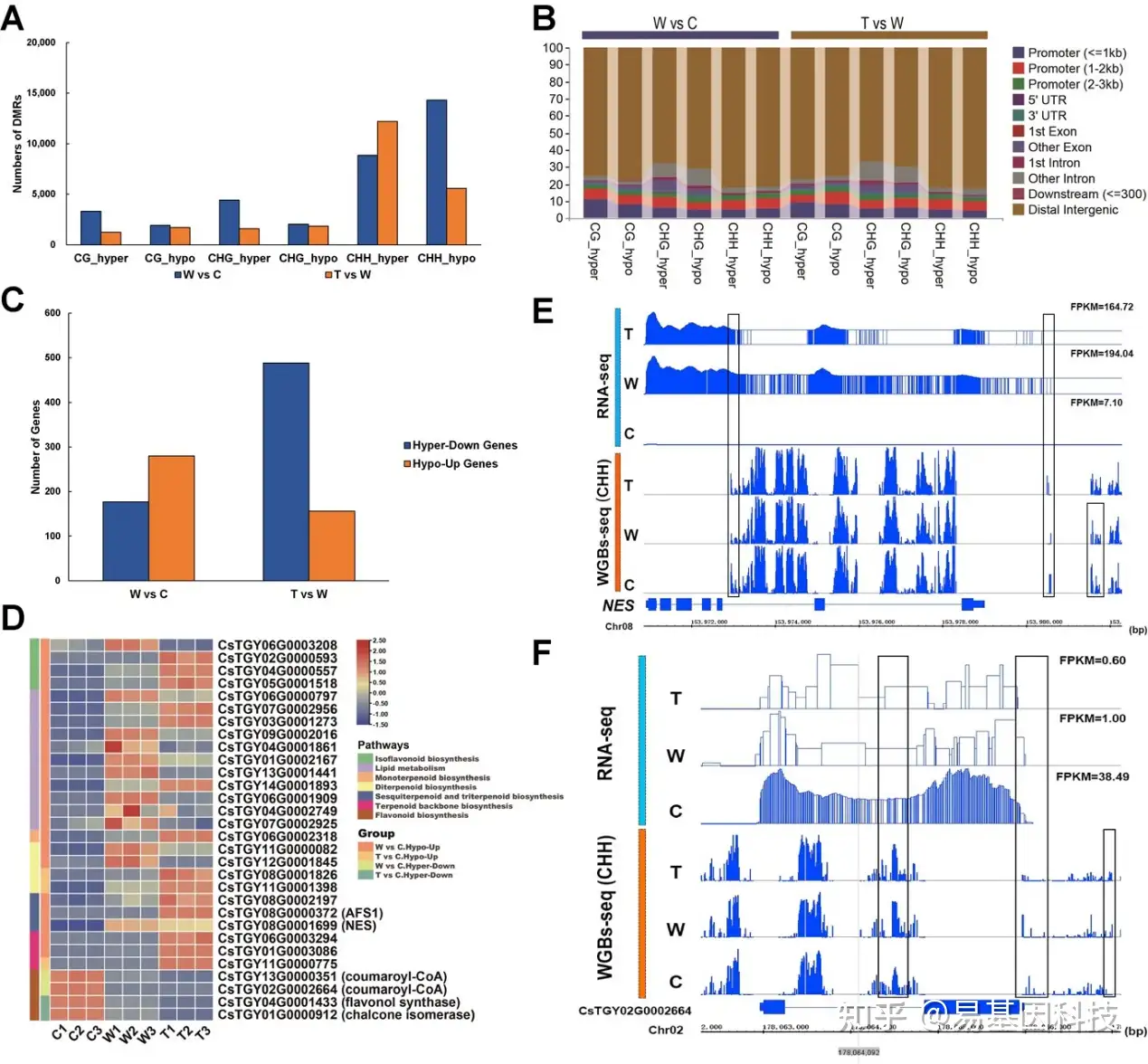
图6:乌龙茶加工过程中DMR和DMR介导的DEG。
(A) DMR的数量。
(B) DMR在基因组中的位置分布。
(C) DMR介导的DEG数量。
(D) DMR介导的与重要风味物质相关的DEG基因表达水平热图。
(E) 橙花叔醇合成酶(NES)基因的WGBS-seq(CHH)和RNA-seq数据的IGV(Integrative Genomics Viewer)可视化。(F) WGBS-seq(CHH)的IGV可视化和4-coumaroyl-CoA (CsTGY13G0000351)基因的RNA-seq数据。
关于易基因全基因组重亚硫酸盐测序(WGBS)
全基因组重亚硫酸盐甲基化测序(WGBS)可以在全基因组范围内精确的检测所有单个胞嘧啶碱基(C碱基)的甲基化水平,是DNA甲基化研究的金标准。WGBS能为基因组DNA甲基化时空特异性修饰的研究提供重要技术支持,能广泛应用在个体发育、衰老和疾病等生命过程的机制研究中,也是各物种甲基化图谱研究的首选方法。
易基因全基因组甲基化测序技术通过T4-DNA连接酶,在超声波打断基因组DNA片段的两端连接接头序列,连接产物通过重亚硫酸盐处理将未甲基化修饰的胞嘧啶C转变为尿嘧啶U,进而通过接头序列介导的 PCR 技术将尿嘧啶U转变为胸腺嘧啶T。
应用方向:
WGBS广泛用于各种物种,要求全基因组扫描(不错过关键位点)
- 全基因组甲基化图谱课题
- 标志物筛选课题
- 小规模研究课题
技术优势:
- 应用范围广:适用于所有参考基因组已知物种的甲基化研究;
- 全基因组覆盖:最大限度地获取完整的全基因组甲基化信息,精确绘制甲基化图谱;
- 单碱基分辨率:可精确分析每一个C碱基的甲基化状态。

易基因科技提供全面的DNA甲基化研究整体解决方案,详询易基因:0755-28317900。
参考文献:
Kong W, Zhu Q, Zhang Q, Zhu Y, Yang J, Chai K, Lei W, Jiang M, Zhang S, Lin J, Zhang X. 5mC DNA methylation modification-mediated regulation in tissue functional differentiation and important flavor substance synthesis of tea plant (Camellia sinensis L.). Hortic Res. 2023 Aug;10(8):uhad126.
相关阅读:
项目文章 | WGBS等揭示SOX30甲基化在非梗阻性无精症中的表观遗传调控机制
科研速递 | WGBS等揭示丹参甲基化表征及DNA甲基化在丹参酮生物合成中的调控机制


